替诺福韦酯阻断乙肝母婴传播的疗效评价
张玉蓉,彭孟云,尹 玥,汪 静
西南医科大学附属中医医院肝胆病科(泸州 646000)
乙型肝炎病毒(hepatitis B virus,HBV)感染是世界范围内一个重要公共卫生问题,我国是HBV感染的中高流行区,据统计目前HBV 感染人数约为7 000 万[1]。HBV 感染与肝硬化、肝细胞癌和肝衰竭的发展密切相关,严重威胁人们生命健康[2]。母婴传播是我国HBV感染的主要途径,有研究表明,经围产期母婴垂直传播感染HBV 的新生儿中有90%会发展为慢性,且其中15%~40%可能会发展为肝硬化和肝癌等终末期肝病[3,4],因此,阻断母婴传播是预防HBV 感染的重要手段。替诺福韦酯(tenofvir disoproxil fumarate,TDF)是目前国内外多数指南推荐用于母婴阻断的首选药物[5-6],多项研究表明其阻断效率高、安全性好[7-9],但对于阻断停药后乙肝母亲的病情变化目前尚缺乏长期随访研究,本研究采用TDF治疗妊娠中晚期HBV DNA高载量孕妇,观察TDF 阻断HBV 母婴传播的有效性、安全性及停药后乙肝母亲的病情变化,为我国乙肝母婴阻断研究提供循证医学科学依据。
1 资料与方法
1.1 研究对象
选取2017年9月至2019年6月于本院肝胆病科门诊接受TDF抗病毒治疗的慢性乙肝中晚期孕妇为研究对象(诊断标准参照中华医学会肝病分会及中华医学会感染病学会联合制定的《慢性乙型肝炎防治指南(2015 年版)》),本研究孕妇均知情同意并通过了医院伦理委员会批准。
纳入标准:①符合慢性乙型肝炎诊断标准;②HBV DNA载量>2×106IU/mL;③妊娠中晚期或孕周为28~42 周;④愿意接受TDF 抗乙肝病毒治疗;⑤有能力理解和签署知情同意书,遵守研究要求。
排除标准:①合并甲、丙、丁、戊型肝炎病毒及艾滋病病毒感染者;②因酒精、药物、自身免疫等其他原因所致肝脏损伤,或合并慢性重型肝炎、失代偿期肝硬化、肝癌等严重肝病;③有除肝炎以外的其他任何严重疾病,包括任何未被控制的有临床意义的心脏、肺、肾脏、消化、神经、精神疾病、免疫调节性疾病或恶性肿瘤;④过敏体质,对TDF 过敏者;⑤研究者认为对研究方案依从性差的受试者。
1.2 研究方法
口服TDF 联合标准的免疫预防进行母婴阻断:入组孕妇均予以TDF(正大天晴,300 mg,1 次/d)抗病毒治疗,至分娩当天停药。新生儿出生后均按照我国《慢性乙型肝炎防治指南(2015 年版)》采取标准的免疫预防措施,于出生24 h内分别注射乙肝疫苗10 μg及乙肝免疫球蛋白100 IU,并分别在1、6月龄时各注射1次乙肝疫苗(10 μg)。
1.3 观测指标
参考中华医学会《乙型肝炎病毒母婴传播预防临床指南(2020)》[6],入组孕妇于开始接受治疗时、分娩前、停药后1、3、12 月时进行血常规、谷丙转氨酶(ala⁃nine aminotransferase,ALT)、谷草转氨酶(aspartate ami⁃notransferase,AST)、血肌酐(serum creatinine,Scr)及HBV DNA 载量检测;新生儿分别于出生时、6 月龄、12月龄时进行乙肝两对半及HBV DNA 载量检测,HBV DNA 小于最低检测下限认为HBV DNA 阴性。停药后,观察随访所有产妇及新生儿12 个月,随访期间,若产妇出现肝功能恶化或有慢性乙肝再活动情况,则重新给予抗乙肝病毒治疗。研究期间,注意观察所有孕妇及新生儿的不良反应发生情况。
1.4 统计学分析
采用SPSS 22.0 进行统计学处理,计量资料以均数±标准差()描述,两个样本均数比较采用t检验;计数资料以相对数表示[n(%)]。P <0.05为差异具有统计学意义。
2 结果
2.1 基线及分娩前相关有效性指标的比较
与基线水平比较,经TDF治疗后,入组孕妇分娩前ALT 及AST 水平降低,差异均无统计学意义(P>0.05),分娩前HBV DNA载量水平下降明显,差异具有统计学意义(P<0.05),见表1。

表1 入组孕妇治疗前及分娩前血清ALT、AST及HBV DNA 水平比较Table 1 Comparison of serum ALT,AST,and HBV DNA levels in pregnant women before treatment and childbirth
2.2 新生儿母婴阻断情况
入组孕妇口服TDF 治疗后,从出生至12 月龄,新生儿血清HBsAg阳性率及HBV DNA ≥50 IU/mL比率均为0%(0/30),母婴阻断率达100%(30/30)。
2.3 不良反应
TDF治疗期间,入组孕妇中1例发生一过性肾功能不全,1例出现轻微头痛,经对症支持治疗后恢复正常,不良反应发生率为6.66%(2/30)。5 例产前血常规伴有白细胞升高,产后恢复正常,考虑为妊娠期生理性增高;1例分娩时出现胎膜早破,未发生产后出血等并发症。对所产新生儿的随访观察显示,所有新生儿的生长发育状况良好,未见畸形及发育异常。
2.4 停药后随访情况
停药后随访1~3 个月内,产妇HBV DNA 载量水平逐渐升高到产前水平,至停药后随访12个月,共计7例产妇出现肝功能异常(23.33%),其中2例轻度升高,未予治疗自行缓解,5 例(16.67%)重新给予抗乙肝病毒治疗后恢复正常。停药后随访过程中,所有产妇均未发现肾功能异常等不良反应,见表2。
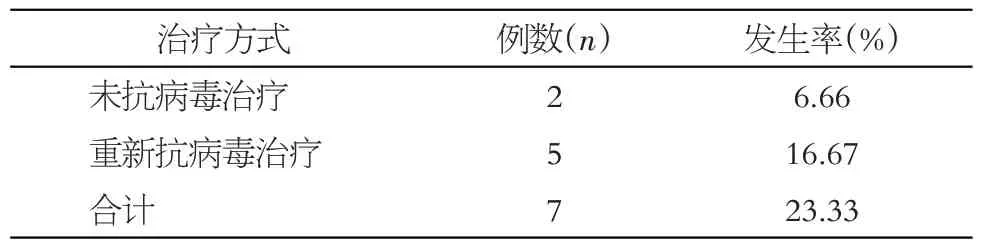
表2 停药后肝功能异常发生情况Table 2 Abnormal liver function after drug withdrawal
3 讨论
HBV 感染是全球性的公共卫生问题,也是导致肝硬化和肝癌的主要原因,我国是世界上HBV感染负担最重的国家,其中母婴传播是HBV感染的主要传播途径[10-11],因此,通过阻断母婴传播预防HBV感染是减少慢性乙型肝炎和肝细胞癌全球负担的最有效策略。在过去三十年里,我国在预防母婴传播方面取得了长足的进步,但在消除HBV母婴传播方面仍面临挑战[12]。
宫内感染和产时感染是乙肝母婴传播最常见的传播途径,因此,预防HBV感染应从其传播途径入手,包括孕期母亲进行抗病毒治疗和产后新生儿免疫接种。研究表明,仅单独进行新生儿免疫接种的母婴阻断效率并不理想,其中,产后免疫预防在大约5%-10%的婴儿中失败,而这种失败率在HBeAg 阳性且病毒载量高的母亲所生产的婴儿中更是高达30%[2,13-14]。因此,专家指出,对于HBV DNA 水平高于200,000 IU/mL 的母亲应积极接受抗病毒治疗,因为高病毒载量是免疫预防失败的最强独立危险因素[15]。
研究表明,高HBV病毒载量孕妇能够通过抗病毒药物治疗降低其HBV DNA水平从而降低HBV垂直传播机率[16]。TDF 是目前推荐用于预防HBV 母婴传播的首选药物,多项研究表明TDF阻断HBV母婴传播有效性及安全性良好[17-20],对胎儿发育无明显不良作用。且有研究发现在妊娠晚期接受或没有接受TDF 治疗的HBV感染母亲的孩子在分娩后6~7年内生长发育、肾功能和骨骼发育等方面无明显差异,表明TDF 亦具有较好的长期安全性[21],值得推荐用于母婴阻断。
本研究结果显示,所有入组孕妇口服TDF后,分娩前HBV DNA载量水平较治疗前明显下降,母婴阻断率达100%,且孕妇不良反应发生率较低,所产新生儿随访12 月内生长发育状况良好,未见畸形及发育异常,表明TDF 阻断乙肝母婴传播的有效性和安全性良好,与文献报道结果一致[22-23]。
但针对患有慢性乙型肝炎的孕妇服用TDF 阻断HBV母婴传播停药后的安全性研究,目前少有报道,故本研究从该角度出发进行初步探讨,结果发现,自分娩当日停药后1~3月内,产妇HBV DNA载量水平逐渐升高到产前水平,至停药后随访12月,共计7例产妇出现肝功能异常(23.33%),其中2 例经休息后自行缓解,5例(16.67%)再次给予抗乙肝病毒治疗后恢复正常,肝功能异常率与我国《乙型肝炎病毒母婴传播预防临床指南(2020)》[6]中所记载的20%接近。有研究显示,停药后肝功能异常与停药时间无显著关系,可能与HBeAg阳性、年轻患者、孕期ALT升高等因素有关[24-25],由于缺乏肝脏病理检查数据,对于HBV母婴阻断停药后肝功能异常的原因尚无法明确,后期可以寻找合适的无创检测方法,亦可扩大临床样本量,延长随访时间,并针对年龄、HBeAg 情况、孕期ALT 水平等进行分层研究,以进一步明确停药后肝功能异常的原因。
4 结论与启示
本研究结果提示,慢性乙肝孕妇中晚期口服TDF抗病毒治疗能够有效且安全地阻断HBV母婴传播,分娩后立即停药有一定肝功能异常风险,予以规范治疗后病情可控。同时,通过本研究,我们认识到在关注高HBV病毒载量孕妇所产新生儿是否感染HBV的同时,临床医师更应该关注分娩停药后的孕妇本身,包括产后安全性指标、肝炎活动情况、停药后抗病毒治疗情况及长期随访观察其肝硬化、原发性肝癌发生率等问题,为今后更进一步的临床研究提供科学数据支持。
(利益冲突:无)

