超低位去大骨瓣术联合亚低温治疗重症颅脑损伤
韩利彦 李 静 曹亚哲 王 东
石家庄市人民医院,河北 石家庄 050000
颅脑损伤是指头部遭受外界暴力后造成颅骨骨折、脑损伤及头部软组织损伤,发病率仅次于四肢骨折,多由各类意外事故所致。发生颅脑损伤后,患者可出现瞳孔变化、意识障碍、颅内压增高等典型症状,可出现脑疝、脑积水、感染等多种并发症,加重患者病情[1]。超低位去大骨瓣术是近年来临床治疗脑损伤的常用方法,其可快速消除脑肿胀导致的颅内高压,重建脑血流灌注,挽救患者生命[2]。亚低温常用于辅助治疗脑出血、脑外伤等中枢神经系统疾病,可有效减轻脑水肿,降低颅内压,保护脑组织功能,降低致死、致残率。研究显示血清胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)、S100B 蛋白(S100B)、血 小 板 反 应 蛋 白1(thrombospondin-1,TSP-1)水平与颅脑损伤具有密切关系,其值越高表示颅脑损伤越严重[3]。目前临床虽有关于超低位去大骨瓣术与亚低温联合治疗颅脑损伤的报道,但尚无对这3 种生化指标影响的深入研究。本研究观察超低位去大骨瓣术联合亚低温治疗重症颅脑损伤患者的临床疗效。
1 对象与方法
1.1 研究对象回顾性分析2019-01—2022-01 石家庄市人民医院收治的100 例重症颅脑损伤患者的一般资料,研究经院伦理委员会审核并批准。纳入标准:(1)符合相关临床诊断标准[4],经脑CT 确诊为颅脑损伤;(2)近期有颅脑创伤史,符合超低位去大骨瓣术指征;(3)年龄18~72岁,病例资料完整。排除标准:(1)严重脑血管疾病者;(2)合并恶性肿瘤、心肺等脏器功能严重异常者;(3)既往有脑卒中、颅脑手术史者;(4)凝血功能异常者;(5)合并神经系统疾病、精神疾病者;(6)妊娠及哺乳期患者;(7)对本研究所用药物过敏者。
1.2 一般资料对照组50 例,男36 例,女14 例,年龄18~72(43.62±8.33)岁;体 重 指 数(body mass index,BMI)17~26(21.57±3.81)kg/m2;受伤原因:高空坠落19 例,交通事故20 例,外物撞击11 例;损伤类型:闭合性损伤26 例,开放性损伤24 例。联合组50例,男35 例,女15 例,年龄18~72(45.02±8.65)岁;BMI 17~26(21.35±3.69)kg/m2;受伤原因:高空坠落21 例,交通事故19 例,外物撞击10 例;损伤类型:闭合性损伤29 例,开放性损伤21 例。2 组患者基本资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组患者基本资料比较Table 1 Comparison of basic data between the two groups
1.3 治疗方法2 组患者入院后均给予静脉补液、吸氧支持,密切监测生命体征变化,根据病情确定治疗方案。对照组给予超低位去大骨瓣术治疗,具体方法:患者取仰卧位,气管插管后全身麻醉,使头偏向侧位45°左右,手术侧肩垫高约20 cm,从颧弓上耳屏前做切口并以问号形状在同侧顶结节前切开,向前至额骨颧突后部,向下平颧弓上缘,向上至额顶部开骨窗。骨窗应充分暴露蝶骨嵴,并将蝶骨嵴中外部分咬除,扩大颅骨骨窗,形成超低位大骨瓣。行硬膜扩大减压,然后减张缝合硬膜,切开颞肌筋膜放置引流管。联合组予以超低位去大骨瓣术+亚低温治疗,手术方法与对照组一致。
亚低温治疗方法:采用温床对患者进行降温,使患者肛温维持在34~35 ℃,同时采用盐酸哌替啶(宜昌人福药业有限责任公司,国药准字H42022074,型号:2 mL:0.1 g)0.05 g,氯丙嗪(江苏吴中医药集团有限公司苏州制药厂,国药准字H32022769,型号:2 mL:50 mg)25 mg,异丙嗪(西南药业股份有限公司,国药准字H31021490,型号:1 mL:25 mg/支)25 mg 肌内注射,q8h,持续治疗7 d。
1.4 评估临床疗效随访3 个月,参照临床疗效判定标准[5]:(1)无效:3 个月后患者仍意识模糊,格拉斯哥昏迷量表(Glasgow coma scale,GCS)[6]评分改善<2 分,临床症状无好转或出现恶化及死亡;(2)有效:3个月后临床症状明显好转,GCS评分升高2分以上;(3)显效:3个月后临床症状基本改善,意识清晰,可正常生活。总有效率=(显效+有效)/总例数×100%。
1.5 血清GFAP、S100B、TSP-1水平治疗前及治疗7 d后采集2组患者静脉血5 mL,以转速3 000 r/min、半径20 cm 离心10 min,离心操作后取上层血清标本,妥当保存待测。采用酶联免疫吸附试验法检测血清GFAP、S100B、TSP-1水平,所用试剂盒购自上海恒远生物科技有限公司。
1.6 炎性细胞因子水平治疗前及治疗7 d后采集2组患者静脉血3 mL,以转速3 000 r/min、半径20 cm离心10 min,得到血清标本,妥当保存待测。采用酶联免疫吸附试验法检测肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)水平,所用试剂盒均由赛默飞世尔科技公司提供。
1.7 认知功能及颅脑损伤程度评估治疗前及术后3个月采用简易智能精神状态检查量表(mini-mental state examination,MMSE)[7]对患者认知功能进行评估。该量表包含定向力(10 分)、记忆力(3 分)、注意力和计算力(5分)、回忆能力(3分)、语言能力(9分)5 个方面,总分30 分,≥27 分表示正常,<27 分表示存在认知功能障碍,得分越少表示认知功能障碍越严重。采用GCS 对颅脑损伤程度进行评估,该量表包含睁眼反应、运动反应、言语反应3 个方面,总分15分,分数越低表示颅脑损伤越严重。
1.8 并发症发生情况对所有患者随访3 个月,记录其并发症发生情况。
1.9 统计学分析采用SPSS 25.0 软件对数据进行统计分析,实验数据均符合正态分布,计量资料以均数±标准差(±s)表示,采取t检验;计数资料以率(%)表示,采取χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者临床疗效对比联合组临床总有效率(94.00%)明显高于对照组(80.00%)(P<0.05),见表2。
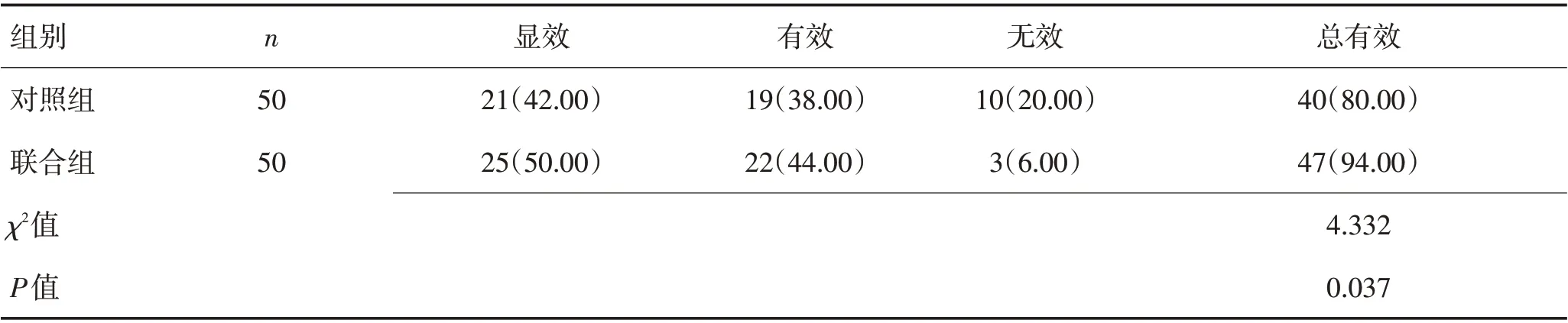
表2 2组患者临床疗效对比 [例(%)]Table 2 Comparison of clinical efficacy between the two groups [n(%)]
2.2 2组患者血清GFAP、S100B、TSP-1水平对比2组患者治疗7 d后GFAP、S100B、TSP-1水平均低于治疗前(P<0.05),且联合组治疗7 d 后GFAP、S100B、TSP-1水平较同期对照组降低更显著(P<0.05)。见表3。
表3 2组患者血清GFAP、S100B、TSP-1水平对比 (±s)Table 3 Comparison of serum levels of GFAP, S100B and TSP-1 between the two groups (±s)

表3 2组患者血清GFAP、S100B、TSP-1水平对比 (±s)Table 3 Comparison of serum levels of GFAP, S100B and TSP-1 between the two groups (±s)
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别对照组t值P值联合组t值P值TSP-1/(μg/L)170.63±30.57 139.88±28.49a 2.203 0.016 171.24±31.02 112.31±30.06ab 2.786 0.007 n 50时间治疗前治疗后50治疗前治疗后GFAP/(μg/L)5.64±1.62 2.86±0.91a 2.579 0.010 5.71±1.65 1.81±0.60ab 3.012 0.004 S100B/(ng/L)7.91±1.62 4.72±1.35a 2.697 0.009 7.89±1.70 3.54±1.12ab 2.926 0.005
2.3 2组患者炎性细胞因子水平对比2组患者治疗7 d后IL-8、TNF-α、IL-6水平均低于治疗前(P<0.05),且联合组治疗7 d后IL-8、TNF-α、IL-6水平明显低于同期对照组(P<0.05)。见表4。
表4 2组患者炎性细胞因子水平对比 (ng/L,±s)Table 4 Comparison of levels of inflammatory cytokines between the two groups (ng/L,±s)
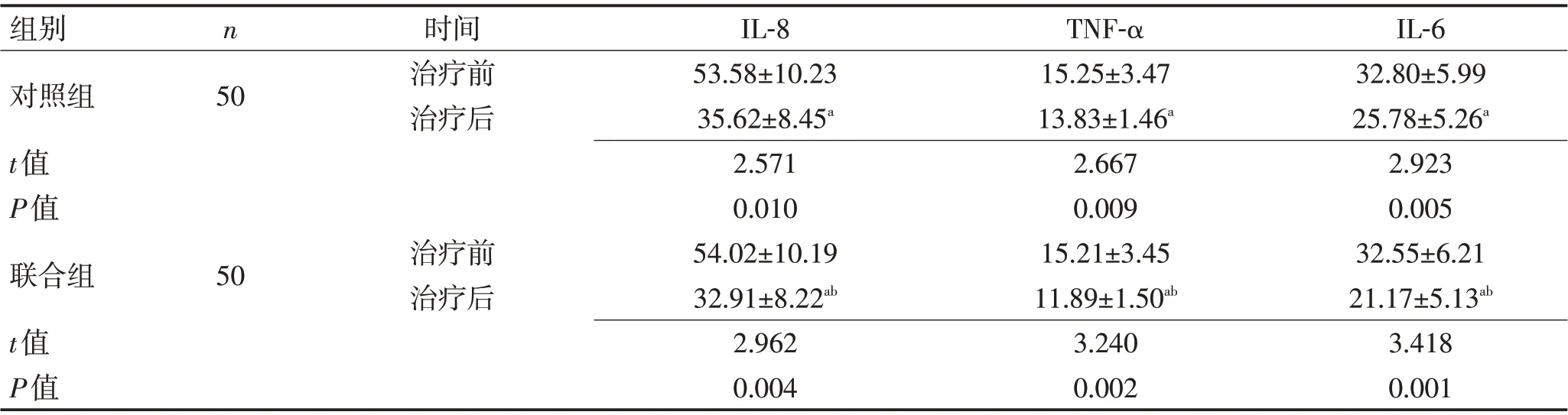
表4 2组患者炎性细胞因子水平对比 (ng/L,±s)Table 4 Comparison of levels of inflammatory cytokines between the two groups (ng/L,±s)
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别对照组t值P值联合组t值P值n 50时间治疗前治疗后50治疗前治疗后IL-8 53.58±10.23 35.62±8.45a 2.571 0.010 54.02±10.19 32.91±8.22ab 2.962 0.004 TNF-α 15.25±3.47 13.83±1.46a 2.667 0.009 15.21±3.45 11.89±1.50ab 3.240 0.002 IL-6 32.80±5.99 25.78±5.26a 2.923 0.005 32.55±6.21 21.17±5.13ab 3.418 0.001
2.4 2组患者认知功能及颅脑损伤程度对比较治疗前比较,2组患者术后3个月MMSE、GCS评分均有升高(P<0.05);与对照组治疗术后3 个月比较,联合组术后3 个月MMSE、GCS 评分提高更明显(P<0.05)。见表5。
表5 2组患者认知功能及颅脑损伤程度对比 (分,±s)Table 5 Comparison of cognitive function and degree of craniocerebral injury between the two groups (scores,±s)
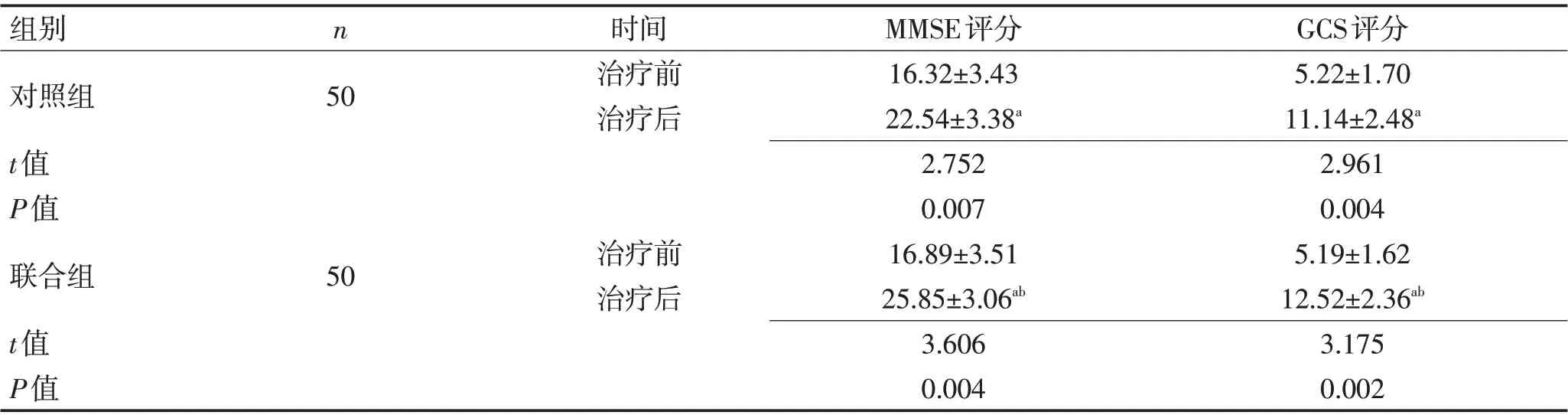
表5 2组患者认知功能及颅脑损伤程度对比 (分,±s)Table 5 Comparison of cognitive function and degree of craniocerebral injury between the two groups (scores,±s)
注:与治疗前比较,aP<0.05;与对照组比较,bP<0.05
组别对照组t值P值联合组t值P值n 50时间治疗前治疗后50治疗前治疗后MMSE评分16.32±3.43 22.54±3.38a 2.752 0.007 16.89±3.51 25.85±3.06ab 3.606 0.004 GCS评分5.22±1.70 11.14±2.48a 2.961 0.004 5.19±1.62 12.52±2.36ab 3.175 0.002
2.5 2组患者并发症发生情况对比对照组并发症总发生率为18.00%,联合组为4.00%,2 组患者治疗期间并发症总发生率比较,联合组明显低于对照组(χ2=5.005,P=0.025)。见表6。
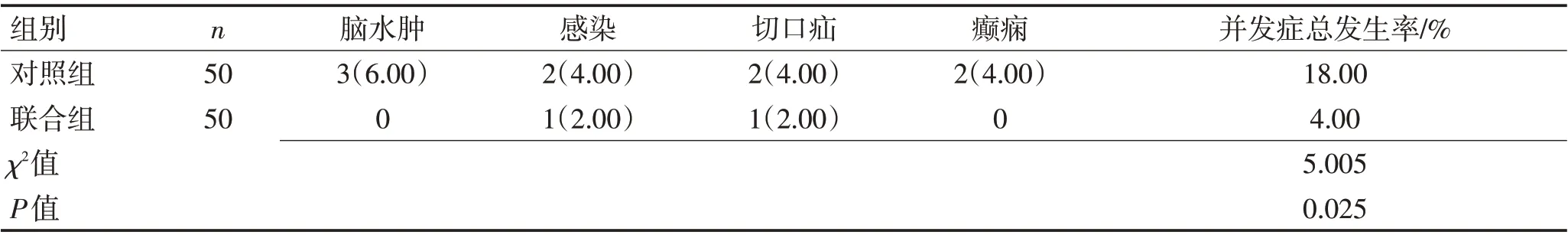
表6 2组患者并发症发生情况对比 [例(%)]Table 6 Comparison of complications between the two groups [n(%)]
3 讨论
颅脑损伤是指由交通事故、高处跌落、外物撞击等外力作用导致颅骨骨折或脑组织损伤[8]。根据病情严重程度患者可表现出恶心、头痛、意识障碍等临床症状,若未及时治疗,病情可进一步进展,引发脑疝等严重并发症,危及患者生命。临床需及时对颅脑损伤患者予以有效治疗控制病情,改善神经功能,减少并发症的发生。
目前颅脑损伤的治疗方法包括药物治疗和手术治疗。由于颅脑损伤后患者多出现血肿及脑挫裂伤继发脑水肿,可使颅内压升高,损害患者脑干及神经功能,临床根据患者病情严重程度多采用手术治疗。超低位去大骨瓣术是近年来治疗重症颅脑损伤患者的常用方法,通过进一步拓宽骨窗面积,有效降低颅内压,改善脑脊液及血氧循环,减轻脑肿胀,提高治疗效果[9-13]。亚低温治疗通过物理方法使患者肛温维持在较低水平,对脑缺血、脑出血等患者脑功能有明显的保护作用[14-18]。单一手术治疗后患者仍可能出现各种并发症,不利于大脑神经功能的恢复,临床可对术后患者予以脑功能保护治疗。研究显示对重型颅脑损伤患者予以外伤大骨瓣开颅术+亚低温治疗可明显提高治疗效果[19-21]。本研究发现,与对照组治疗7 d 后比较,联合组治疗7 d 后临床总有效率明显较高,且联合组术后3 个月MMSE、GCS 评分较同期对照组提高更明显,提示两者联合可有效改善颅脑损伤患者的认知功能和意识状况,减轻颅脑损伤程度,提高临床疗效。分析其原因,一方面,超低位去大骨瓣术可快速降低颅内压,解除脑组织压迫症状;另一方面,亚低温治疗通过将患者肛温维持在34~35 ℃,可调节脑血流,降低脑组织耗氧量,改善细胞能量代谢,减少兴奋性氨基酸的释放,抑制内源性毒素的产生及释放,保护神经元,从而促进患者脑神经损伤的修复,改善认知功能,提高治疗效果[22-28]。
研究发现血清GFAP、S100B、TSP-1 在神经系统疾病的诊断、治疗和预后方面发挥着重要作用[29-31]。GFAP是中枢神经系统星形胶质细胞活化的标志物,可有效判断患者颅脑损伤程度,水平越高表示颅脑损伤越严重。S100B是一种钙结合酸性蛋白,在细胞增生、分化、凋亡及基因表达中具有重要作用,颅脑损伤发生后患者血清S100B水平可快速升高。TSP-1是由被激活血小板、神经元等分泌的一种调节型细胞外基质糖蛋白,与创伤性疾病严重程度呈正相关。本研究显示,联合组治疗7 d 后GFAP、S100B、TSP-1水平较同期对照组降低更显著,提示亚低温治疗联合超低位去骨瓣术可降低颅脑损伤患者血清GFAP、S100B、TSP-1水平,减轻颅脑损伤程度。分析其原因,一方面,超低位去大骨瓣术有效降低了患者颅内压,促进大脑血液回流,有效改善了临床症状;另一方面,亚低温治疗可对神经细胞的进展及凋亡起抑制作用,通过改善脑组织耗氧及能量代谢,促使受损脑细胞及神经功能加速修复。两者联合有效减轻了患者颅脑损伤程度,从而降低机体血清GFAP、S100B、TSP-1水平[32-38]。本研究中联合组治疗7 d后IL-8、TNF-α、IL-6 水平明显低于同期对照组,这可能与亚低温治疗对脑损伤后炎性介质的生成具有明显的抑制作用,且两者联合有效改善患者颅内压及脑水肿症状,减轻颅脑损伤程度等有关[39-41]。联合组并发症发生率明显低于对照组,分析其原因,亚低温治疗属于物理疗法,安全性较高,不会增加对其他器官组织的损伤,将其应用于超低位去骨瓣术后颅脑损伤患者,可对脑神经功能起到明显的保护和修复作用,从而使术后并发症明显减少。
超低位去大骨瓣术联合亚低温治疗可降低重症颅脑损伤患者血清GFAP、S100B、TSP-1及炎症水平,促进患者脑神经功能恢复,改善其认知功能,疗效确切且安全性高。

