枯草芽孢杆菌分泌表达有机磷水解酶突变体和降解沙林活性的研究
顾恰敏,赵传欣,刘敏,3*,陈高云,李丹
(1.陆军防化学院,北京 102205;2.66072部队,北京 100041;3.国民核生化灾害防护重点实验室,北京 102205)
神经性毒剂对人类和社会有极大的危害,沙林作为经典的神经性毒剂,杀伤速度快、致死率高,寻找到能够高效降解神经性毒剂尤其是降解沙林的方法具有重要的现实意义。有机磷水解酶(Organophosphorus Hydrolase,OPH)广泛用于生物降解有机磷神经毒剂和生物技术洗消有机磷农药残留。OPH是一种最初从黄杆菌属和缺陷假单胞菌中分离纯化得到的酯酶[1-2]。OPH由有机磷水解酶基因(opd)编码,广泛存在于多种生物体内,具有较宽的底物范围,能够断裂P-O、P-S、P-F和P-CN等化学键[3]。这种酯酶可以水解包括有机磷神经性毒剂(如沙林、梭曼等)和对氧磷、对硫磷、甲基对硫磷等广泛使用的杀虫剂在内的有机磷酸酯类化合物。传统降解有机磷酸酯类化合物多采用化学法,即利用“三合二”等强氧化性物质催化水解。此类化合物大多具有强酸或强碱性,腐蚀性高,不适用于环境和精密仪器的洗消。酶类水解有机磷酸酯类化合物反应条件温和、无二次污染,对环境污染修复和保障人员健康具有重大意义。有机磷水解酶是一种公认的在处理有机磷酸酯类化合物方面很有前景的酶。但野生的有机磷水解酶活性不高、分泌表达不理想,不能满足实际应用的需要。本文通过蛋白质工程技术设计改良有机磷水解酶的结构和表达方式,寻找更加高效、广谱、经济和环保的降解有机磷酸酯类化合物的手段。
本文选用枯草芽孢杆菌表达体系分泌表达有机磷水解酶,以解决其在天然生物体中存在的产量低、纯化困难等问题。枯草芽孢杆菌是一种安全性高、遗传背景清晰、便于基因工程改造的革兰氏阳性研究模式菌[4],其无密码子偏爱性[5],多种外源基因都可以高效翻译表达[6],且对培养要求简单、操作方便。通用的大肠杆菌表达体系易形成无活性的包涵体[7],而枯草芽孢杆菌具有很强的蛋白分泌能力,可以将外源性的蛋白直接分泌到胞外且具有生物活性,这对蛋白质的后期纯化与实际使用有着重要的意义。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
枯草芽孢杆菌RIK1285(Bacillus subtilis)、载体pBE-S、有机磷水解酶基因及突变体,防化学院生物实验室保存;沙林(Sarin,GB)纯品,防化学院生物实验室储存。
质粒小提试剂盒、胶回收试剂盒、NdeⅠ内切酶、PstⅠ内切酶、T4DNA连接酶、DNA Marker及蛋白Marker,均采购自天根生化科技(北京)有限公司;NTA金属螯合亲和层析介质,购自中科森辉微球技术(苏州)有限公司。
1.1.2 仪器与设备
BSC-1000II超净工作台,苏州博莱尔净化设备有限公司;SynergyHTX/2/H1多功能微孔板检测仪,美国伯腾仪器有限公司;2720型PCR仪,美国应用生物系统公司;SPX智能生化培养箱,宁波海曙赛福实验仪器厂;LX-B立式压力蒸汽灭菌器,合肥华泰医疗设备有限公司;CR22G高速冷冻离心机,日本日立有限公司。
1.1.3 培养基配方
LB培养基(1 L):氯化钠10 g,酵母提取物5 g,蛋白胨10 g,pH值为7.4(加2%琼脂即为固体培养基)。
10×最低盐溶液(100 mL):14 g K2HPO4,6 g KH2PO4,2 g (NH4)2SO4,1 g柠檬酸钠(Na3C6H5O7·2H2O),0.2 g MgSO4·7H2O。
SPⅠ培养基:2 mg/mL L-色氨酸2.5 mL,10%酵母溶液1 mL,5%水解酪蛋白溶液0.4 mL,50%葡萄糖溶液1 mL,1×最低盐溶液95 mL。
SPⅡ 培 养 基:2 mg/mL L-色 氨 酸 0.5 mL,0.5 mol/L MgCl2溶液0.5 mL,0.1 mol/L CaCl2溶液0.5 mL,10%酵母溶液0.04 mL,5%水解酪蛋白溶液0.08 mL,50%葡萄糖溶液1 mL,1×最低盐溶液97.5 mL。
1.2 实验方法
1.2.1 构建蛋白表达质粒pBE-S-opd
根据载体pBE-S图谱,选择酶切位点,设计His标签在C端的引物,扩增野生型有机磷水解酶基因(opd)和含有H254R-H257Y-L303T突变位点的有机磷水解酶基因(RYT-opd)。引物序列片段见表1。

表1 引物序列片段
1%琼脂糖凝胶电泳回收目的片段。双酶切载体pBE-S和扩增产物,1%琼脂糖凝胶电泳后,回收酶切的质粒和目的基因片段。用T4连接酶将目的基因片段连接到pBE-S中,转化E.coliDH5α后,涂板含有氨苄青霉素的LB固体培养基平板,过夜培养后,挑取阳性单克隆,用含有氨苄青霉素的LB液体培养基平板,摇12 h后,提取质粒,对连入的目的基因进行测序验证,保存测序正确的单克隆质粒。
我把习惯上课回头的学生请到身边,告诉他我的所见:“我总是看到你上课扭过头来,后面的人并不理你啊,怎么回事呢?”我以为他会说课听不进去,想跟后面的人讲话。结果他说:“啊?我不知道,可能是习惯了。”扭头只是他的惯性动作,他潜意识里压根儿不知道自己扭头了。
1.2.2 转化B. subtilis RIK1285感受态细胞
在LB平板上划线活化RIK1285,放入37 ℃培养过夜。挑取活化的菌斑到2 mL液体LB培养基,28 ℃摇培16 h。取50 μL菌液到5 mL的SPⅠ培养基中,在37 ℃培养至菌体生长至对数期。将pBE-S-opd质粒转化到RIK1285感受态细胞刚稳定期。取0.5 mL的菌体到4.5 mL SPⅡ培养基,37 ℃培养90 min。加入50 μL的100 mmol/L乙二醇双(2-氨基乙基醚)四乙酸在37 ℃摇培5~10 min。将培养基按300 μL/支分装至10 mL圆底离心管。加入1 μg质粒DNA至1支分装的感受态细胞中,在30 ℃摇培90 min,然后涂板含10 μg/mL的卡那霉素(Ka)LB培养基,放入37 ℃过夜培养。挑取单克隆,37 ℃摇菌后,保存菌种,并用于后续实验。
1.2.3 OPH的分泌表达和收集
将转化后的RIK1285-pBE-S-opd株从-80 ℃冰箱取出,在LB+Ka(10 μg/mL)的平板划线,放入37 ℃培养箱倒置培养过夜。挑取平板上长好的单克隆,至600 mL LB液体培养基(1 L三角瓶,加入终浓度为10 μg/mL的Ka抗生素),放入37 ℃,180 r/min的摇床培养48 h。将培养好的菌液倒入500 mL离心瓶中(分2个离心瓶收集,每瓶250 mL菌液),配平后,8 000 r/min、25 ℃离心15 min,小心地将上清倒入干净的1 L三角瓶中,将沉淀弃掉。OPH分子量约为36 kD,将上清液用截留分子量为10 kD的超滤浓缩管在4 ℃,4 000 r/min离心浓缩至150 mL。
1.2.4 分泌蛋白的镍柱纯化
将总容积为20 mL的蛋白纯化柱固定在铁架台后,将NTA金属螯合亲和层析介质从4 ℃冰箱中取出颠倒混匀,取出5 mL NTA金属螯合亲和层析介质,加入蛋白纯化柱柱底,取下柱子下方的止水塞,将NTA金属螯合亲和层析介质中的乙醇沿重力自然流干,沿柱面轻轻加入15 mL裂解缓冲液,沿重力流干,然后再重复一次。分次将裂解的上清蛋白液轻轻沿柱面加入,重力过柱;沿柱面轻轻加入15 mL冲洗缓冲液1,沿重力流干;分别使用15 mL冲洗缓冲液2冲洗2次,15 mL冲洗缓冲液3冲洗2次;沿柱面分3次,轻轻加入15 mL洗脱缓冲液,收集流出液,即为纯化的蛋白。用ddH2O将截留分子量为10 kD的蛋白超滤浓缩管清洗2次,然后将蛋白加入到超滤管中,4 000 r/min、4 ℃离心约30 min,将蛋白浓缩至1.5 mL。
1.2.5 纯化蛋白浓度测定
考马斯亮蓝法:将2 mg/mL的BSA蛋白标准品梯度稀释后,向每个标准品中加入1 mL考马斯亮蓝蛋白浓度测定液;同样取20 μL待测样品,加入1 mL考马斯亮蓝染液,混匀后,吸出200 μL至平底透明96孔板中,检测595 nm下的吸光值。
1.2.6 重组有机磷水解酶的活性测定
沙林标准曲线的绘制:称取100 μg/mL的沙林标准液 0 μL、50 μL、100 μL、150 μL、200 μL 和250 μL,分别加入 0.01 mol/L PBS 溶液至 500 μL,再依次加入125 μL丙酮、125 μL 0.5%联苯胺水溶液和500 μL 0.25%过硼酸钠水溶液。测定406 nm处的吸光值。
联苯胺定量法检测酶活:过硼酸钠在碱性水中分解出过氧化氢,过氧化氢与G类毒剂作用生成过氧磷酸,此过氧磷酸有强的氧化能力,能氧化联苯胺生成有色的偶氮染料,并在波长406 nm处有特异吸收峰,检测样品在406 nm处的吸光值,进而计算剩余沙林的含量和酶的活性。
反应体系(1.25 mL):0.01 mol/L PBS溶液稀释酶液使蛋白质浓度一致;取250 μL稀释后酶液加入250 μL 100 μg/mL沙林,室温反应5 min后,依次加入125 μL丙酮、125μL 0.5%联苯胺水溶液和500 μL 0.25%过硼酸钠水溶液,测定吸光值并计算剩余沙林含量和酶的活性。将每分钟每毫克蛋白酶降解的沙林毫克数定义为有机磷水解酶的酶活单位。实验重复3次。
1.3 数据分析
BIOVIA Discovery Studio 2020 蛋白模拟软件。由NCBI数据库中查找野生型OPH结构,导入BIOVIA Discovery Studio后,修改OPH关键位置氨基酸,建模有机磷水解酶突变体结构,生成结构示意图,分析有机磷水解酶突变体的性质。
2 结果与分析
2.1 含有机磷水解酶基因的枯草芽孢杆菌
根据1.2.1及1.2.2构建含有机磷水解酶基因的枯草芽孢杆菌重组菌株,所获得的菌株提取质粒,经鉴定其基因序列与预期一致。质粒利用NdeⅠ和PstⅠ水解酶双酶切后,琼脂糖凝胶电泳图见图1。
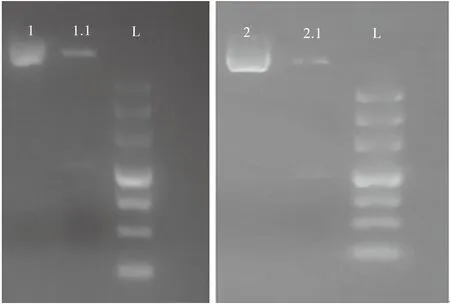
图1 质粒双酶切凝胶电泳图
2.2 有机磷水解酶蛋白浓度
根据1.2.5绘制蛋白曲线并确定纯化后的有机磷水解酶浓度。根据表2可得,蛋白的标准曲线方程为y=1.764 6x+0.002 6,相关系数R2=0.998。
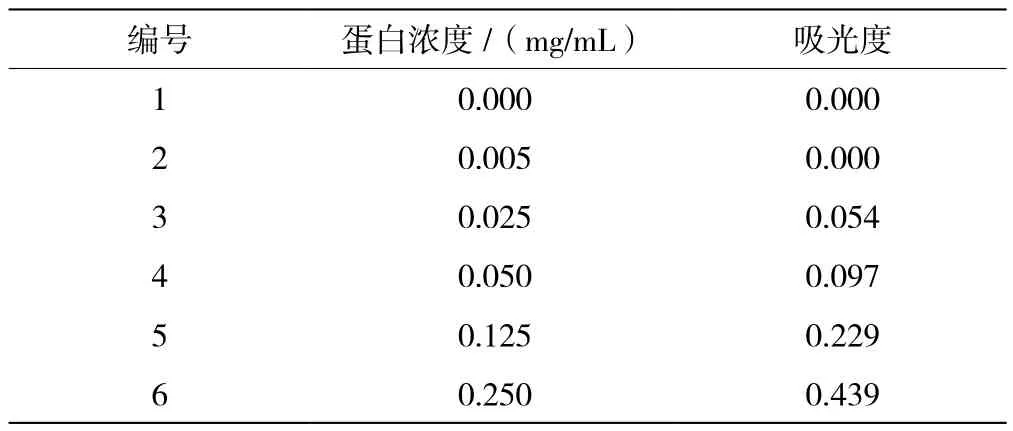
表2 标准蛋白溶液吸光度
纯化后野生型有机磷水解酶的蛋白浓度为0.461 mg/mL,含有H254R-H257T-L303Y突变位点的有机磷水解酶突变体的蛋白浓度为0.429 mg/mL。
2.3 有机磷水解酶水解沙林活性测定
根据1.2.6方法绘制沙林标准曲线,根据表3可得,沙林的标准曲线方程为y=0.003 2x+0.061 2,相关系数R2=0.995。
表3 沙林标准溶液吸光度
根据1.2.6测试枯草芽孢杆菌分泌表达的有机磷水解酶水解沙林的酶活性,实验结果见表4。5 min时,野生型有机磷水解酶对沙林的水解率为42.72%,酶活为 0.407 mg/(min·mg)。含有 H254R-H257YL303T突变位点的有机磷水解酶突变体对沙林的水解率为82.88%,酶活为0.790 mg/(min·mg),酶活提高了94.1%。实验表明,枯草芽孢杆菌所分泌表达的有机磷水解酶具有较好的酶活性,并且H254RH257Y-L303T三个突变位点联合突变,显著提高了有机磷水解酶降解沙林的能力。

表4 野生型有机磷水解酶和突变体水解沙林的能力
2.4 有机磷水解酶结构分析
通过BIOVIA软件对有机磷水解酶的结构进行分析,结构见图3。发现H254R-H257Y-L303T突变体的能量低于野生型有机磷水解酶,推测突变体的蛋白结构更加稳定,这对有机磷水解酶的储存、活性保持和热稳定性均有着积极的意义,是一种理想的突变方式。

图3 含H254R-H257Y-L303T突变位点的有机磷水解酶
3 结论
本研究成功构建了枯草芽孢杆菌分泌表达有机磷水解酶的表达体系,将有机磷水解酶基因插入pBE-S载体后转入枯草芽孢杆菌中。重组枯草芽孢杆菌表达体系培养48 h,通过超滤浓缩和镍柱纯化后,有机磷水解酶浓度为0.4 mg/mL。本研究构建的枯草芽孢杆菌分泌表达体系使得有机磷水解酶的获得和纯化更为简易快捷,为后续有机磷水解酶的实际应用和工业生产提供了一定的基础。
本研究在分泌表达野生型有机磷水解酶的基础上,选择了一种含有H254R-H257Y-L303T三个位点联合突变的有机磷水解酶突变体进行表达,并比较了突变体和野生型水解神经性毒剂沙林的水解效果。结果表明,5 min时,含有H254R-H257Y-L303T突变位点的有机磷水解酶突变体对沙林的水解率为82.88%,酶活为0.790 mg/(min·mg),比野生型有机磷水解酶的酶活提高了94.1%。H254R-H257YL303T三个位点联合突变是本课题组在前期单点突变的基础上构建的新突变组合。其中,H254和H257位点处于OPH的活性中心大疏水口袋(H254、H257和L271),通过分析蛋白质结构,将极性带正电荷且亲水的组氨酸突变为精氨酸和极性不带电荷且疏水的酪氨酸,这可能改变了疏水口袋的电荷情况并使疏水口袋的疏水性得到加强,促进了该口袋结构与底物分子取代基的作用。303位点处于小疏水口袋(M317、G60、I106、L303和S308),虽然在前期实验中,L303位点非极性的亮氨酸突变为极性的苏氨酸后,水解酶的水解能力受到抑制,但当H254R-H257Y与L303T联合突变,水解酶的水解能力得到了明显促进作用,这可能是因为H254R-H257Y与L303T联合突变同时改变了大小口袋,促进沙林水解键位的断裂和官能团的去除。
本实验构建了枯草芽孢杆菌分泌表达有机磷水解酶的表达体系并验证了所表达的有机磷水解酶具有良好的活性。分泌表达了含有H254R-H257YL303T三点突变的有机磷水解酶突变体,一定程度提高了野生型有机磷水解酶水解沙林的能力,表明改变有机磷水解酶的活性中心位点的氨基酸种类能够有效的影响其酶活性。后续研究中,可以结合蛋白质空间结构分析,筛选出更多的影响较大的活性位点和更加合理的突变氨基酸种类,以期找到更优的重组型和分泌表达体系。随着科研探索的逐渐深入,期望获得性能优良、底物范围广、实用价值高的水解酶,并能够将这些新型降解工具从实验室向实际应用推广,为降解神经性毒剂和杀虫剂等有机磷酸酯类化合物提供一个高效、经济、绿色、环保的新手段。

