吐纳麝香对东海原甲藻的毒性作用机制
曲玉楹,张彩杰,沈秋岑,张 婧,于 红
吐纳麝香对东海原甲藻的毒性作用机制
曲玉楹,张彩杰,沈秋岑,张 婧*,于 红
(中国海洋大学化学化工学院,山东 青岛 266100)
为研究吐纳麝香(AHTN)对海洋微藻的毒性作用机制,以东海原甲藻()为受试对象,测定5种浓度的AHTN(1,10,50,200和400μg/L)对微藻的生长、光合色素含量、细胞形态结构、细胞膜通透性、抗氧化系统和光合系统的影响.结果表明,AHTN显著抑制东海原甲藻的生长,对东海原甲藻具有高毒性(96h-EC50=48.21μg/L),其毒性作用机制为抑制光合色素产生,破坏其细胞结构和细胞膜完整性,诱发抗氧化系统响应,影响光合作用性能.其中,1μg/L AHTN处理对东海原甲藻生长有促进作用,1和10μg/L AHTN处理促进光合色素合成,并使超氧化物歧化酶活性和部分光合参数升高.低浓度AHTN(1μg/L)可能会诱导东海原甲藻赤潮爆发,高浓度AHTN(10~400μg/L)则会抑制该藻种群生长,从而对海洋生态系统产生潜在威胁.
吐纳麝香;东海原甲藻;毒性机制;抗氧化系统;光合性能
合成麝香(SMs)广泛使用于香水、洗发水、乳液、洗衣粉和除臭剂等[1],通过废水进入到各种环境,存在于地表水、海水、水体颗粒相、水体沉积物、大气样品及生物体中[1-2].在我国水环境中各类麝香被频繁检出,如广州的化妆品污水中含有高达595.48μg/L的SMs[3];Zhang等[4]在新加坡的海水样品中检测到8种合成麝香化合物,其中佳乐麝香和吐纳麝香的总浓度(溶解+颗粒)范围分别为1730~ 23300和270~1950pg/L,麝香酮浓度在170~1260pg/ L之间;王杰等[5]在胶州湾北岸潮间带沉积物中检出佳乐麝香、吐纳麝香和酮麝香3种麝香污染物,含量分别为1.84~4.35,n.d.~10.9和6.90~10.9ng/g[5].麝香具有较强的亲脂性和持久性,这些物质往往会从环境中进入水生生物体中积累,并随着食物链传递和放大[6].
在各类合成麝香中,多环麝香占市场的主导地位,其中吐纳麝香(AHTN)在环境和生物群中的浓度相对较高,经常在环境中被检测到[3,7].前期研究发现,AHTN具有雌激素效应,并且对水生动物有毒性[8];Parolini等[9]发现高浓度AHTN暴露会引起斑马贻贝脂质过氧化、蛋白质羰基化和DNA链断裂; Wollenberger等[10]的研究表明4种合成麝香对海洋桡足类幼虫的5d-EC50范围为0.03~0.16mg/L,能强烈抑制幼虫的发育.这些研究结果表明, AHTN对水生生物具有毒性效应,对水生生态系统存在潜在风险.
目前关于AHTN对海洋生物的毒性研究较少,缺乏毒性数据和水生生物标准,因而对AHTN进行环境风险评估存在困难[8].海洋微藻是海洋生态系统的初级生产者,其对水质具有敏感性,经常被用作生态毒理实验的目标微生物.因此本文以长江口海域的优势赤潮藻东海原甲藻为研究对象,结合微藻生长情况、光合活性、氧化应激、细胞膜完整性及形态结构等参数探究AHTN暴露对海洋微藻的毒性及作用机制,旨在为AHTN在长江口等近岸海域生态系统中的风险评价提供毒性数据.
1 材料与方法
1.1 实验材料
东海原甲藻()购自上海光语公司.藻种培养采用添加f/2培养基的灭菌天然海水,使用锥形瓶置于光照培养箱(GXZ-380B,宁波江南仪器公司,中国)中摇床震荡培养,培养温度(21±1)℃,光照强度3000lux,光暗比为12h:12h.吐纳麝香(AHTN)为标准品(分子式C18H26O),购自美国霍尼韦尔公司;使用二甲亚砜(DMSO)为助溶剂配制母液,购自上海沪试公司,为分析纯.
1.2 毒性生长实验
将东海原甲藻培养至对数生长期进行实验.将藻液分装于250mL锥形瓶,每瓶100mL,初始密度为4.5×104cells/mL.根据预实验设计AHTN浓度梯度(对藻类生长产生0~100%抑制效应),共设置1个对照组和5个处理组(1,10,50,200和400μg/L),对照组添加0.1%的DMSO以消除溶剂影响(经预实验,该浓度的DMSO对东海原甲藻无生长抑制),每组3个平行.实验条件与培养条件一致,共培养96h,每24h取样,使用流式细胞仪(Accuri C6Plus,BD,美国)计数并绘制生长曲线,比生长率()使用藻细胞密度均值计算,公式如下:
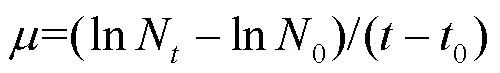
式中:N和0分别代表时刻和0时刻(初始接种)的藻密度.抑制率计算如下:
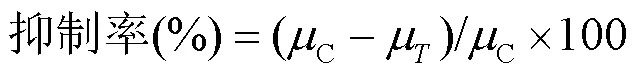
式中:C和μ分别代表对照组和实验组的比生长率平均值.使用概率单位-浓度对数法计算96h的半最大效应浓度(96h-EC50).
1.3 生理生化参数测定
1.3.1 光合色素含量测定 采用丛海兵等[11]的方法测定不同浓度AHTN胁迫对东海原甲藻细胞内叶绿素a(chl-a)和叶绿素c(chl-c)含量的影响.在生长实验96h后,取20mL藻液经0.45 μm滤膜过滤,将滤膜浸泡到5mL 90%乙醇中,4 ℃条件下黑暗萃取24h.以90%乙醇作为对照,使用分光光度计测定萃取液在630,647,664和750nm波长处的吸光值,用下式计算chl-a和chl-c含量(mg/L):
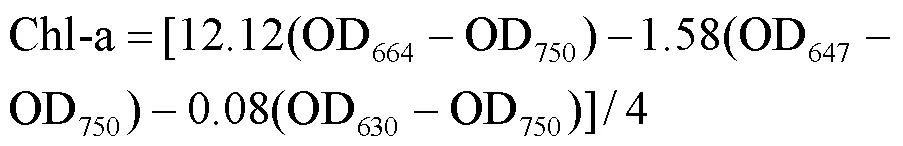
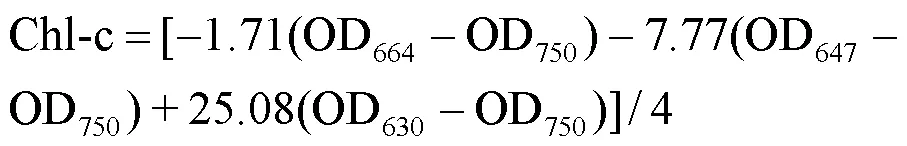
1.3.2 细胞形貌及内部结构观察 收集正常东海原甲藻和400μg/L AHTN处理96h后的藻细胞,使用2.5%的戊二醛溶液固定,磷酸盐缓冲溶液(PBS)清洗3次后,加入1%的锇酸溶液固定,再使用PBS清洗3次,使用乙醇梯度(30%、50%、70%、80%、90%和95%浓度)脱水处理细胞,包埋后切片染色,使用透射电子显微镜(TEM,H-7650,日立,日本)观察细胞内部结构;同上述步骤完成梯度洗脱后,先后使用乙醇与醋酸异戊酯的混合液和纯醋酸异戊酯处理样品,临界点干燥,镀膜,使用扫描电子显微镜(SEM,SU8010,日立,日本)观察细胞形貌.
1.3.3 细胞膜通透性测定 使用碘化丙啶(PI)染色测定生长实验后48和96h后的藻细胞膜通透性.参照王执伟等[12]的方法,使用PBS配制1mmol/L的PI储备液,4℃保存.取1mL藻液,加入PI染液的浓度为50μmol/L,25℃避光孵育20min.使用流式细胞仪检测,在FL2通道处收集PI荧光信号,结果表示为强荧光区细胞数量占检测细胞的百分比.
1.3.4 抗氧化系统活性测定 取生长实验96h后的藻液40mL,于4℃下6000r/min离心10min.去除上清液,细胞沉淀使用PBS清洗2次后,再加入2mL PBS重悬,使用超声细胞破碎仪在冰浴下破碎至镜检无完整细胞.将破碎后的藻液离心(7500r/min, 15min,4℃),上清液即为粗酶液.使用试剂盒(南京建成生物工程研究所,中国)检测总可溶性蛋白(TSP)含量、超氧化物歧化酶(SOD)活性、还原性谷胱甘肽含量(GSH)和丙二醛(MDA)含量.
1.3.5 叶绿素荧光参数测定 取生长实验0,24,48, 72,96h后的藻液2mL,使用浮游植物分类荧光仪(PHYTO-PAM,WALZ,德国)直接测定微藻实际量子产率(φPSⅡ);藻液避光暗处理15min,用于检测PSⅡ最大量子产率(Fv/Fm)、实际量子产率(φPSⅡ)、光限制斜率()、最大相对电子传递速率(rETRmax).
1.4 数据分析
采用SPSS 20.0软件,使用单因素方差分析和双因素方差分析实验结果,以多重比较(Duncan)检验组间差异,<0.05即表示存在显著性差异.
2 结果与分析
2.1 AHTN对东海原甲藻生长的影响
如图1所示,在实验的48h内,所有的AHTN处理组表现为对东海原甲藻的抑制效应,藻细胞密度相对于对照组下降了2.95%~63.23%,10~400μg/L处理组效应显著(<0.05).72h后,1μg/L AHTN浓度处理下的藻细胞密度超过对照组,表现为促进东海原甲藻生长;96h时在50~400μg/L浓度处理下细胞密度随浓度增大降低了59.57%~78.72%,表现为抑制作用,与对照组差异显著(<0.05).10μg/L AHTN处理组在前72h内对东海原甲藻表现为生长抑制,在第96h细胞密度恢复至与对照组无明显差异(> 0.05).
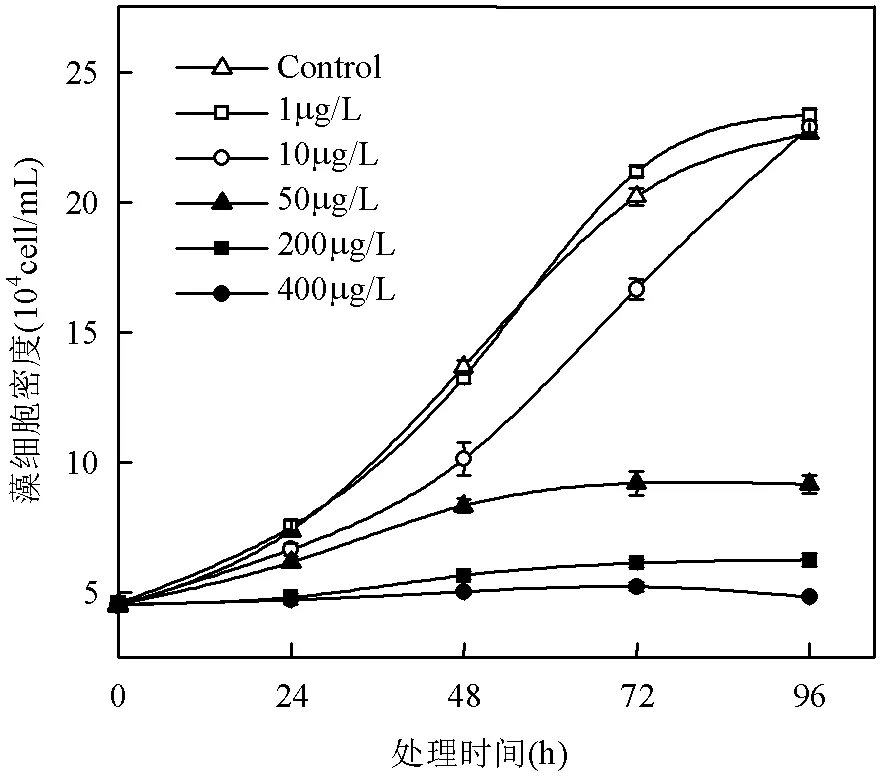
图1 东海原甲藻生长对AHTN处理的毒性响应
2.2 AHTN对东海原甲藻生理的影响
2.2.1 AHTN对东海原甲藻光合色素的影响 如图2所示,不同浓度AHTN处理96h的东海原甲藻chl-a、chl-c含量与生长结果类似,1和10μg/L AHTN处理组的chl-a含量与对照组相比分别增加了7.18%、6.93%,chl-c含量分别增加了29.77%、8.05%,但与对照组比较无显著性差异.50~400μg/L处理组显著抑制光合色素产生,chl-a含量相对于对照组减少了54.96%~87.58%,chl-c含量减少了50.45%~79.23%.
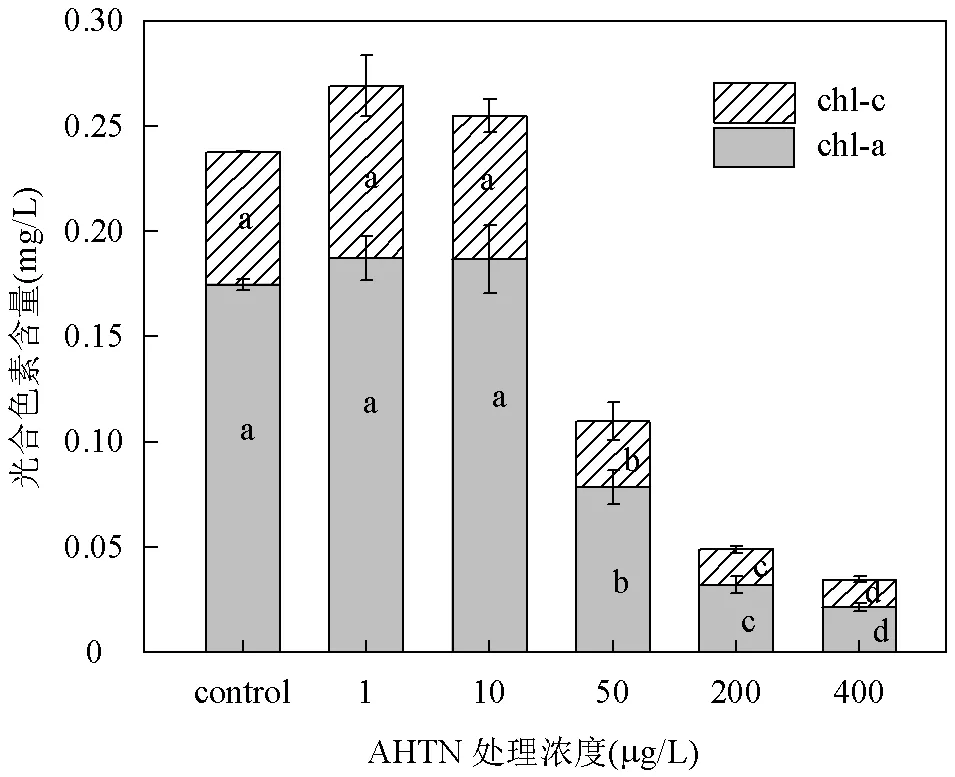
图2 不同浓度AHTN处理96h后东海原甲藻的光合色素含量
不同字母表示实验组间存在显著差异,<0.05
2.2.2 AHTN对东海原甲藻细胞形貌和内部结构的影响 如图3(a)所示,未经AHTN处理的东海原甲藻,细胞成椭圆体,饱满,细胞壁完整,表面长有尖刺并布有零星壳面小孔.图3(b,c)为处理组藻细胞,明显观察到细胞严重变形并缩小.由图3(d)可见,正常东海原甲藻细胞结构清晰,各细胞器完整,细胞壁与细胞膜贴合紧密,细胞内部具有一个大液泡. AHTN处理后的许多藻细胞出现质壁分离的现象,细胞器被破坏,细胞质溶解且空泡化(图3e,f);图3(f)显示细胞不同程度的损伤,细胞内物质泄露.
2.2.3 AHTN对东海原甲藻细胞膜通透性的影响 PI是一种荧光染料,可以插入双链核酸在蓝光激发下产生红色荧光.由于PI不能穿过完整的细胞膜,当细胞膜受损时PI才能够进入细胞并染色,因此强PI荧光细胞的比例可以反映细胞膜通透性[13].如图4所示,低浓度(1和10μg/L)处理48和96h时,强荧光细胞百分比与对照组无显著性差异,表明细胞膜通透性几乎不受影响;且随着暴露时间的延长,强荧光细胞百分比略微减少.第48h时,50,200和400μg/L处理组强荧光细胞百分比分别为1.0%、1.2%和2.4%,与对照组相比有显著性差异,细胞膜受损程度随浓度呈增加趋势.第96h与48h相比,50,200和400μg/L处理组强荧光细胞百分比分别增加到17.9%、13.6%和4.4%,随浓度增大呈减小趋势.
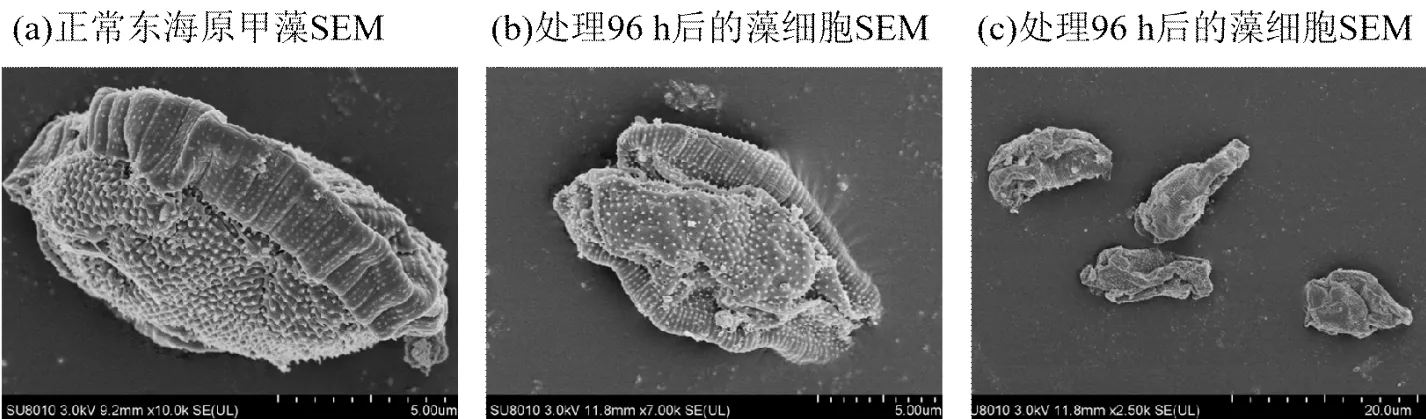
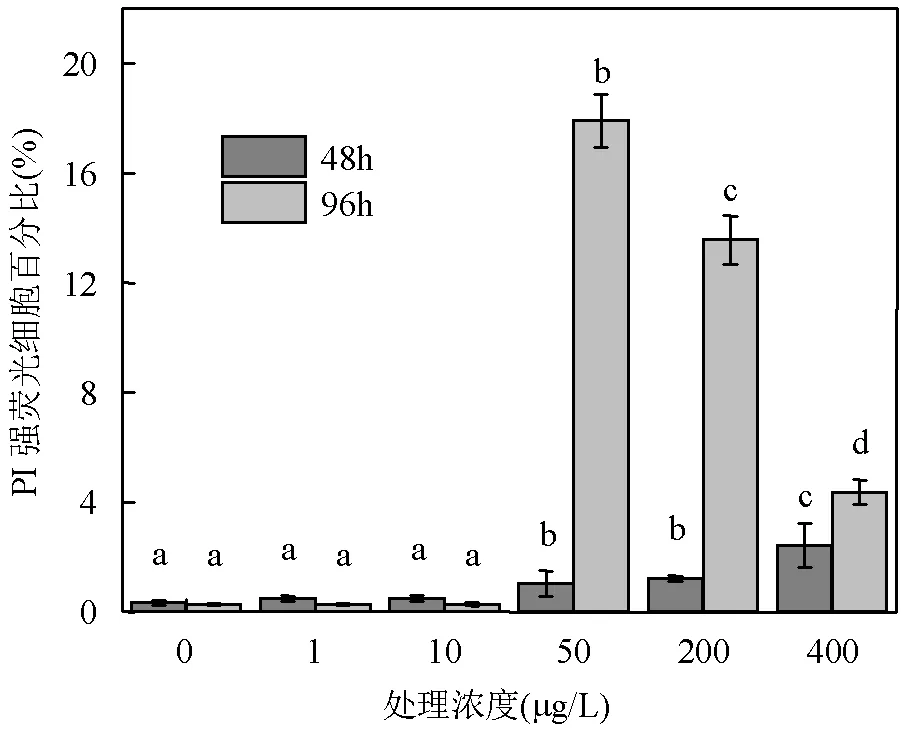
图4 东海原甲藻在AHTN处理48,96h后的PI强荧光细胞百分比
不同字母表示同一时间实验组间存在显著差异,<0.05
2.2.4 AHTN对东海原甲藻抗氧化系统活性的影响 如图5(a)所示,在1,10μg/L AHTN处理下,TSP含量高于对照组,10μg/L处理组与对照组存在显著性差异;50~400μg/L处理组TSP含量显著低于对照组,且随暴露浓度增大,藻细胞TSP含量降低.如图5(b),在较低浓度AHTN(1,10μg/L)处理下,SOD活性与对照组无显著性差异;在50μg/L AHTN处理下的SOD活性达到最大值,为对照组的2倍;高浓度AHTN(200,400μg/L)处理下,SOD活性相比50μg/L处理组逐渐降低,在实验浓度范围内呈先升高后下降趋势.如图5(c),与SOD活性结果相似, GSH含量出现先升高后降低的现象,50μg/L AHTN处理下的GSH含量达最大值,为对照组的2倍.如图5(d), AHTN处理组诱导东海原甲藻MDA含量增大,且随AHTN浓度增大MDA含量显著增多,与对照组相比增大0.8~4倍.
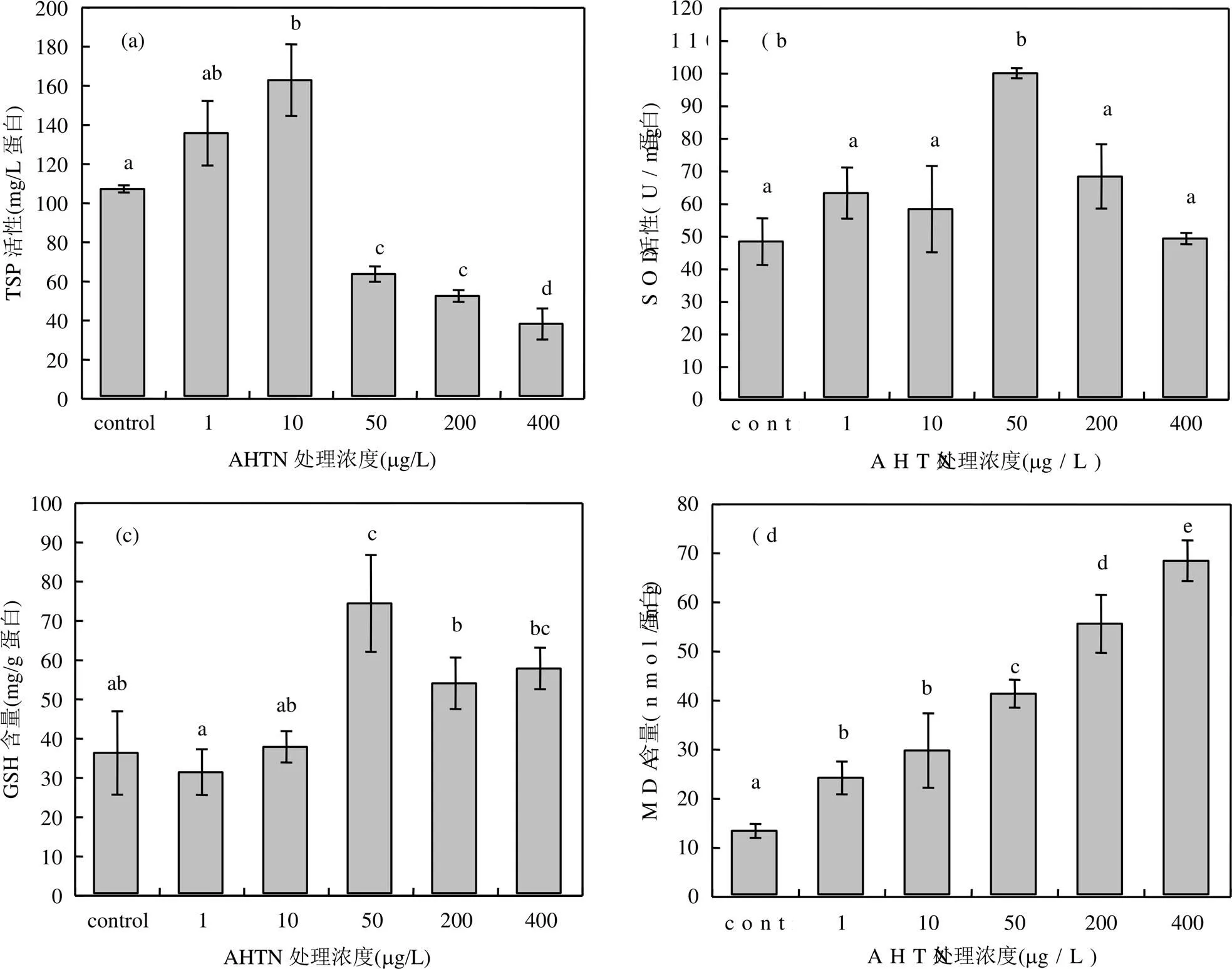
图5 AHTN对东海原甲藻TSP含量、SOD活性、GSH含量和MDA含量的影响
不同字母表示实验组间存在显著差异,<0.05
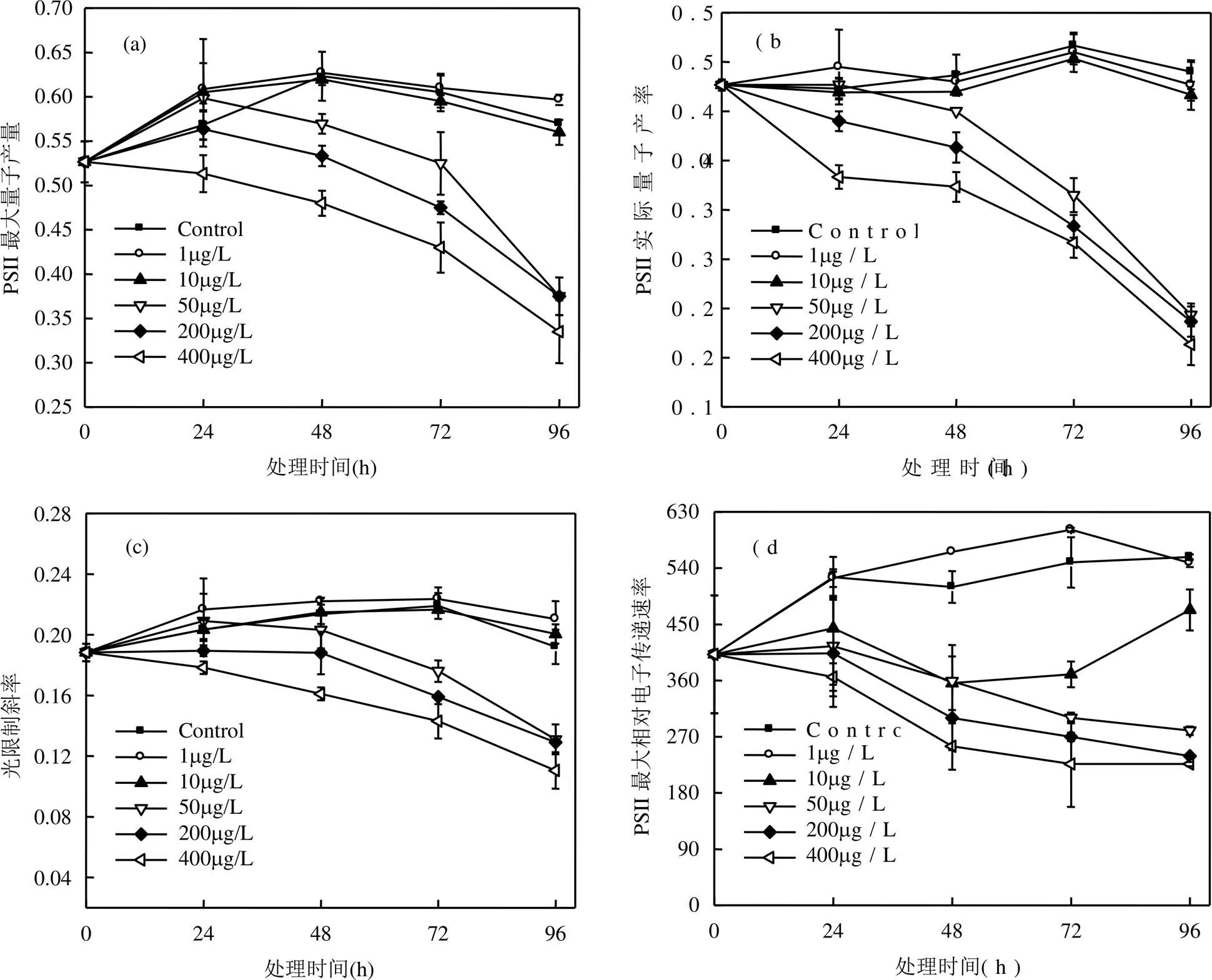
图6 不同浓度AHTN和处理时间对东海原甲藻叶绿素荧光参数的影响
2.2.5 AHTN对东海原甲藻光合活性的影响 如表1所示,AHTN浓度、处理时间和二者交互作用(浓度*时间)对Fv/Fm、φPSⅡ、、rETRmax4项叶绿素荧光参数均有显著影响,其中对φPSⅡ的影响最为显著.由图6和多重比较可见,AHTN高浓度(³50μg/L)处理组的4项叶绿素荧光参数显著低于低浓度处理组(1,10μg/L)和对照组,且随着处理浓度的增大,AHTN对4项参数抑制作用增强.1μg/L处理组对东海原甲藻的Fv/Fm、、rETRmax有刺激作用,10μg/L处理组对Fv/Fm和有刺激作用,但作用不显著(>0.05).根据多重比较结果,Fv/Fm、φPSⅡ随处理时间增长而减小.
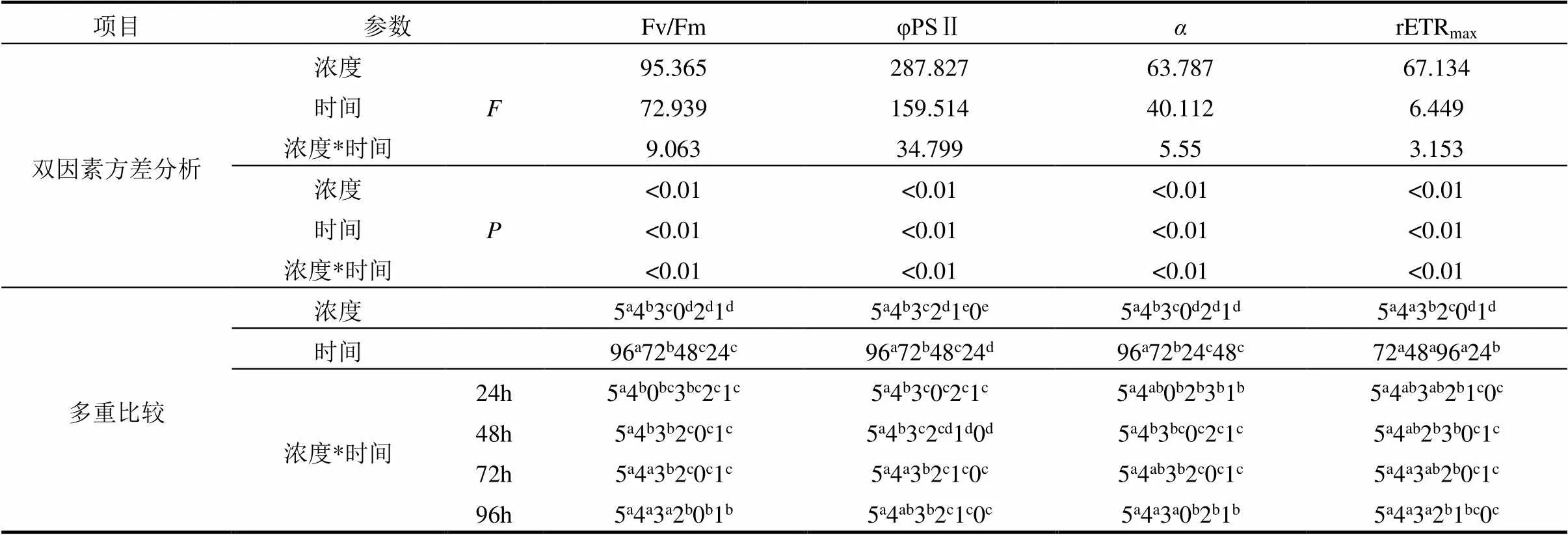
表1 AHTN浓度和处理时间对东海原甲藻光合活性参数的双因素方差分析和多重比较(Duncan)结果
注:不同字母表示实验组间存在显著差异,按升序排列,即a 本文中,AHTN对东海原甲藻生长的作用表现为低浓度时促进、高浓度时抑制.1μg/L实验组为探究接近环境浓度的低浓度AHTN对微藻的影响,结果表明,在1μg/L AHTN处理下,东海原甲藻被刺激生长,产生毒物兴奋效应(hormesis)[14],这种效应反映的是一种生物的过度补偿[15],因此AHTN可能会在实际环境中的低浓度下引发赤潮危害.10μg/L AHTN处理组对东海原甲藻的生长抑制在第96h恢复,可能由于AHTN降解为低毒产物,或者藻细胞在低浓度胁迫下自身解毒机制被激活[16].AHTN对东海原甲藻的生长抑制表现出明显的剂量-效应关系,由抑制率计算得到AHTN对东海原甲藻的96h- EC50为48.21μg/L,根据《新化学危害评估导则》[17]中的分级标准,AHTN对东海原甲藻为高毒性(EC50<1mg/L),可能因为AHTN有较高的logK而易在生物体内积蓄,和含有致毒的苯环结构.但由于AHTN有挥发性,实验得到的生物毒性可能被低估.由此可见,AHTN能够抑制海洋微藻种群的生长,而微藻作为初级生产者,AHTH的毒害作用将会沿着食物链放大累积,进而对整个海洋生态系统造成潜在威胁. 当受到污染胁迫时,光合色素含量通常是表征藻类生长的一个指标[18].本实验中chl-a与chl-c的合成也有低促高抑的现象:低AHTN浓度(1和10μg/L)促进光合色素的合成,这可能是藻细胞一种自我保护机制,用于清除叶绿体中因外界胁迫积累的活性氧(ROS)[19];高浓度AHTN(³50μg/L)抑制光合色素的生成,且随浓度增大抑制作用增强,光合色素的减少也是植物和微藻的常见胁迫反应,可能是类囊体脂质的过氧化和光合系统PSII复合物的降解所导致的[20].当叶绿素含量下降时,可能会阻碍植物正常的光吸收和散射[21],从而影响光合系统活性. 细胞结构的完整性是细胞增殖和发育的重要因素[22].由两种电镜结果可以看出,400μg/L AHTN对藻细胞的形态结构造成了一定的破坏.根据SEM图片和陆斗定等[23]的报道分析,东海原甲藻表面均匀分布的球形突起可以增大毒性物质与藻细胞的接触面积,零星的壳面小孔有利于毒性物质进入藻体,这可能是东海原甲藻易受AHTN损伤的关键.TEM结果显示,AHTN可能破坏细胞膜并诱导细胞内物质泄漏,导致藻细胞死亡;部分藻细胞观察到叶绿体结构被破坏,这将会导致叶绿素合成受阻,这可能也是上节讨论中高浓度AHTN处理组光合色素含量减少的原因之一. 细胞膜是细胞选择性的动态屏障,在调节生理生化过程中发挥重要作用[24].MDA是膜脂质过氧化的产物,可衡量藻细胞受逆境胁迫后膜结构损伤的程度[25].AHTN对东海原甲藻细胞膜的影响可通过膜的通透性和MDA含量变化来反映.根据实验结果分析,低浓度AHTN(1和10μg/L)下的膜受损细胞的比例随着处理时间增长略微减小,可能是由于随着东海原甲藻的生长,AHTN对总群体的毒性作用逐渐减弱,或由于藻细胞自身修复.高浓度AHTN (³50μg/L)处理组随暴露时间的增长对细胞膜的破坏增强,在96h时随浓度升高强荧光细胞百分比逐渐减小,可能由于部分细胞在高浓度AHTN胁迫下破坏程度较大,胞内核酸物质泄露(图3f),导致流式细胞仪检测到的荧光细胞数量减少.细胞膜通透性的改变可能导致细胞体积控制过程中的渗透压调节功能被破坏[26],这可以用来解释SEM观察到的细胞皱缩的现象(图3b,c).MDA含量呈浓度依赖性变化,表明AHTN处理浓度增大使膜脂质过氧化加剧,进而导致细胞膜完整性的损害.这些结果表明, AHTN可以破坏藻细胞膜完整性进入细胞体内,从而影响藻类生长. 在藻细胞正常生理代谢过程中,叶绿体和线粒体等细胞器均可能产生ROS[12],低浓度的ROS可以调节细胞周期、免疫和基因组完整性[27].当藻细胞受到外界胁迫时,可能会诱导ROS快速产生并累积,造成细胞氧化损伤.ROS主要包括超氧阴离子自由基(O2−)、过氧化氢(H2O2)和羟基自由基(·OH)等,藻细胞可通过体内的抗氧化酶类和抗氧化物质清除ROS和还原其为毒性较小的物质来减少氧化损伤[28].大多数氧化损伤始于O2−的产生,SOD可以将O2−转化为H2O2,因此是抵抗ROS的第一道防线[29].在50~400μg/L AHTN处理下SOD活性升高,这是因为藻细胞通过增加SOD活力来对抗AHTN引起的氧化胁迫;当浓度继续增大时,SOD活性降低,说明此时的氧化胁迫已经超出细胞的防御能力,藻细胞受到损伤.当酶清除系统不堪重负时,会使H2O2累积并分解产生·OH,·OH可以抑制PSII的电子传递并减少光合作用相关的基因(B,D1)的数量,从而阻碍光合作用进程[30],这可能是本研究中高浓度AHTN胁迫下光合活性显著降低的原因.TSP主要参与各种代谢酶,用作藻类细胞对污染物抗性的指标[31].TSP在高浓度AHTN(³50μg/L)下显著降低,可能与微藻生物量的减少有关.MDA含量增加说明膜系统受到了氧化损伤,蛋白质也会因膜系统受到干扰而加速降解[32].另外,蛋白质是植物光合作用的部分产物,chl-a的减少也影响了蛋白质的生产[33].GSH是藻细胞内重要的抗氧化剂,同时也是谷胱甘肽过氧化物酶和谷胱甘肽转移酶的底物[34].GSH含量在暴露浓度范围内出现先升高后降低的现象表明, GSH首先被诱导产生,但随着酶的清除或细胞破损使GSH含量减少或流失,但处理组GSH含量基本显著高于对照组,说明即使在SOD等抗氧化酶受到抑制时,GSH仍能发挥其抗氧化作用,这与王执伟[35]的研究结果一致. 叶绿素荧光技术常用于监测植物和藻类的光合性能,因此可以通过叶绿素荧光参数来评估在逆境胁迫下植物的光合作用能力的改变[36].Fv/Fm可以反映藻细胞的最大光合作用能力,在高浓度AHTN(³50μg/L)处理下Fv/Fm下降表明,AHTN能显著抑制东海原甲藻的光合性能,并且胁迫程度随着暴露时间增长而增加;低浓度(1和10 μg/L)处理下则能够增强微藻的光合能力.φPSⅡ反映了PSⅡ反应中心实际光化学效率,φPSⅡ下降表明,AHTN使细胞同化功能受损,影响了碳的固定和同化[36].α反映了微藻对光能的利用效率[37],这种效能也表现出在低浓度AHTN(1和10μg/L)下增强,在高浓度AHTN(³50μg/L)下减弱的现象.rETRmax反映了藻类的潜在最大光合速率,常用于指示微藻的“生长潜能”[38],10μg/L浓度下微藻的生长潜能在72h逐渐恢复,与细胞密度恢复的结果相一致;高浓度AHTN (³50μg/L)组rETRmax减小表明AHTN阻碍了东海原甲藻PSⅡ中心的电子传递过程.藻细胞吸收的光能如果无法通过光合作用耗散,这部分过剩能量可能会以ROS的形式聚集,从而对细胞造成损伤[39].因此,AHTN可以通过影响东海原甲藻的光合系统活性来抑制细胞生长. 根据以上结果可见,东海原甲藻的抗氧化系统和光合系统等生理生化功能系统在AHTN胁迫下受到显著影响.在低浓度AHTN胁迫下藻细胞可以通过自身调节作用维持正常生理功能,但随着处理浓度的升高,抗氧化系统活性和光合作用性能的降低可能会导致细胞中ROS的累积,从而导致蛋白质变性、脂质过氧化和叶绿素漂白[40],最终影响藻类生长.张薛薇等[41]也报道了4种香料通过抑制藻细胞抗氧化酶活性和叶绿素含量导致藻类生长异常.另外,东海原甲藻的生理生化功能也在低AHTN浓度胁迫下出现毒性兴奋效应,这与Liu等[29]、Wang等[42]和刘伟杰等[43]的研究结果相似.据报道,植物的毒性兴奋效应会影响其细胞和分子机制,包括光合作用、希尔反应、叶绿素含量、信号传导途径和抗氧化酶,从而反映到作物产量[14],这解释了东海原甲藻的生长在1μg/L AHTN处理下被促进和在10μg/L AHTN处理下恢复生长的现象. 4.1 低浓度AHTN(1μg/L)会促进东海原甲藻生长,1,10μg/L AHTN能够促进其光合色素的合成,对细胞膜完整性无显著影响,能够激发抗氧化系统活性,促进光合作用性能增强,因而具有导致以东海原甲藻为优势种的赤潮爆发的潜在风险. 4.2 较高浓度AHTN(10~400μg/L)对东海原甲藻的生长有抑制作用,50~400μg/L AHTN能够抑制东海原甲藻光合色素产生,破坏藻细胞膜和内部结构的完整性,在诱导氧化应激后破坏细胞抗氧化能力,造成光合系统损伤,证明AHTN对海洋生态环境存在潜在的威胁. [1] Rainieri S, Barranco A, Primec M, et al. Occurrence and toxicity of musks and UV filters in the marine environment [J]. Food and Chemical Toxicology, 2017,104:57-68. [2] 李晓云.污泥堆肥过程中多环麝香的降解与微生物群落演替的关系[D]. 沈阳:东北大学, 2012. Li X Y. The relationship between the degradation of synthetic musk and microbial community succession in sludge composting [D]. Shenyang: Northeastern University, 2012. [3] Liu J L, Wong M H. Pharmaceuticals and personal care products (PPCPs): a review on environmental contamination in China [J]. Environment International, 2013,59:208-224. [4] Zhang H, Bayen S, Kelly B C. Multi-residue analysis of legacy POPs and emerging organic contaminants in Singapore's coastal waters using gas chromatography-triple quadrupole tandem mass spectrometry [J]. Science of the Total Environment, 2015,523:219-232. [5] 王 杰,楼迎华,王 玲,等.胶州湾北岸潮间带沉积物中人工合成麝香的污染特征[J]. 环境化学, 2015,34(2):384-385. Wang J, Lou Y H, Wang L, et al. Pollution characteristics of synthetic musk in intertidal sediments of the intertidal zone on the north coast of Jiaozhou Bay [J]. Environmental Chemistry, 2015,34(2):384-385. [6] Lange C, Kuch B, Metzger J W. Occurrence and fate of synthetic musk fragrances in a small German river [J]. Journal of Hazardous Materials, 2015,282:34-40. [7] Zeng X Y, Sheng G Y, Gui H Y, et al. Preliminary study on the occurrence and distribution of polycyclic musks in a wastewater treatment plant in Guandong, China [J]. Chemosphere, 2007,69(8): 1305-1311. [8] Li W W, Wang S H, Li J, et al. Development of aquatic life criteria for tonalide (AHTN) and the ecological risk assessment [J]. Ecotoxicology and Environmental Safety, 2020,189:109960. [9] Parolini M, Magni S, Traversi I, et al. Environmentally relevant concentrations of galaxolide (HHCB) and tonalide (AHTN) induced oxidative and genetic damage in Dreissena polymorpha [J]. Journal of Hazardous Materials, 2015,285:1-10. [10] Wollenberger L, Breitholtz M, Ole Kusk K, et al. Inhibition of larval development of the marine copepod Acartia tonsa by four synthetic musk substances [J]. Science of The Total Environment, 2003, 305(1-3):53-64. [11] 丛海兵,黄廷林,周真明,等.藻类叶绿素测试新方法[J]. 给水排水, 2007,33(6):28-33. Cong H B, Huang T L, Zhou Z M, et al. A new measurement method for chlorophylls [J]. Water& Wastewater Engineering, 2007,33(6): 28-33. [12] 王执伟,刘冬梅,张文娟,等.溴酸盐对普通小球藻的生长以及生理特性的影响[J]. 环境科学, 2016,37(6):2158-2163. Wang Z W, Liu D M, Zhang W J. et al. Effects of bromate on the growth and physiological characteristics of chlorella vulgaris [J]. Environmental Science, 2016,37(6):2158-2163. [13] Seoane M, Rioboo C, Herrero C, et al. Toxicity induced by three antibiotics commonly used in aquaculture on the marine microalga Tetraselmis suecica (Kylin) Butch [J]. Marine Environmental Research, 2014,101:1-7. [14] Jalal A, Oliveira Junior J C, Ribeiro J S, et al. Hormesis in plants: Physiological and biochemical responses [J]. Ecotoxicology and Environmental Safety, 2021,207:111225. [15] Calabrese E J, Baldwin L A. Hormesis: U-shaped dose responses and their centrality in toxicology [J]. Trends in Pharmacological Sciences, 2001,22(6):285-291. [16] Ding T D, Li W, Yang M, et al. Toxicity and biotransformation of bisphenol S in freshwater green alga Chlorella vulgaris [J]. Science of the Total Environment, 2020,747:141144. [17] HJ/T 154-2004 新化学物质危害评估导则[S]. HJ/T 154-2004 The guidelines for the hazard evaluation of new chemical substances [S]. [18] Wang H, Jin M K, Mao W F, et al. Photosynthetic toxicity of non-steroidal anti-inflammatory drugs (NSAIDs) on green algae Scenedesmus obliquus [J]. Science of the Total Environment, 2020,707:136176. [19] Kasahara M, Kagawa T, Oikawa K, et al. Chloroplast avoidance movement reduces photodamage in plants [J]. Nature, 2002,420:829- 832. [20] Xiong J Q, Kurade M B, Abou-Shanab R A I, et al. Biodegradation of carbamazepine using freshwater microalgae Chlamydomonas mexicana and Scenedesmus obliquus and the determination of its metabolic fate [J]. Bioresource Technology, 2016,205:183-190. [21] Biczak R. Quaternary ammonium salts with tetrafluoroborate anion: Phytotoxicity and oxidative stress in terrestrial plants [J]. Journal of Hazardous Materials, 2016,304:173-185. [22] Hu L X, Xiong Q, Shi W J, et al. New insight into the negative impact of imidazolium-based ionic liquid [C10mim] Cl on Hela cells: From membrane damage to biochemical alterations [J]. Ecotoxicology and Environmental Safety, 2021,208:111629. [23] 陆斗定,齐雨藻,Jeanette G,等.东海原甲藻修订及与相关原甲藻的分类学比较[J]. 应用生态学报, 2003,14(7):1060-1064. Lu D D, Qi Y Z, Jeanette G, et al. Redescription of Prorocentrum donghaiense Lu and comparison with relevant Prorocentrum species [J]. Chinese Journal of Applied Ecology, 2003,14(7):1060-1064. [24] Ehiguese F O, Alam M R, Pintado-Herrera M G, et al. Potential of environmental concentrations of the musks galaxolide and tonalide to induce oxidative stress and genotoxicity in the marine environment [J]. Marine Environmental Research, 2020,160:105019. [25] Allen R D. Dissection of oxidative stress tolerance using transgenic plants [J]. Plant Physiology, 1995,107(4):1049-1054. [26] Seoane M, Esperanza M, Rioboo C, et al. Flow cytometric assay to assess short-term effects of personal care products on the marine microalga Tetraselmis suecica [J]. Chemosphere, 2017,171:339-347. [27] Murali Achary V M, Panda B B. Aluminium-induced DNA damage and adaptive response to genotoxic stress in plant cells are mediated through reactive oxygen intermediates [J]. Mutagenesis, 2010,25(2): 201-209. [28] Larson R A. The antioxidants of higher plants [J]. Phytochemistry, 1988,27(4):969-978. [29] Liu Y, Guan Y T, Gao B Y, et al. Antioxidant responses and degradation of two antibiotic contaminants in Microcystis aeruginosa [J]. Ecotoxicology and Environmental Safety, 2012,86:23-30. [30] Chen C, Yang Z, Kong F X, et al. Growth, physiochemical and antioxidant responses of overwintering benthic cyanobacteria to hydrogen peroxide [J]. Environmental Pollution, 2016,219:649-655. [31] Li H, Yao J, Duran R, et al. Toxic response of the freshwater green algae Chlorella pyrenoidosa to combined effect of flotation reagent butyl xanthate and nickel [J]. Environmental Pollution, 2021,286: 117285. [32] Pisani T, Munzi S, Paoli L, et al. Physiological effects of arsenic in the lichen Xanthoria parietina (L.) Th. Fr. [J]. Chemosphere, 2011, 82(7):963-969. [33] Nong Q Y, Liu Y A, Qin L T, et al. Toxic mechanism of three azole fungicides and their mixture to green alga Chlorella pyrenoidosa [J]. Chemosphere, 2021,262:127793. [34] Lin T H, Rao M Y, Lu H W, et al. A role for glutathione reductase and glutathione in the tolerance of Chlamydomonas reinhardtii to photo-oxidative stress [J]. Physiologia Plantarum, 2018,162:35-48. [35] 王执伟.水中溴酸盐的急性生物毒性及致毒机理[D]. 哈尔滨:哈尔滨工业大学, 2016. Wang Z W. The acute biological toxicity and toxic mechanism of bromate in water [D]. Harbin: Harbin Institute of Technology, 2016. [36] Kumar K S, Dahms H U, Lee J S, et al. Algal photosynthetic responses to toxic metals and herbicides assessed by chlorophyll a fluorescence [J]. Ecotoxicology and Environmental Safety, 2014,104:51-71. [37] Dubinsky Z, Stambler N. Photoacclimation processes in phytoplankton: mechanisms, consequences, and applications [J]. Aquatic Microbial Ecology, 2009,56:163-176. [38] 吴义诚,吴文惠,陈国元,等.壬基酚对小球藻生理及光合特性的影响[J]. 安全与环境学报, 2020,20(3):1185-1190. Wu Y C, Wu W H, Chen G Y, et al. Effect of nonylphenol on the physiological and photosynthetic characteristics of chlorella vulgaris [J]. Journal of Safety and Environment, 2020,20(3):1185-1190. [39] 王木兰,姜玥璐.微量元素锰对威氏海链藻生长及叶绿素荧光的影响[J]. 环境科学, 2018,39(12):5514-5522. Wang M L, Jang Y L. Effects of manganese on the growth and fluorescence induction kinetics of conticribra weissflogii [J]. Environmental Science, 2018,39(12):5514-5522. [40] Dummermuth A L, Karsten U, Fisch K M, et al. Responses of marine macroalgae to hydrogen-peroxide stress [J]. Journal of Experimental Marine Biology and Ecology, 2003,289(1):103-121. [41] 张薛薇,开振鹏,宋卫国,等.50种常用香料对铜绿微囊藻的生态毒性效应[J]. 中国环境科学, 2021,41(3):1429-1435. Zhang X W, Kai Z P, Song W G, et al. Ecotoxicological effects of 50kinds of fragrance materials on[J]. China Environmental Science, 2021,41(3):1429-1435. [42] Wang X F, Miao J J, Pan L Q, et al. Toxicity effects of p-choroaniline on the growth, photosynthesis, respiration capacity and antioxidant enzyme activities of a diatom, Phaeodactylum tricornutu [J]. Ecotoxicology and Environmental Safety, 2019,169:654-661. [43] 刘伟杰,吴孝倩,鄢佳英,等.壬基酚对羊角月牙藻的毒性效应研究 [J]. 中国环境科学, 2018,38(6):2329-2336. Liu W J, Wu X Q, Yan J Y, et al. Toxic effects of nonylphenol on Selenastrum capricornutum [J]. China Environmental Science, 2018, 38(6):2329-2336 Toxic mechanism of tonalide on. QU Yu-ying, ZHANG Cai-jie, SHEN Qiu-cen, ZHANG Jing*, YU Hong (College of Chemistry Engineering, Ocean University of China, Qingdao 266100, China)., 2022,42(3):1401~1409 was selected to study the toxic mechanism of tonalide (AHTN) on marine microalgae. Five concentrations (1, 10, 50, 200 and 400μg/L) of AHTN were tested to evaluate its influence on the growth, photosynthetic pigment content, cell morphology and structure, cell membrane permeability and the antioxidant and photosynthetic systems. The results showed that AHTN significantly inhibited the growth ofwith high toxicity (96h-EC50= 48.21μg/L). The mechanism of realization of the algal toxicity of AHTN is the inhibition of photosynthetic pigment production, the destruction of cell structure and cell membrane integrity, the induction of antioxidant system response, and the effect of photosynthe performance. However, treatment with 1μg/L AHTN treatment promoted the growth of. Meanwhile, treatment with 1μg/L and 10μg/L AHTN promoted the synthesis of photosynthetic pigments and increased the activity of superoxide dismutase as well as some photosynthetic parameters. In conclusion, low concentrations of AHTN (1μg/L) may induce red tides of, while high concentrations of AHTN (10~400μg/L) could inhibit the population growth of this algae and cause a potential threat to marine ecosystems. tonalide;;toxic mechanism;antioxidant system;photosynthetic characteristics X55 A 1000-6923(2022)03-1401-09 曲玉楹(1997-),女,山东青岛人,中国海洋大学化学化工学院硕士研究生,主要从事新兴污染物的生态毒理学研究. 2021-08-17 国家自然科学基金青年科学基金资助项目(41806093) *责任作者, 教授, zhangjouc@ouc.edu.cn3 讨论
3.1 AHTN对东海原甲藻生长有低促高抑的作用
3.2 AHTN损伤东海原甲藻的形貌结构及细胞膜完整性
3.3 AHTN使东海原甲藻的生理生化功能产生氧化应激
4 结论

