2型糖尿病患者血清semaphorin3A水平与骨密度及骨代谢指标的相关性分析
陈镜 冯正平
重庆医科大学附属第一医院内分泌科,重庆 400016
2型糖尿病(type 2 diabetes mellitus,T2DM)和骨质疏松症是常见的慢性疾病,其患病率逐年上升。目前我国的糖尿病患病率高达11.2%,50岁以上人群骨质疏松患病率高达19.2%。2型糖尿病患者因为持续高血糖状态、胰岛素相对或绝对缺乏、糖尿病微血管病变及体内激素水平的改变等原因,其患骨质疏松及骨质疏松性骨折的风险明显升高[1]。信号素3A(semaphorin3A,Sema3A)作为信号素家族中的一员,是胚胎发育、肿瘤发生、免疫调节及骨发育的重要调节因子[2-3]。在骨重建过程中,Sema3A通过抑制骨吸收和促进骨形成发挥骨保护作用[4-5]。动物研究[6]表明高糖可降低Sema3A及其受体神经纤毛蛋白-1(neuropilin-1,Nrp1)的表达,并且降低成骨相关基因的表达,从而抑制成骨分化。有关糖尿病患者血清Sema3A水平与骨代谢的相关性尚无报道。本研究旨在观察2型糖尿病患者血清Sema3A水平与骨密度、骨代谢指标的相关性,为临床防治糖尿病合并骨质疏松提供理论依据。
1 材料和方法
1.1 研究对象
选取2020年3月至2021年1月于重医附一院内分泌科住院的2型糖尿病患者共129例。根据DXA测定的腰椎(L1~L4)或股骨颈或全髋骨密度,按T值分成骨质疏松组(62例,T值≤-2.5)和非骨质疏松组(67例,T值>-2.5),其中非骨质疏松组包括低骨量和正常骨量患者。该研究通过医院伦理委员会批准,由于ELISA检测标本来自内分泌实验室废弃血标本,故免除知情同意。
1.1.1纳入标准:①根据1999年WHO的糖尿病诊断标准诊断2型糖尿病;②自然绝经后女性;③男性年龄≥50岁。
1.1.2排除标准:①1型糖尿病、妊娠糖尿病、特殊类型糖尿病或合并糖尿病急性并发症(如高血糖高渗状态、酮症酸中毒);②合并有恶性肿瘤、甲状腺或甲状旁腺疾病、肠胃营养不良、严重感染等影响骨代谢的其他内分泌疾病或慢性疾病;③合并有过敏性鼻炎、过敏性哮喘、自身免疫性疾病等;④严重的肝肾功能不全;⑤近6个月内有急性心脑血管事件发生者;⑥服用影响骨代谢药物或接受过抗骨质疏松治疗(如双膦酸盐、甲状旁腺素、雌激素、糖皮质激素、免疫抑制剂等)。
1.2 研究方法
1.2.1临床资料的收集:收集两组患者的临床资料,包括性别、年龄、糖尿病病程、身高、体重,并计算BMI。
1.2.2骨密度的测定:采用美国HOLOGIC公司的Discovery A(S/N 87352)骨密度仪双能X线吸收法(DXA)测定腰椎(L1~L4)、全髋及股骨颈骨密度,单位为g/cm2,CV值为1.0%。
1.2.3Sema3A的测定:清晨空腹采集静脉血,分装于离心试管中在室温放置2 h,然后1 000 r/min离心15 min,取上清液将其置于-80 ℃低温冰箱保存待测。采用江莱生物的人Sema3A ELISA试剂盒测定,板内CV值<9%,板间CV值<11%。每例血清样本均设2个测试孔,最终反应板在酶标仪(美国Thermo公司)450 nm处读取吸光度值,并取其2个测试孔吸光度平均值,在Excel工作表中绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值。
1.2.4骨代谢指标及各生化指标的测定:①血PINP、血OC、血β-CTX均采用电化学法测定;②血BALP、血PTH均采用化学发光法;③血25(OH)D采用双抗夹心酶联免疫法;④血Ca、血Mg、血P采用自动生化分析仪测定;⑤随机UALB/Cr采用透射比浊法;⑥ HbA1c采用高压液相离子交换层析法。
1.3 统计学处理
采用SPSS 22.0统计软件分析处理数据,正态性检验采用单个样本Kolmogorov-Smirnov检验。满足正态分布计量资料用均值±标准差表示,采用t检验;非正态分布计量资料用中位数(四分位数范围)[M(P25~P75)]表示,采用Mann-WhitneyU检验。计数资料用例数表示,采用卡方检验。两个连续性数值变量采用Spearman相关分析。血清Sema3A水平与骨密度及骨代谢指标的相关性采用多元线性回归分析方法。P<0.05表示差异具有统计学意义。
2 结果
2.1 2型糖尿病患者的临床资料
2型糖尿病患者骨质疏松组和非骨质疏松组间糖尿病病程、HbA1c、随机UALB/Cr相比差异无统计学意义(均P>0.05)。两组间性别比例、年龄、BMI相比差异有统计学意义(均P<0.01),其中骨质疏松组年龄高于非骨质疏松组,而BMI水平低于非骨质疏松组。与非骨质疏松组相比,骨质疏松组患者女性占比明显更高。见表1。
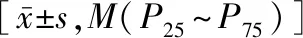
表1 2型糖尿病患者的临床资料Table 1 The clinical data of T2DM
2.2 2型糖尿病患者的血清Sema3A、骨密度、骨代谢指标
2型糖尿病患者骨质疏松组腰椎骨密度、全髋骨密度、股骨颈骨密度明显低于非骨质疏松组(均P<0.01)。血清Sema3A水平骨质疏松组显著低于非骨质疏松组(P<0.05)。血清β-CTX在骨质疏松组较非骨质疏松组明显升高(P<0.05)。和非骨质疏松组患者相比,骨质疏松组血PINP、OC、BALP、PTH升高,25(OH)D降低,但差异无统计学意义(均P>0.05)。见表2。
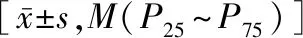
表2 2型糖尿病患者的血清Sema3A、骨密度、骨代谢指标Table 2 Serum Sema3A, BMD, and bone metabolic indicators in T2DM
2.3 2型糖尿病患者血清Sema3A水平与各参数间的相关性
2型糖尿病患者血清Sema3A水平与腰椎骨密度、全髋骨密度、股骨颈骨密度呈正相关,相关系数r分别为0.310、0.239、0.203,P值分别为<0.001、0.006、0.021。血清Sema3A水平与OC呈负相关,相关系数r为-0.177,P值为0.045。Sema3A与PINP、β-CTX、BALP、PTH呈负相关,与25(OH)D呈正相关,但无统计学意义(P>0.05)。见表3。
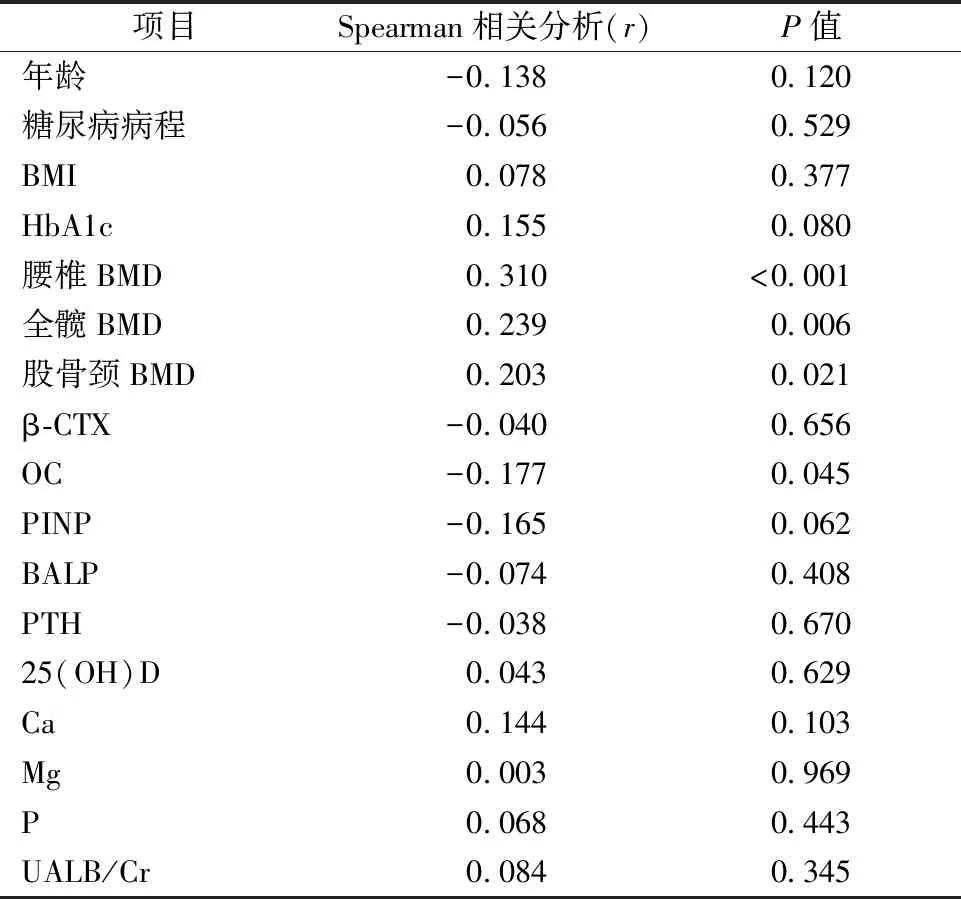
表3 2型糖尿病患者血清Sema3A水平与各参数间的相关性Table 3 The association between serum Sema3A level and other variables
2.4 2型糖尿病患者血清Sema3A与骨密度、骨代谢指标的多元回归分析
多元回归分析结果显示,校正可能的混杂因素年龄、糖尿病病程、BMI、HbA1c后,血清Sema3A与腰椎骨密度、全髋骨密度、股骨颈骨密度均呈正相关(P<0.05)。进一步校正性别后,血清Sema3A水平与腰椎骨密度仍呈正相关(B=0.002,P=0.035);与全髋骨密度、股骨颈骨密度呈正相关,但无统计学意义(P>0.05)。在校正年龄、糖尿病病程、BMI、HbA1c后Sema3A与PINP呈负相关(B=-0.340,P=0.048);与OC、β-CTX呈负相关,但无统计学意义(P>0.05)。见表4。

表4 2型糖尿病患者血清Sema3A与骨密度、骨代谢指标的多元回归分析Table 4 Multiple regression analysis between Sema3A and BMD and bone metabolic indicators in T2DM patients
3 讨论
骨质疏松症多见于绝经后女性及老年男性,我们的研究发现,在2型糖尿病患者中,绝经后女性比男性更容易患骨质疏松,与以往的研究结果一致。这与绝经后女性体内雌激素水平降低后对破骨细胞的抑制作用减弱,导致其骨吸收功能增强有关[7]。在2型糖尿病患者中,骨质疏松组年龄大于非骨质疏松组,表明了骨质疏松症是一种与增龄相关的代谢性疾病[8]。首先,增龄可以导致骨重建失衡,骨吸收与骨形成的比值升高,从而导致进行性的骨量丢失;其次,增龄可以使免疫系统呈低度活化状态,白介素-1(IL-1)、白介素-6(IL-6)、肿瘤坏死因子α(TNF-α)等炎性反应介质可以刺激核因子-κB受体活化因子配体(RANKL)和巨噬细胞集落刺激因子(M-CSF)表达,从而刺激破骨细胞,抑制成骨细胞,造成骨量的减少。有研究[9-10]表明肥胖可能会导致骨密度增加,与骨密度呈正相关,与骨质疏松呈负相关。BMI下降或低BMI是老年女性和男性骨折发生率较高的独立危险因素[11]。本研究也发现骨质疏松组患者BMI更低,这可能与体内较低的17β-雌二醇水平和较低的机械负荷有关。
Sema3A是脊椎动物中发现的第一个信号素。它最初被认为是一种可扩散的轴突导向分子,诱导神经系统的生长和发育。然而,研究发现Sema3A在骨重建中也发挥着重要作用。Sema3A基因敲除小鼠的原代成骨细胞存在分化缺陷,成骨细胞标志物Runx2和Bglap2表达降低[12],而骨保护素(OPG)缺陷的小鼠颅骨细胞培养液中加入Sema3A能抑制破骨细胞的成熟。在一项基于Sema3A基因治疗的骨靶向给药系统的研究[13]显示,经过Sema3A治疗的小鼠破骨细胞数量明显减少,成骨细胞数量明显增加,骨密度、骨体积/组织体积(BV/TV)、骨小梁数量(Tb.N)和骨小梁厚度(TB.Th)均显著高于对照组。静脉注射Sema3A可加速钻孔损伤所致皮质骨缺损小鼠模型的骨再生,去卵巢(ovariectomized,OVX)诱导的骨质疏松小鼠模型也显示Sema3A可以减少卵巢切除后所致的骨量丢失[12]。在本研究中,我们发现在2型糖尿病患者中,骨质疏松组患者血清Sema3A水平明显低于非骨质疏松组,Sema3A与各部位骨密度呈正相关。其可能的机制有如下几个方面:一方面Sema3A与从状蛋白-A1(plexin-A1)和Nrp1受体复合物结合后影响免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motif,ITAM)信号通路和RhoA激活,从而抑制破骨细胞分化和破骨前体细胞迁移;另一方面Sema3A和Nrp1的结合还可以增加Rac1的表达,促进β-catenin在细胞核内聚集,增加成骨细胞分化、增殖[12]。而高糖可以降低Sema3A及受体Nrp1的表达,显著抑制成骨分化。Ma等[14]研究也表明糖尿病可能通过调节Sema3A/IGF-1/β-catenin信号通路来干扰骨代谢。基于此,调节血清Sema3A水平可能成为骨质疏松治疗的新靶点,特别是为糖尿病合并骨质疏松患者的治疗提供新思路。
既往有研究[15]表明在人体中血清Sema3A水平随年龄的增长或绝经而降低。而本研究显示年龄与Sema3A无明显相关性,分析可能与本研究选取的研究对象年龄较大,不能代表一般人群Sema3A水平有关。OC是一种由成骨细胞分化后期分泌的非胶原性、依赖维生素K的蛋白质,其不仅能够调节成骨细胞及破骨细胞的活性,还是骨矿化速率的调节因子。本研究发现2型糖尿病患者骨质疏松组OC、PINP、β-CTX水平更高,血清Sema3A水平与OC、PINP、β-CTX呈负相关趋势,这可能与骨质疏松患者骨转换增加,成骨细胞、破骨细胞活性增强有关。
本研究也存在一定局限性。首先,因为研究的样本量有限,未能对研究对象进行更详细的分层分析,若后续研究中能够继续扩大样本量,可按照T值进行更详细的分组。其次,由于研究对象为2型糖尿病病人,糖尿病病程相对较长,虽然已调整了一些混杂因素,但可能存在部分混杂因素如血糖等仍未被调整。
本研究发现,2型糖尿病合并骨质疏松患者血清Sema3A水平明显降低,校正骨质疏松的可能影响因素后血清Sema3A水平与腰椎骨密度仍呈正相关,与PINP、OC、β-CTX等骨代谢指标有一定相关性。未来Sema3A可能成为筛选抗骨质疏松药物的新的靶点。

