腔内微波和射频消融闭合大隐静脉主干的疗效及安全性对比分析
卢凯平,卢惟钦,杨光唯,来集富,蒋劲松
浙江省人民医院血管外科,浙江 杭州 310014
目前,腔内热消融闭合术是治疗大隐静脉功能不全的主要方法,主要包括腔内激光消融(endovenous laser ablation,EVLA)闭合术和腔内射频消融(radio frequency ablation,RFA)闭合术,以上两种方法获得了美国血管外科学会(Society for Vascular Surgery,SVS)和美国静脉论坛(American Venous Forum,AVF)公布的指南中的1B级推荐[1]。血管腔内微波消融(endovenous microwave ablation,EMA)闭合术是继以上两种方法之后治疗大隐静脉功能不全的一种具有国内特色的腔内微创治疗手段。目前,已有EMA和EVLA的对比研究[2],但国内外关于EMA和RFA的对比研究尚未见报道。本研究采用回顾病例资料,筛选、分层配对病例并分析的方法,对比EMA和RFA在特定人群中治疗大隐静脉功能不全的疗效和安全性,旨在为EMA的临床应用与推广进一步完善依据,现报道如下。
1 资料与方法
1.1 一般资料
收集2019年1月—6月浙江省人民医院收治的大隐静脉功能不全患者的临床资料。纳入标准:(1)随访时间至少为6个月;(2)基础临床表现-病因-解剖-病理生理(clinical etiology anatomy pathophysiology,CEAP)分级为C2~C6级,Ep,As,p,d,Pr,即临床分级为C2~C6级,病因分级为原发性,解剖分级为浅静脉、穿通静脉、深静脉,病理生理分级为反流;(3)具备手术指征,符合SVS和AVF制定的指南中关于EMA的要求[1],即大隐静脉直径要求为2~15 mm;隐股静脉交界处(sapheno-popliteal junction,SPJ )反流时间≥500 ms。排除标准:(1)大隐静脉主干过度扭曲;(2)正在接受抗凝治疗、安装起搏器,以及存在全身性疾病,不能耐受手术;(3)根据一般资料分层配对,检验研究资料,剔除造成两组一般资料差异有统计学意义的病例。根据纳入和排除标准,最终共纳入316例大隐静脉功能不全患者(均为单侧患肢),按照性别、年龄、病程、体重指数、身高、基础CEAP分级、大隐静脉直径,将316例大隐静脉功能不全病例人为干预筛选并分层配对为EMA组(n=157)和RFA组(n=159),使两组各个分层比较差异均无统计学意义(P>0.05,表1),具有可比性。

表1 两组患者的临床特征
1.2 治疗方法
所有患者均由血管外科同一医师治疗,均采用喉罩全身麻醉或腰硬联合麻醉:(1)以点式切口,在筋膜上结扎术前标记的病理性穿通静脉;(2)采用泡沫硬化剂注射治疗膝下曲张浅静脉(1%聚多卡醇注射液和空气按Tessari法1∶4配比,现配现用)。
1.2.1 EMA组
采用EMA闭合大隐静脉主干,设备选择ECO-100B型微波治疗仪,频率为2470 MHz,功率为0~100 W,配套导管型号ECO-100F-2016。在超声定位下穿刺膝下3~5 cm大隐静脉主干,置入6 F血管鞘。在超声引导下将导管送至距隐股交界2 cm处并固定导管,取头高脚低位,排空大隐静脉主干内血液。在超声引导下围绕大隐静脉主干注射肿胀麻醉液,要求深浅筋膜之间被肿胀麻醉液充满,达到距离大隐静脉主干1 cm深度。再次通过超声检查定位导管位置,设定微波功率为55 W,开始进行微波治疗,导管回撤速度在消融起始部为8 s/cm,主干区为4 s/cm。
1.2.2 RFA组
采用RFA闭合大隐静脉主干,使用射频系统,配套导管型号CF7-7-60。置入导管及注射肿胀麻醉液的方法与EMA组相同。该系统采用节段式消融,节段长度7 cm,单次消融时间20 s。消融起始部消融两次,之后根据导管上标记点节段闭合,直至穿刺点。
1.2.3 术后处理及随访
术后加压包扎48 h后改穿20~30 mmHg(1 mmHg=0.133 kPa)弹力袜。术后14 d,患者返院复查,主要复查内容:(1)采用视觉模拟评分法(visual analogue scale,VAS)[1]记录量化指标,包括两组患者的大隐静脉主干闭合段疼痛和皮肤瘀伤情况,评分越高代表疼痛程度越强烈;(2)术后14 d、6个月,再次通过超声复查大隐静脉主干闭合情况。大隐静脉主干未完全闭合判定标准:彩色多普勒超声检查结果显示大隐静脉主干出现血流信号、管腔存在且可压扁的长度大于5 cm判定为阳性。(3)后期2~5年随访目前仍在持续。
1.3 统计学方法
应用SPSS 19.0软件对数据进行统计学分析。计量资料以(±s)表示,符合正态分布的计量资料组间比较采用两独立样本t检验;两组患者术后疼痛和皮肤瘀伤情况差别采用误差图表示;计数资料以n(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 术后大隐静脉主干闭合段术后疼痛和皮肤瘀伤情况
RFA组患者的术后VAS评分相对EMA组患者低,RFA组患者的术后VAS最高评分出现在术后1 d,EMA组患者的术后VAS最高评分出现在术后3 d。术后1~10 d,两组患者的VAS评分存在差异,期间RFA组患者的术后VAS评分低于EMA组患者(图1)。两组患者的术后皮肤瘀伤最高评分均出现在术后4 d;RFA组患者的皮肤瘀伤评分相对EMA组患者低;术后5~9 d,两组患者的皮肤瘀伤评分差异较大(图2)。

图1 术后14 d两组患者大隐静脉闭合段VAS评分
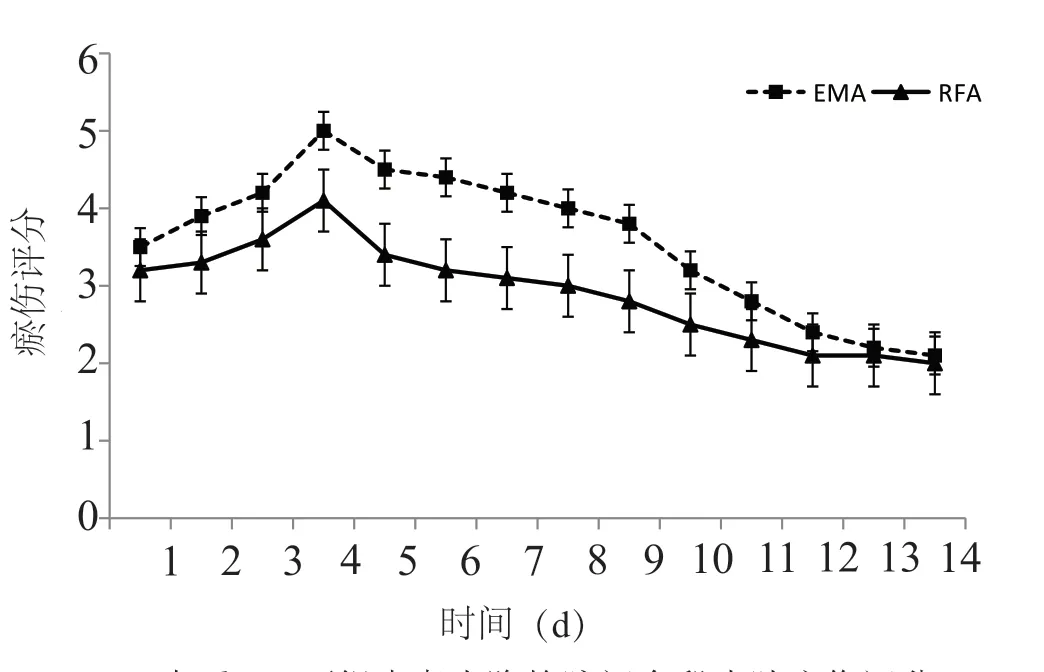
图2 术后14 d两组患者大隐静脉闭合段皮肤瘀伤评分
2.2 术后超声复查治疗段大隐静脉闭合情况
术后14 d,EMA组和RFA组患者的治疗段大隐静脉主干闭合率分别为97%(152/157)、99%(158/159);术后6个月,EMA组和RFA组患者的治疗段大隐静脉主干闭合率分别为94%(147/157)、95%(151/159)。两组患者术后14 d、6个月的治疗段大隐静脉主干闭合率比较,差异均无统计学意义(P>0.05)。对于复查治疗段大隐静脉主干未完全闭合的患者,当日门诊行超声检查,于超声引导下对未闭合段进行泡沫硬化剂(1%聚多卡醇)补充注射治疗。对于患者(包括补充泡沫硬化剂注射患者)的长期闭合率,仍在继续随访中。
2.3 并发症发生情况
316例患者中,共21例患者出现下肢麻木感、针刺感,于内踝处明显,症状于3~6个月内自行消失,EMA组患者占5.7%(9/157),RFA组患者占7.5%(12/159);8例患者下肢穿通静脉结扎切口出现少量淋巴漏,于加压包扎后2周内消失,EMA组患者占1.9%(3/157),RFA组患者占3.1%(5/159)。两组患者的并发症发生情况比较,差异无统计学意义(P>0.05)。未出现下肢深静脉血栓形成、肺栓塞等严重并发症。
3 讨论
3.1 原理异同
EMA和RFA均属于物理热消融范畴,两者的物理原理不同,但均是通过使组织加热、蛋白变性、凝固坏死而达到闭合的目的。一般认为,射频电流与阻抗的关系较大,容易受血流影响,热沉降效应相对明显,需要射频导管贴合血管壁才能达到更好的闭合效果,虽然射频能量穿透浅,但相对可控,更加精准。微波是电磁波,不受阻抗的影响,热沉降效应相对较弱,对组织的穿透较深,能够较好地包裹血管壁,但选择性较差,容易伤及靶向外组织。有研究认为,EMA和RFA在对肿瘤的消融效果、并发症方面无明显差别[3]。但关于两者对大隐静脉消融效果方面的对比研究国内外均未见报道。
3.2 闭合率、安全性的比较
目前,尚无关于EMA和RFA单中心对比研究的相关报道。1999年,美国食品药品管理局(Food and Drug Administration,FDA)批准第一代射频消融设备用于大隐静脉功能不全的消融治疗,最早由Chandler等[4]报道。Lurie等[5]的研究发现,RFA的3年闭合率为75%~92%。Merchant等[6]的研究进行了长期随访,RFA的5年闭合率为87.2%。射频消融系统是近年来的主流,Proebstle等[7]的研究发现,该系统的6个月闭合率为99.6%。该系统因其相对第一代射频操作方便、快捷、闭合可靠的特性,目前被广泛应用于临床,1年闭合率为95%左右[8-9]。
EMA用于消融大隐静脉功能不全,晚于RFA出现,而且种类繁杂。王小平等[10]的研究发现,大隐静脉高位结扎术联合主干EMA治疗大隐静脉功能不全取得较好的疗效,6个月闭合率为100%。2009年,Subwongcharoen等[11]的研究对20例患肢单纯使用EMA闭合大隐静脉主干,术后1周闭合率为100%,术后6个月、1年闭合率降至65%。最近的病例报道中,122条患肢采取大隐静脉高位结扎联合EMA的手术方式,术后6个月、1年的闭合率分别为99%、97%[12]。以上报道均采用不同微波器械进行治疗[10-12],主干闭合率的差别可能与是否进行大隐静脉高位结扎及使用不同微波器械有关。
本研究通过回顾分析已完成随访6个月的病例,采取筛查、分层配对病例的方法进行人为干预,消除两组患者一般资料的统计学差异,除去可造成大隐静脉闭合率不同的因素。本研究结果显示,术后14 d、术后6个月,EMA组和RFA组患者的闭合率均稍低于之前的报道[8,12],但两组患者的闭合率比较,差异无统计学意义。
3.3 EMA在大隐静脉功能不全中的应用与存在问题
关于EMA治疗大隐静脉功能不全的能量设定问题,国内尚未统一。Subwongcharoen等[11]将大隐静脉功能不全患者剥脱的静脉分段埋入猪肉内并围绕静脉注射一定剂量肿胀麻醉液,采用日本Microtaze OT-110M微波仪(2450 MHz)及配套导管,分别设定40 、40 、60 、70 W微波功率,以0.5 cm/10 s的回撤速度进行消融,对比静脉壁热消融及静脉周围组织损伤情况。结果发现,50~60 W的功率能在上述实验环境下取得大隐静脉主干消融和周围组织保护的最佳功率设定,此结论亦被第二阶段临床应用证实。基于此,本研究将微波功率统一设定为55 W,取得了满意的大隐静脉闭合率及可以接受的大隐静脉闭合段并发症。
对于微波导管发热问题,是由EMA和RFA设备的不同构造原理所致,是相对于RFA的一种缺陷,且目前尚难解决,若不注意,可能会导致鞘外导管和皮肤接触性烫伤,以及大隐静脉内导管对静脉壁和周围组织的额外热损伤。对于鞘外导管和皮肤接触性损伤,本研究采取了两种方法尽量避免,具体如下:(1)采用湿盐水纱条隔离鞘管外导管和皮肤;(2)每隔1 min鞘管注射2 ml生理盐水冷却鞘管。临床实践方便有效,本研究中,EMA患者无鞘管外导管皮肤烫伤情况出现。对于大隐静脉内微波导管持续发热,相对射频导管无发热的特性,已在研究通过自动水循环控制导管温度,但目前尚无法优化。这可能是本研究中EMA相对于RFA,除了两者的物理原理存在差异外,在大隐静脉闭合段围手术期皮肤疼痛和瘀伤发生率较高的重要原因之一。
本研究主要是关于EMA和RFA对于大隐静脉闭合的治疗效果及并发症发生情况的对比研究,对于同时伴有穿通静脉功能不全(incompentent perforating vein,IPV)的患者的处理,受限于目前多种腔内设备使用的限制,本研究统一筛选筋膜上IPV结扎联合大隐静脉热闭合的患者进行对比,尽量增加病例数量以便统计分析。大隐静脉功能不全的治疗目前处于一个微创时代,国际主流是RFA和EVLA。微波在肿瘤消融中的应用已有较长的历史,但微波治疗大隐静脉功能不全仍处于初级阶段。根据本研究的治疗经验及相关文献总结,EMA具有主流热消融闭合微创、美观、快速康复、并发症少的特点,而且相对经济;在短期疗效方面,可达到与RFA或EVLA相同的效果,但目前仍缺乏关于疗效和安全性的长期随访数据和大规模的前瞻性随机对照研究。此外,微波导管发热亦是一个不可回避的问题,作为具有中国特色的大隐静脉热消融技术,尚存在设备改进的空间。

