桑椹多酚及其微胶囊对猪肉脯品质的改良
沈双伟,李登龙,林伟玲,张贤斌,刘学铭,林耀盛,唐道邦,王旭苹,程镜蓉*,朱明军
(1.喀什大学生命与地理科学学院,新疆喀什 844000)(2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)(3.叶尔羌绿洲生态与生物资源研究高校重点实验室,新疆喀什 844000)(4.中山市黄圃镇农业服务中心,广东中山 528429)(5.华南理工大学生物科学与工程学院,广东广州 510006)
猪肉脯作为我国市场主要的干肉制品之一,是一种中国传统风味美食。将新鲜的猪瘦肉经过去筋膜、拌料、摊片、干燥、烘烤等系列加工工序后制得肉脯成品,因其色香味独特、营养丰富,且方便携带、深受大众喜爱,具有广阔的市场前景。但是,作为肉制品,猪肉脯的脂质和蛋白质含量较高,在高温烤制与贮运过程中易受到氧、光照及酶等的氧化诱导,使得脂质和蛋白质发生不同程度地氧化,最终影响产品的色泽、风味及其营养价值[1,2]。为了有效调控肉制品的氧化,抗氧化剂被广泛应用于肉制品生产。然而,近年来一些常见的合成型抗氧剂(抗坏血酸,丁基羟基甲苯,丁基羟基茴香醚等)被证实具有潜在致病性和致敏性[3-5]。于是人们开始关注新型绿色、天然的抗氧化剂的开发。研究发现,许多天然植物成分可以作为肉制品的抗氧化剂,改善加工类肉制品的抗氧化活性,且效果可以与传统抗氧化剂相媲美[6]。
桑椹是一种富含多酚类物质的水果,被证实具有广泛的生物活性,如清除自由基,抗糖尿病,神经保护,抗疲劳,抗动脉粥样硬化,抗血栓,免疫调节等[7]。前期研究发现[8-10],桑椹多酚(MP)可有效改善肉制品的氧化稳定性,并赋予肉制品一定的抗氧化性。然而,由于酚类物质的热敏性,桑椹多酚在高温、光照和有氧等环境下易发生降解,必然影响其生物活性的发挥。因此,设法提高酚类物质的热稳定性、改善其加工性能,成为植物多酚在加工肉制品应用中的重要课题。微胶囊是一种有效提高活性物质生物利用度和稳定性的技术,它有助于实现生物活性物质的缓释,减少外界环境对核心材料的影响[11],该技术广泛应用于食品和医药领域,其通过包裹或密封等方式,保护对外界敏感的化合物,是解决物料不稳定问题的一种优良手段。通过该技术对多酚类物质进行保护,可以克服其溶解度低、稳定性差、口感不佳等问题。β-环糊精(β-CD)衍生自淀粉,可以在一定条件下进行生物降解,由于具有亲水性外表面和疏水性内腔,能够与生物活性物质形成包合物,其空腔尺寸适合各种小分子,因此被广泛用作包埋的材料。本实验采用β-环糊精(β-CD)作为壁材制备了桑椹多酚-β-环糊精微胶囊(MPM),将其添入猪肉脯中,探究桑椹多酚对肉脯氧化特性的调控作用并验证微胶囊技术对桑椹多酚的保护作用,以期为植物多酚在肉脯等肉制品加工中的应用提供参考。
1 材料与方法
1.1 原料
猪里脊肉购自广东华润万家超市;β-环糊精,上海市麦克林生化试剂厂;超纯水,美国 Milli-Q纯水仪;ABTS、DPPH、FRAP试剂盒,中国南京建成生物工程研究所,其它试剂均为分析纯。
1.2 仪器与设备
Ultrasonic Cleaner SB25-12清洗池,宁波新芝生物科技有限公司;T25D均质机,德国 IKA集团;UltraScan VIS色度仪,美国 Hunter Lab公司;TA-XT.PLUS质构仪,英国SMS公司;UV-1800紫外-可见分光光度计,日本岛津公司;WRH热泵干燥机,广东威尔信实业有限公司;酶标仪 Gen5,美国Bio Tek公司。
1.3 实验方法
1.3.1 样品制备
1.3.1.1 桑椹多酚的制备
本研究使用的桑椹多酚(MP)源自桑椹(大10)品种,由实验室自制得到,制备方法参照课题组前期研究[12]。样品中总酚、总黄酮和总花青素的含量分别为406.00±1.36 mg 没食子酸当量(GAE)/g、94.47±1.08 mg槲皮素当量(QE)/g和73.59±1.25 mg矢车菊素-3-葡萄糖苷当量(C3GE)/g。
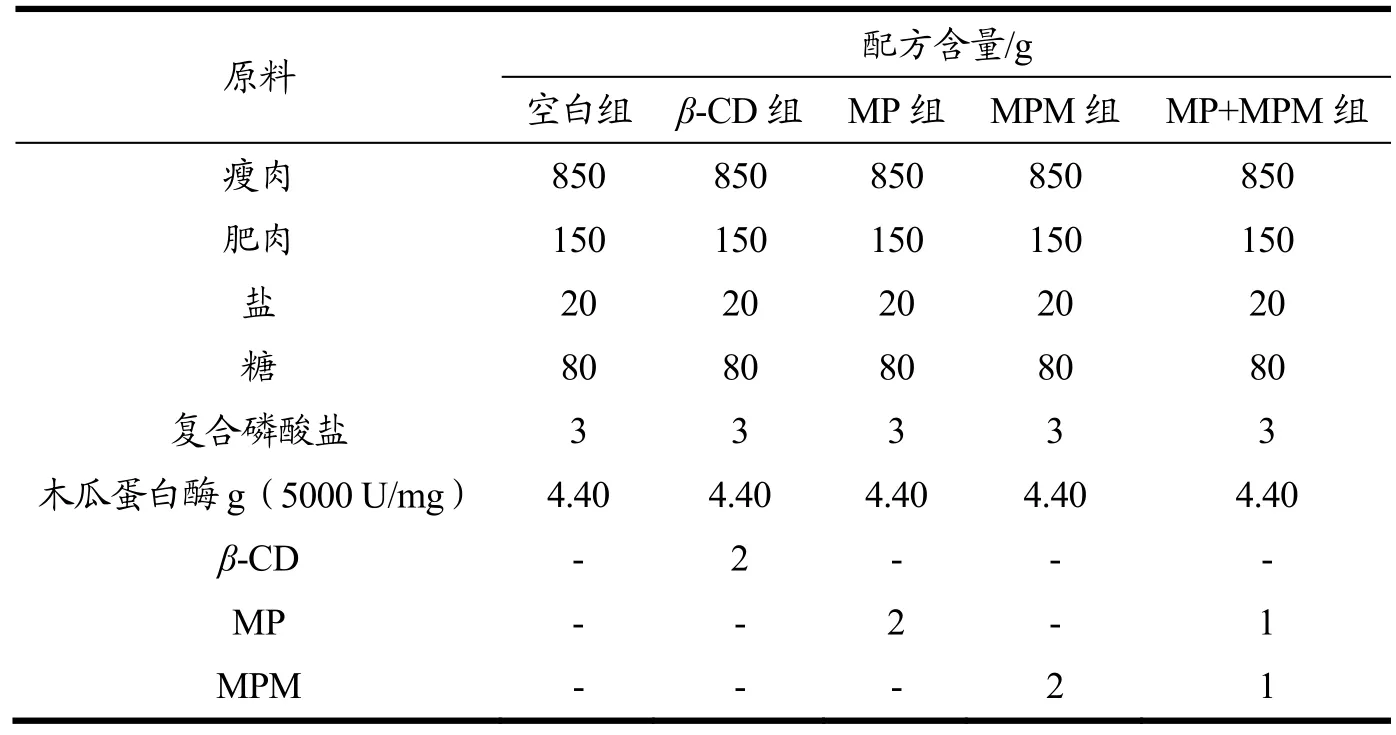
表1 不同处理组肉脯配方Table 1 Different treatment groups of dried minced pork slice
1.3.1.2 桑椹多酚-β环糊精微胶囊的制备
将桑椹多酚与β-环糊精以1:6(m/m)比例溶于蒸馏水,在25 ℃、450 W条件下超声1.5 h。反应结束后,将上述样品溶液在-20 ℃预冻,再使用真空冷冻干燥机冻干。冻干后的固体粉末,即桑椹多酚-β环糊精微胶囊(MPM)。
1.3.1.3 猪肉脯的制作
参考Xu等[13]的方法制作肉脯。猪瘦肉和纯肥肉,用绞肉机分别绞碎。猪肉脯的配方如下:850 g瘦肉、150g纯肥肉、20 g盐、80 g糖、3 g磷酸盐和4.4 g木瓜蛋白酶(5000 U/g)。将搅碎后的肥肉和其他成分用拌料机混合均匀。混合后,制备四组干燥的猪肉切片(具体配方见表1)。然后包括空白组在内进行30 min的搅拌以便彻底混合。混合后的原料制作成4 cm×4 cm×4 cm的正方形。之后,采用热泵干燥(温度55 ℃,湿度30%),直至样品水分含量接近17%。最后,将所有样品在150 ℃下烘烤3 min。待样品冷却至室温后,用聚乙烯袋包装,置于室温(25±2 ℃)光照下保存。
1.3.2 酚类物质的提取
肉脯中酚类物质的提取方法参考 Stojadinovic等[14]的方法并适当修改。向2 g肉脯样品中加入50 mL模拟胃液和50 mL去离子水,在10000 r/min下均质30 s,加入10 mL猪胃蛋白酶溶液(4 mg/mL),在恒温水浴震荡器中,37 ℃、120 r/min消化4 h。使用中速定性滤纸过滤,取上清液使用旋转蒸发仪蒸干水分,收集固体残留物并溶解在20 mL蒸馏水中,即得肉脯多酚粗提液。再将肉脯多酚粗提液和TCA溶液(20%,m/V)以1:1(V/V)比例混合后,漩涡震荡,在10000 r/min下离心10 min,过滤并收集上清液,此步骤重复2次,最终得到的上清液就是肉脯多酚提取液。
1.3.3 总酚含量测定
使用福林酚法测定1.3.2中提取液的总酚含量,参照Lee等[15]方法稍加修改。0.1 mL的提取液中加入2.5 mL福林酚试剂(0.2 mol/L)使用去离子水定容至3 mL后,置于室温反应5 min。再向上述溶液中加入2 mL Na2CO3(7.5%,m/V),室温下避光反应1 h后,于765 nm处测吸光值。用没食子酸制作标准曲线。
1.3.4 肉脯色泽测定
每个样品随机选取三个位置进行采样,使用UltraScan VIS色度仪对样品色度进行测定,记录每一次测得的L*、a*、b*值。
1.3.5 肉脯质构测定
将两块肉脯重叠,使用TA-XT.PLUS质构仪对样品进行测定,探头型号为P50。模式选择为TPA,参数设置如下:测前、测后的速度均为2.0 mm/s、测中速度为1.0 mm/s;两次下压间隔5.0 s;应变和下压距离均为30%。
1.3.6 肉脯抗氧化活性的测定
取5 g样品加入45 mL生理盐水,于10000 r/min均质30 s,将均质后的液体用中速定性滤纸过滤,收集滤液备用。滤液蛋白浓度采用双缩脲法测定。
肉脯的抗氧化活性是依照抗氧化试剂盒使用说明对滤液进行的测定的。
1.3.7 脂质氧化测定
TBARS测定基于Zhang等[16]的方法并进行了适当修改。取肉脯1 g加入9 mL 0.9% NaCl溶液,用均质机在10000 r/min下均质30 s,重复此步骤两次。取0.2 mL匀浆液加入0.2 mL的SDS溶液(8.1%,m/V)、1.5 mL pH 3.5的醋酸缓冲液(20%,V/V)、1.5 mL TBARS水溶液(0.8%,m/V)和0.6 mL双蒸水,放置在95 ℃水浴锅中1 h,取出,迅速冷却至室温后,10000 r/min离心5 min,在532 nm处测定吸光值。用1,1,3,3-四乙氧基丙烷(TEP)制作标准曲线。
参照国标GB5009.227-2016第一法[17]对过氧化值进行测定。
1.3.8 蛋白氧化测定
取2 g肉脯加入20 mL甲溶液(3.5 mmol/L磷酸二氢钾、15.6 mmol/L磷酸氢二钠,pH 7.5),10000 r/min均质30 s后,匀浆使用高速冷冻离心机在4 ℃、10000 r/min下离心10 min,过滤。沉淀中加入20 mL溶液乙(15.6 mmol/L磷酸氢二钠、0.45 mol/L氯化钾、3.5 mmol/L磷酸二氢钾,pH 7.5)10000 r/min下均质30 s后,在4 ℃、10000 r/min条件下离心10 min,过滤,所得滤液为肌原纤维蛋白溶液。
1.3.8.1 蛋白羰基值测定
蛋白羰基值的测定依据 Georgiou等[18]的方法并适当修改。取0.1 mL肌原纤维蛋白溶液,加入0.5 mL 0.02 mol/L 2,4-二硝基苯肼(DNPH),将混合液于 37 ℃水浴15 min之后加入0.5 mL三氯乙酸(20%,V/V),旋涡振荡、10000 r/min离心5 min,沉淀用1 mL无水乙醇和乙酸乙酯(1∶1,V/V)洗涤3次后离心,分离上清后,所得沉淀加入1 mL 6 mol/L的盐酸胍溶液,37 ℃水浴15 min,加入4倍于溶液体积的蒸馏水,在370 nm测吸光值,牛血清蛋白绘制标准曲线,对照组样品采用0.5 mL 2 mol/L盐酸代替DNPH。
计算公式如下:
式中:
A——样品吸光值;
A0——对照组吸光值;
ε——摩尔消光系数(2.1×104L/mol·cm);
C——洗涤后的蛋白浓度。
1.3.8.2 巯基和二硫键含量测定
游离巯基使用Sedlak等[19]的方法并稍加修改。取0.5 mL肌原纤维蛋白溶液加入 2.5 mL Tris-Gly-8 mol/L尿素缓冲液,充分振荡混匀,加入20 μL Ellman试剂,37 ℃水浴15 min后,10000×g离心5 min,测定412 nm处吸光值,对照组使用Tris-Gly缓冲液代替Ellman试剂。
计算公式如下:
式中:
A——样品吸光值;
A0——对照组吸光值;
V——反应总体积;
ε——摩尔消光系数(1.36×104L/mol·cm);
V0——加入样品体积;
C——蛋白浓度。
蛋白总巯基及二硫键含量的测定[20]:取 0.2 mL肌原纤维蛋白溶液,依次加入2 mL Tris-Gly-8 mol/L尿素溶液,20 μLβ-巯基乙醇,在37 ℃下水浴15 min后加入50% TCA至最终浓度为10%(m/V),10000 r/min离心5 min,取出上清,沉淀用丙酮洗涤三次后,加入3 mLTris-Gly-8 mol/L尿素缓冲液和20 μL Ellman试剂,充分混匀后,将悬浮液置于37 ℃下水浴15 min,取出,10000 r/min离心5 min,测定上清液在412 nm吸光度。对照组加入20 μL Tris-Gly缓冲液代替Ellman试剂。总巯基含量的计算同游离巯基;二硫键含量为总巯基与游离巯基含量的差值。
1.3.9 数据分析
每个实验都进行3次独立实验,数据结果为平均值±标准差。使用SPSS 19.0统计软件程序做出分析。使用Anova和Duncan的多重范围检验来进行显着性差异分析,其中p<0.05才认定有统计学意义。
2 结果与讨论
2.1 肉脯中酚类物质稳定性分析
如图1所示,贮藏期间,各实验组肉脯总酚含量(TPC)均出现不同程度下降,且在加工和储藏前期损失最严重。这说明加工和贮藏过程伴随着多酚的降解。贮藏28 d后,添加MP组中TPC值较初始值减少了68.32%,这说明多酚的稳定性可能受到光照和氧的影响。利用β-环糊精对MP进行包埋后,肉脯(添加MPM)的TPC保留率提高到54.55%,较处理前(MP组)提升了71.06%。由于环糊精分子呈锥形的中空圆筒立体环状结构,其表面亲水,而内部空腔疏水,能够与疏水化合物形成包合物,不仅可以提高溶解度和生物利用度,还可以减弱环境因子(氧、温度和光等)对活性物质造成的应激损伤[21]。这也是MPM中多酚稳定性提高的原因。与本实验结果类似,Wang等[22]发现,β-CD可以较好的包埋八角多酚,提高其稳定性和溶解性。因此,以β-环糊精包埋的桑椹多酚部分替代 MP,所得的肉脯酚类物质的含量较对照组有了显著的提高。其中,未受到β-环糊精保护的酚类物质的热损失是造成肉脯酚类物质损失的主要原因。另外,除了氧化损伤外,酚类物质与肉制品中碳水化合物、脂质和蛋白质等成分的结合也会影响酚类物质的提取率[23],造成可提取酚含量的下降。与我们推测相一致,Pešić等[24]研究发现将葡萄皮提取物加入含有火鸡肉的混合食物基后,葡萄皮花青素会与肉类蛋白等成分相互作用导致其含量下降。总的来看,β-环糊精对桑椹多酚进行包埋,可有效提高桑椹多酚在肉脯加工和贮藏过程中的稳定性。
2.2 MP及MPM对肉脯色泽的影响
由表 2可知,在肉脯制作过程中,添加 MP及MPM 会使肉脯L*(亮度)、a*(红度)和b*值(黄度)下降,这可能是因为桑椹多酚富含花青素,如矢车菊素-3-葡萄糖苷和矢车菊素-3-芸香糖苷,在肉制品弱酸性的环境中呈现紫红色,影响了肉脯的色泽。然而,相较MP组,添加MPM的肉脯色泽有了明显改善,这主要是因为β-CD在一定程度上掩盖了桑椹多酚颜色,减少桑椹多酚对肉脯色泽带来的不良影响。在贮藏期间,对照组肉脯的L*值下降,这可能是肉脯氧化所导致。与本研究相似,Wang等人[25]在研究中也发现兔肉氧化会导致L*值下降。值得注意的是,所有添加MP肉脯在储藏过程中L*、a*和b*值均呈增加趋势。L*值和a*值的变化,主要源于酚类物质的降解[10]。与本研究结果相似,徐亮[26]使用阿拉伯胶对桑椹多酚进行包埋处理并用于肉脯的研究,同样发现添加桑椹多酚的肉脯在贮藏20 d后L*值和a*值上升。然而,总体而言,对MP进行微胶囊处理后,MPM组L*、a*值的增幅高于MP组样品。该现象说明可能是β-CD对多酚的包埋和缓释作用降低了酚类物质在储藏过程中的降解。实验组肉脯中b*值可能是由于肉蛋白中变性珠蛋白的氧化降解和血红素色素的氧化裂解,使得铁从血红素分子中释放出来,造成b*值的改变[27]。总体而言,利用β-CD对桑椹多酚进行微胶囊处理有助于改善由MP对肉脯色泽带来的不利影响。

表2 肉脯在贮藏期色泽的变化Table 2 Color variation of the dried minced pork slice during storage
2.3 MP及MPM对肉脯质构的影响
质构是影响肉脯品质的重要因素。由表3可知,空白组和实验组肉脯在贮藏期间的弹性、凝聚力和回复性无显著差异(p>0.05),硬度和咀嚼性均有所增加,这可能是在贮藏过程中水分迁移和蛋白质氧化所致。在贮藏期第0 d,MP组样品的硬度和咀嚼性较空白组有明显改善。有研究表明[26],抗氧化剂可以降低肉脯因蛋白质和脂质的氧化而引起的肌肉膜损伤,保护肌肉纤维的完整性,使硬度降低。因此我们推测,可能是桑椹多酚中酚类物质有效缓解了肉脯加工过程中的氧化,改善了肉脯的质构。与本研究结果相似,Zhang等[16]研究发现鼠尾草可以显著减少氧化引起的香肠质地下降;方辉[28]发现迷迭香作为肉制品氧化抑制剂,可有效缓解由于火腿氧化造成的硬度和咀嚼性的上升。在贮藏过程中,添加了MP及MPM的实验组肉脯硬度和咀嚼性均低于空白组。其中MP+ MPM组的效果最佳,这可能是由于MPM可以实现多酚的缓释,进一步改善肉脯的氧化稳定性和质构特性。

表3 肉脯在贮藏期的质构变化Table 3 Texture variation of the dried minced pork slice during storage
2.4 MP及MPM对肉脯抗氧化活性的影响
本研究通过DPPH清除能力、ABTS法和FRAP法测定总抗氧化能力来评估肉脯的抗氧化活性,如图2所示,对照组肉脯的抗氧化能力较低(ABTS清除能力、FRAP还原能力和DPPH清除率分别为77.00 μmol equivalent/mg sample、6.48 μmol equivalent/mg sample和36.51%),桑椹多酚中酰化花色素苷、酚酸等物质具有较强的抗氧化活性,当添加MP后,肉脯的抗氧化能力显著提高(ABTS清除能力、FRAP还原能力和 DPPH清除率、分别达到 156.33 μmol equivalent/mg sample、142.01 μmol equivalent/mg sample和64.02%)。这说明桑椹多酚作为一种抗氧化剂可改善肉脯的抗氧化性,这与Arun K等[29]和Li等[30]的研究结果是一致的。MP经包埋后一定程度上降低了肉脯的抗氧化能力,这可能是β-环糊精与桑椹多酚结合后,形成的微胶囊促成了桑椹多酚的缓释所致。胡方斌[31]研究与本实验结果相类似,他采用PLGA载虾青素纳米粒,发现包埋后虾青素的ABTS自由基清除能力下降。此外,我们注意到MP和MPM混合添加组的肉脯抗氧化能力在各组中是最强的,这再次证实肉脯抗氧化活性的提高源于桑椹多酚的介入,β-CD作为多酚保护剂,实现了酚类物质的缓释,减少了其在热加工过程中的损失,从而提高了肉脯的抗氧化能力。
2.5 MP及MPM对肉脯脂质氧化的影响
本实验选择过氧化值和TBARS值来表征肉脯的脂质氧化程度。如图3(a、b)所示,在贮藏期第0 d对照组肉脯过氧化值和TBARS值相对较高,且随着贮藏时间的增加,二者数值呈上升趋势;MP的添加显著缓解了该趋势。这可能是因为桑椹多酚富含黄酮化合物,具有清除自由基和螯合金属离子的活性,可以延缓脂质氧化[32,33]。在贮藏28 d后,相对对照组(未添加任何抗氧化剂),添加 MP的肉脯过氧化值和TBARS值分别降低了74.80%和15.91%,这同样证明MP可有效缓解肉脯在热加工和贮藏过程中的脂质氧化。与本结论类似的,姚波[34]将 0.15%的茶黄素和0.15%脂溶性茶多酚加入牛肉棒,可有效延缓牛肉棒的脂质过氧化,延长产品的保质期。将MP制成微胶囊(MPM)后,肉脯在贮藏过程中过氧化值和TBARS值较前者略有增加,这同样是因为桑椹多酚的屏障作用减弱了多酚与自由基的直接作用所致。尽管如此,其值仍显著低于对照组。值得注意的是,贮藏末期,添加MP+MPM组肉脯的脂质氧化程度在各组中是最低的,这说明MP和MPM二者在调控肉脯氧化过程中可能存在协同作用。
2.6 MP及MPM对肉脯蛋白质氧化的影响
半胱氨酸残基上巯基的氧化会导致SH和S-S数量改变[20],因此,巯基和二硫键的变化被广泛用于蛋白质氧化程度的表征。图4、5描述了肉脯在贮藏过程中巯基和二硫键的变化。可以发现,在贮藏过程中,巯基含量呈现逐渐下降的趋势而二硫键呈上升趋势。空白组的巯基水平最低,从第0 d的57.81 nmol/mg蛋白质减少到 36.29 nmol/mg蛋白质,二硫键含量由79.94 nmol/mg蛋白质增加至91.19 nmol/mg蛋白质。这说明储藏过程中伴随着蛋白质的氧化降解,造成巯基向二硫键的转化。添加桑椹多酚后,样品的巯基含量显著提高,同时二硫键生成量显著降低。该结果说明,桑椹多酚可以有效抑制肉脯中蛋白质氧化,这可能是因为桑椹多酚中的酚羟基竞争性地与过氧自由基反应,从而保护巯基不受破坏,减少了二硫键的生成。与本实验结果相类似的,Wei等[35]发现酚类物质可以维持蛋白质构象(增加氢键,减少二硫键),延缓蛋白质变性和降解,在冷冻过程中,多酚可以用来保持罗非鱼片的质地和延长其货架期。在向荣[36]的研究中同样发现,多酚可以延缓广式腊肠中巯基的降低,抑制二硫键的产生。
如图6所示,与肉脯贮藏期巯基和二硫键变化得出的结论相似,MP和MPM的添加抑制了肉脯中羰基含量的增加,减缓了肉脯中的蛋白质氧化。张慧芸等[37]发现,添加0.05%鞣酸和0.25%没食子酸,可显著抑制肌原纤维蛋白羰基和二聚酪氨酸含量的增加。与本研究结果相似,Xiang等[38]的研究中也指出桑椹多酚可以较好的抑制腊肠中蛋白质的氧化。由于β-CD的屏障作用,单纯添加MPM组的肉脯抑制氧化效果略低于MP组。此外,酚类物质与蛋白质的相互作用,对蛋白质结构的修饰作用也是造成肉脯蛋白质氧化稳定性提高的重要原因。Cheng等[39]研究中发现,桑椹多酚与肌原纤维蛋白相互作用,有助于提高蛋白质的结构稳定性和氧化稳定性。与脂质氧化结果相似,以MPM部分替代MP加入肉脯中可进一步改善肉脯的蛋白质氧化稳定性。这可能与β-环糊精自身的抗氧化性有关(添加β-环糊精的样品羰基化程度也弱于对照组),但更重要的是微胶囊实现了多酚的缓释,提高了酚类物质的稳定性。一方面未被包埋的酚类物质凭借其酚羟基捕捉自由基和螯合金属离子的形式抑制蛋白质的氧化,造成酚类物质的氧化损失;与此同时,被包埋的酚类物质被缓慢释放,弥补了游离酚类物质的损失。
3 结论
本研究探讨了β-环糊精作为多酚保护剂在改善桑椹肉脯品质中的作用。研究结果发现β-环糊精可以有效提高肉脯加工和储藏过程中酚类物质的稳定性,缓解酚类物质对肉脯色泽带来的不利影响。以β-环糊精作为壁材制备桑椹多酚微胶囊(MPM),用于肉脯加工,可以进一步改善肉脯的质构和氧化稳定性,提高产品的抗氧化活性。其中,以MPM部分替代MP制作的肉脯抗氧化活性和氧化稳定性最佳。由于桑椹多酚的成分较为复杂,β-环糊精与桑椹多酚间的相互作用在肉脯氧化稳定性提升中发挥的作用机制还有待进一步研究。

