蛛网膜下腔出血大鼠脑组织载脂蛋白E的表达升高
张立,王托弟,黄旌,李彦军,李卫华
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是多种病因导致血液进入蛛网膜下腔所引起的临床疾病,具有高死亡率和高致残率等特点,多数是由颅内动脉瘤破裂引发[1]。有研究显示大约10%的SAH患者在接受治疗前死亡,30%左右在发病后48 h内死亡,50%在发病30 d内死亡[2]。该病的发生机制还不明确,涉及脂质过氧化和细胞凋亡、急性颅内压升高导致脑缺血、脑水肿、神经元死亡等[3]。特别是过量的钙离子通过电压门控通道内流导致大量神经递质谷氨酸的释放,也使得血脑屏障受损,各种蛋白酶和磷脂酶被激活,并释放大量活性因子,从而导致持续性神经损伤[4,5]。目前对于SAH的治疗缺乏特异有效手段,仅限于手术清除血肿、降颅压、神经营养药物等,为此寻找新的治疗方法与治疗靶点具有重要价值。载脂蛋白E(apolipoprotein E,ApoE)是一种多功能的糖蛋白,由α和β两个亚单位构成[6]。正常脑组织内,ApoE由神经元及星形胶质细胞表达,而在脑组织出现损害时,则主要由星形胶质细胞表达[7,8]。ApoE是一个细胞存活基因,可参与调节细胞凋亡、细胞膜保护、补体调控、DNA修复等多种作用,可在缺血性脑血管病、神经系统肿瘤、痴呆中表达并发挥细胞保护的作用[9,10]。本文探讨ApoE对SAH大鼠血脑屏障的影响,从而探索ApoE在SAH的病理生理过程中的作用机制,现报道如下。
1 材料与方法
1.1 材料
Sprague-Dawley(SD)大鼠60只由本医院实验动物中心提供(雄性,鼠龄2~3月,体质量220~240 g),置于具有湿度控制,恒定温度(25℃)、12 h/12 h光照/黑暗循环的环境中进行饲养,单笼饲养,保持环境安静与充足的食物及水供应。研究得到医院动物伦理委员会的批准,所有操作严格遵守动物伦理。将所有大鼠随机分为空白对照组、假手术组、模型组各20只,每组随机于造模后1 d、7 d分别处死10只大鼠。
1.2 方法
SAH模型制备:模型组大鼠进行深度麻醉并固定,沿大鼠颈正中线剪开皮肤,暴露左侧颈动脉三角。充分游离颈内动脉(internal carotid artery,ICA)与颈外动脉(external carotid artery,ECA),切断吻合支后,将ECA近心端结扎并离断拉直,临时阻断颈总动脉近心端和颈内动脉夹上的血流,并预留松线结。取尼龙线由颈外动脉上剪开的小口处穿入,固定穿刺线,松开血管夹。在颈内动脉内推送穿刺线至深度约20 mm处,刺破血管后拔出尼龙线,结扎颈外动脉残端,恢复颈内动脉、颈总动脉的血流,缝合切口。假手术组除最后一步遇到阻力时不穿破血管壁之外,其余操作同模型组。空白对照组不进行实验操作。造模成功标准:0级,无神经缺失症状;1级,将大鼠尾巴提起,瘫痪侧前肢回收屈曲于腹下,正常侧前肢向地面伸展;2级,除1级症状外,向瘫痪侧推大鼠时阻力较对侧显著降低;3级,除2级体征外,大鼠有向瘫痪侧旋转的行为。神经症状达1级、2级、3级就可判断为建模成功。
1.3 观察指标
1.3.1 神经功能障碍评分 根据自发活动、对称运动、前肢对称外展、爬铁笼壁等6个维度进行神经功能评分,分为0~3分,分数越低,神经功能障碍越重。
1.3.2 伊文思蓝(Evans Blue,EB)含量测定 将大鼠麻醉后,将5 mL/kg 2%EB生理盐水经股静脉注入到大鼠的体内。1 h后处死大鼠,在左心室剪出一个小口,沿左心室尖向主动脉方向将灌流针头插入并固定,在右心耳剪一缺口。将生理盐水推入大鼠体内进行灌注,直到右心耳流出的液体变澄清为止。然后取出大鼠的脑组织,匀浆后采用乙醇进行稀释,15 000 rpm离心30 min,取上清液,计算样品的EB含量。
1.3.3 脑含水量测定 取大鼠的手术侧脑半球,测定脑含水量,脑含水量=(湿重-干重)/湿重×100%。
1.3.4 ApoE蛋白测定 取大鼠的手术侧脑半球,加入蛋白裂解液后进行组织匀浆,冰上静置30 min后,4℃,12 000 rpm/min离心30 min,吸取上清,上样SDS-PAGE电泳,转膜后封闭2 h,加入一抗(抗ApoE抗体,1∶2 000)4℃孵育过夜,洗涤3次后加入二抗(1∶5 000),37℃孵育2 h,洗涤3次后进行曝光检查。
1.4 统计学处理
采用SPSS19.0软件对所有数据进行分析,计量资料以(均数±标准差)表示,行正态性检验和方差齐性检验后,两两对比采用t检验,相关性分析采用Pearson分析,P<0.05为差异有统计学意义。
2 结果
2.1 神经功能障碍评分对比
3组大鼠在建模过程中都无死亡情况发生,模型组造模后1 d、7 d的神经功能障碍评分低于空白对照组与假手术组(P<0.05),假手术组与空白对照组比较差异无统计学意义(P>0.05),见表1。
表1 3组大鼠造模后不同时间点的神经功能障碍评分对比(分,±s)
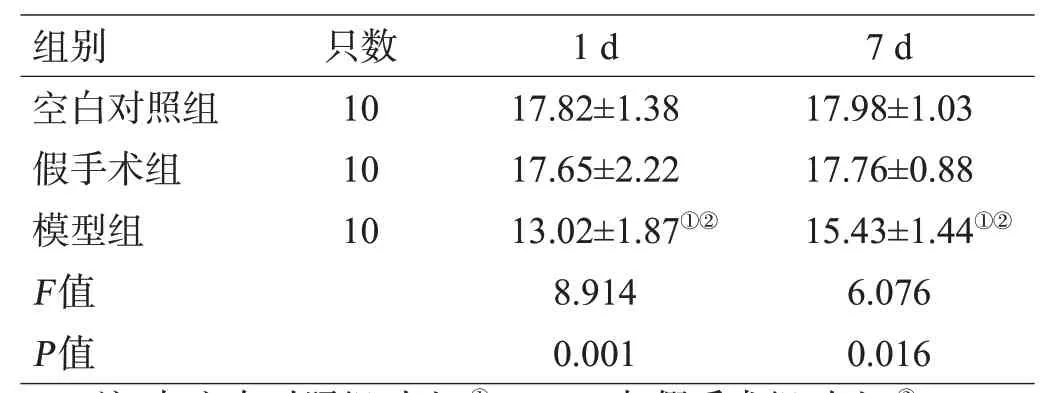
表1 3组大鼠造模后不同时间点的神经功能障碍评分对比(分,±s)
注:与空白对照组对比,①P<0.05;与假手术组对比,②P<0.05
组别空白对照组假手术组模型组F值P值只数10 10 10 1 d 17.82±1.38 17.65±2.22 13.02±1.87①②8.914 0.001 7 d 17.98±1.03 17.76±0.88 15.43±1.44①②6.076 0.016
2.2 血脑屏障通透性对比
模型组造模后1 d、7 d的脑组织EB含量显著高于空白对照组与假手术组(P<0.01),假手术组与空白对照组比较差异无统计学意义(P>0.05),见表2。
表2 3组大鼠造模后不同时间点的脑组织EB含量对比(μg/g,±s)
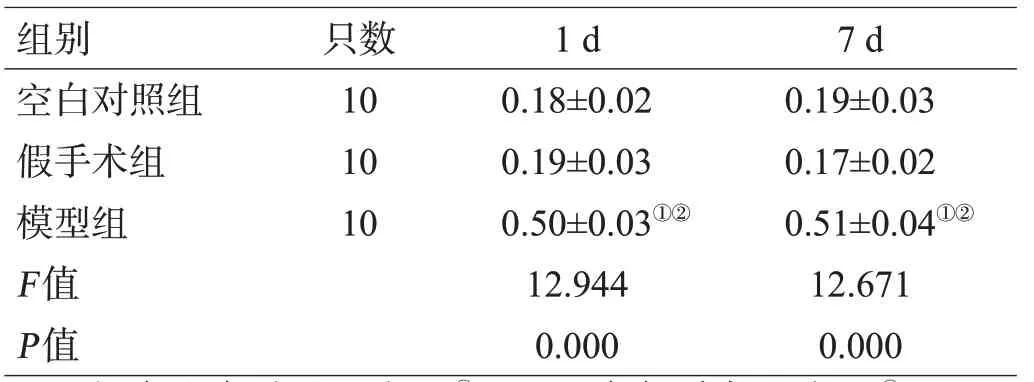
表2 3组大鼠造模后不同时间点的脑组织EB含量对比(μg/g,±s)
注:与空白对照组对比,①P<0.01;与假手术组对比,②P<0.01
组别空白对照组假手术组模型组F值P值只数10 10 10 1 d 0.18±0.02 0.19±0.03 0.50±0.03①②12.944 0.000 7 d 0.19±0.03 0.17±0.02 0.51±0.04①②12.671 0.000
2.3 脑含水量变化对比
模型组造模后1 d、7 d的脑含水量显著高于空白对照组与假手术组(P<0.01),空白对照组与假手术组对比差异无统计学意义(P>0.05),见表3。
表3 3组大鼠造模后不同时间点的脑含水量变化对比(%,±s)
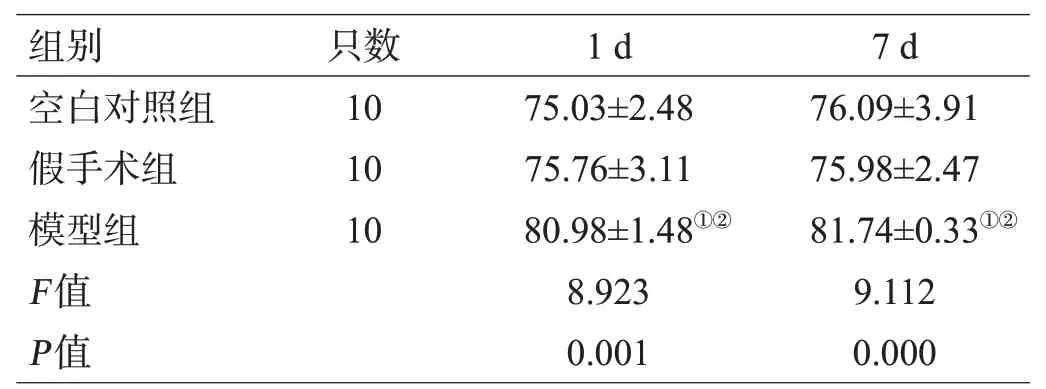
表3 3组大鼠造模后不同时间点的脑含水量变化对比(%,±s)
注:与空白对照组对比,①P<0.05;与假手术组对比,②P<0.05
组别空白对照组假手术组模型组F值P值只数10 10 10 1 d 75.03±2.48 75.76±3.11 80.98±1.48①②8.923 0.001 7 d 76.09±3.91 75.98±2.47 81.74±0.33①②9.112 0.000
2.4 ApoE蛋白相对表达水平对比
模型组造模后1 d、7 d的脑组织ApoE蛋白相对表达水平显著高于空白对照组与假手术组(P<0.01),假手术组与空白对照组比较差异无统计学意义(P>0.05),见表4。
表4 3组大鼠造模后不同时间点的ApoE蛋白相对表达水平对比(±s)
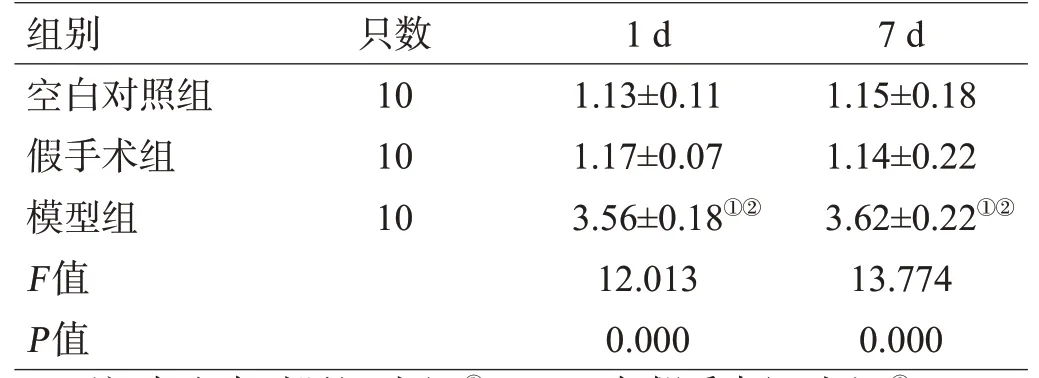
表4 3组大鼠造模后不同时间点的ApoE蛋白相对表达水平对比(±s)
注:与空白对照组对比,①P<0.01;与假手术组对比,②P<0.01
组别空白对照组假手术组模型组F值P值只数10 10 10 1 d 1.13±0.11 1.17±0.07 3.56±0.18①②12.013 0.000 7 d 1.15±0.18 1.14±0.22 3.62±0.22①②13.774 0.000
2.5 相关性分析
在模型组中,Pearson分析显示造模后1 d、7 d的脑组织ApoE蛋白相对表达水平与EB含量呈正相关(r=0.562,P=0.003;r=0.587,P=0.001)。
3 讨论
SAH具有高死亡率和高致残率等特征。尽管近年来临床上关于SAH的诊治手段均有显著进步,但该病患者的预后依然较差[11]。良好的SAH动物模型建立是研究脑SAH的前提,本实验建立的SAH动物模型的血管解剖及生理接近人类,价格低廉且容易管理和实施手术,且易于病理学和生化学观察[12]。本研究显示3组大鼠在建模过程中都无死亡情况发生,模型组造模后1 d、7 d的神经功能障碍评分都低于空白对照组与假手术组,空白对照组与假手术组对比差异无统计学意义;模型组造模后1 d、7 d的脑含水量显著高于空白对照组与假手术组,空白对照组与假手术组对比差异无统计学意义,表明SAH大鼠伴随有脑含水量增加与神经功能障碍。
SAH除了脑出血造成的水肿压迫、病灶周围缺血外,也会引起补体的激活,造成神经细胞毒性、细胞凋亡等继发性脑损伤,其中涉及Apo蛋白的异常表达[13]。ApoE的相对分子质量约70 000~80 000,可与ApoA、ApoJ一起形成高密度脂蛋白复合物,参与末端补体反应[14]。人ApoE mRNA在脑中浓度最高,在睾丸、肺、脾、卵巢、乳腺和膀胱也有表达。在神经元受损伤时,ApoE的表达可能增加,呈聚集状态,并起到保护细胞的作用[15]。本研究显示模型组造模后1 d、7 d的脑组织ApoE蛋白相对表达水平显著高于空白对照组与假手术组,空白对照组与假手术组对比差异无统计学意义,提示ApoE参与SAH的病理生理过程。相关研究也表明,ApoE可作为反凋亡信号,抑制补体蛋白形成膜攻击复合体,也具有抗氧化作用,可通过抑制补体激活从而阻止神经细胞损伤[16]。还有研究表明ApoE是一种膜攻击复合物形成的抑制剂,可形成水溶性的亚溶解量细胞活性的复合物,从而阻止膜攻击复合物的形成[17]。
细胞凋亡和坏死可参与神经元的死亡,都涉及血脑屏障通道异常激活或被打破。特别是在SAH患者中,血脑屏障损伤较轻者,能在机体血压和颅内压发生变化时维持脑血流量的相对稳定;血脑屏障受损越重,脑血管痉挛和继发性脑缺血的发生率越高[18,19]。本研究显示模型组造模后1 d、7 d的脑组织EB含量显著高于空白对照组与假手术组,空白对照组与假手术组对比差异无统计学意义,表明SAH大鼠多伴随有血脑屏障被破坏。ApoE存在于身体的各种体液中,ApoE在补体的激活中具有调节作用,能抑制补体的激活,也可抑制补体膜攻击复合物的活性[20,21]。本研究Pearson分析显示SAH组造模后1 d、7 d的脑组织ApoE蛋白相对表达水平与EB含量都存在正相关性,说明ApoE蛋白表达水平越高,SAH大鼠血脑屏障被破坏程度越重,脑组织损伤程度越重。不过本研究没有具体阐述ApoE的信号传导机制,也没有从多方面分析血脑屏障改变情况,将在后续研究深入探讨。
总之,SAH大鼠多存在ApoE的高表达,且伴随血脑屏障破坏,导致大鼠脑含水量增加与神经功能障碍,两者存在相关性。
