氯氮平治疗抗NMDAR脑炎合并精神障碍患者代谢组学研究
孙珞滢,梁小丽,李冬凤,刘学军,周志强
抗N-甲基-D-天冬氨酸受体(N-methyl-D-aspartate receptor,NMDAR)脑炎是一种由抗NMDAR抗体介导的自身免疫性脑炎[1]。NMDAR是离子型谷氨酸受体的一个亚型,主要存在于额叶和边缘系统,其作用包括调节突触传递、触发突触重塑及参与学习记忆等,其功能障碍与脑发育、精神行为异常、药物成瘾、神经退行性变等有关[2]。抗NMDAR脑炎多急性起病,儿童、青年多见,女性多于男性[3]。约70%的抗NMDAR脑炎患者主要表现为急性或亚急性精神病发作,且病情发展迅速[4],大多数患者既往无精神症状史,常被精神科收治,诊断较困难[5]。抗NMDAR脑炎多依赖脑脊液和血清抗NMDAR抗体检测[6],但精神分裂症患者中也发现了抗NMDAR抗体[7,8],因此,在临床上寻找可用于辅助诊断NMDAR脑炎合并精神障碍的一些小分子生物标记物尤为重要。
目前抗NMDAR脑炎治疗的方案包括免疫治疗、对癫痫发作和精神症状的治疗、康复治疗。抗NMDAR脑炎合并精神障碍治疗现在缺乏统一、标准的治疗方案,由于案例较少,使得这类患者的治疗变得更加困难,笔者前期使用氯氮平干预抗NMDAR脑炎合并精神障碍患者,发现能显著改善患者精神症状[9],但尚未有明确的生物标志物作为可靠的用药效果评估依据。本文利用超高效液相色谱串联质谱(Ultra Performance Liquid Chromatography Tandem Mass Spectrometry,UPLC-MS/MS)代谢组学的方法分析抗NMDAR脑炎合并精神障碍患者用药前后与健康对照血清、尿液中的代谢物差异,以期能更早地发现抗NMDAR脑炎合并精神障碍的发生,同时为氯氮平治疗抗NMDAR脑炎合并精神障碍提供新的证据。
1 资料与方法
1.1 一般资料
选取确诊为伴有精神症状的抗NMDAR脑炎患者18例为患者组。纳入标准:符合2016年Graus及2017年中国自免脑炎专家共识抗NMDAR脑炎的诊断标准[10];血清和脑脊液抗NMDAR抗体阳性;符合ICD-10中由于脑损害和功能紊乱以及躯体疾病引起的其他精神障碍诊断标准;年龄18~60岁;获得法定监护人的书面知情同意;使用3种抗精神病药物治疗各1月,临床疗效总评量表(clinical global impression,CGI)[11]无效。排除标准:孕期或哺乳期妇女;合并卵巢畸胎瘤或其他肿瘤;使用氯氮平出现严重粒细胞减少;其他性质脑炎。18例患者中,男7例,女11例;平均年龄(25.06±2.98)岁;平均体质量指数(body mass index,BMI)为(22.12±1.48)kg/m2;平均病程为(8.83±2.64)d。另选取同期在我院进行健康体检的正常健康人18例为对照组,男9例,女9例;平均年龄(25.94±3.47)岁;平均BMI为(21.78±1.43)kg/m2。2组的性别、年龄、BMI差异无统计学意义(P>0.05)。患者脑脊液抗NMDAR抗体均为阳性,滴度测定为1∶4 4例,1∶16 4例,1∶32 6例,1∶100 4例,见图1A~D。
1.2 方法
1.2.1 治疗方法 所有患者均在完成免疫球蛋白疗程治疗后给予氯氮平治疗[9],重症患者可联合激素冲击治疗后进行氯氮平治疗:均从25 mg开始,每日2次,根据症状加至100~300 mg/d。最终剂量100 mg/d 4例,患者150 mg/d 6例,200 mg/d 4例,300 mg/d 4例,氯氮平最终剂量以治疗1月内CGI疗效总评分2分时氯氮平剂量为准,每周监测血常规、肝肾功能,15 d监测脑电图,连续治疗24周[9],治疗24周后所有患者复查脑脊液抗NMDAR抗体滴度均为1∶1,见图1E~H。

图1 患者治疗前(A~D)、后(E~H)脑脊液中抗NMDAR受体抗体滴度
1.2.2 样品采集方法及制备 对照组及患者组治疗前后,禁食12 h,于清晨7时左右安静状态下分别使用真空采血管采集5 mL静脉血,室温下3 000 r/min离心10 min,取上清分装,于-80℃保存。另取2组晨尿,置于塑料管中,于-80℃冰箱保存。取出上述冻存的血清样品,在4℃条件下解冻,每份标本取出血清100μL备用。尿样在室温下完全解冻,并在4℃以13 000 r/min离心15 min,每份标本取出上清50μL备用。
1.2.3 色谱条件 ACQUITY UPLCTM BEH C18柱(100 mm×2.1 mm,1.7μm),流速0.25 mL/min,柱温40℃,样品室温度4℃,进样量5μL,流动相A:10 mmol/L醋酸铵水溶液(pH 4.0),流动相B:乙腈,梯度洗脱:0~2 min,0%~10%B,2~11 min,10%~95%B。
1.2.4 质谱条件 ESI离子源,正负离子同时检测,代谢谱分析采用全扫描方式,扫描范围100~1000 Da,毛细管电压3.0 kV(ESI+)、2.9 kV(ESI-),锥孔电压35 V(ESI+)、25 V(ESI-),源温度120℃。去溶剂温度:350℃,去溶剂气流速400 L/h,锥孔反吹气流速:50 L/h。
1.3 观察指标
采用阳性与阴性症状量表(positive and negative syndrome scale,PANSS)、CGI[10]及改良Rankin量表(modified Rankin scale,mRS)评估患者精神状况、临床疗效及神经功能,对照组评定1次,患者组在氯氮平治疗前后各评定1次。PANSS为他评量表,主要适用于成年精神分裂症患者,所有项目均按照1~7分评分,分值越高,表示精神症状越严重。CGI是一种总体评定量表,用于评定临床总体疗效,由3个分量表组成,包括病情严重程度(severity of illness,SI)、疗效总评(global impression,GI)和疗效指数(efficacy index,EI)3项,SI采取“0~7”8级评分,根据患者的病情进行评估,从0(无病)~7(极重);GI也是采取“0~7”8级评分,根据患者的病情与研究开始时比较做出评估;EI根据综合治疗效果和治疗引起的副反应进行评定。mRS[11]是一种简化的整体评估患者神经功能的量表,用于评估患者神经功能恢复状况。
1.3 统计学处理
采用SPSS17.0统计学软件分析数据,计量资料以(±s)表示,2组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。用XCMS软件对代谢物离子峰进行样本检测数据提取,使用LOESS方法对数据进行标准化。采用帕累托缩放(Perato Scaling)方法进行归一化,然后应用Metabo Analyst3.0软件进行主成分分析法(PCA),偏最小二乘回归分析(PLS-DA)。根据VIP值和P值统计,筛选潜在生物标志物。同时用Graghpad8.0软件对用药前后各潜在生物标志物进行疾病诊断和药物效果能力的评估。
2 结果
2.1 治疗前后患者组临床评分比较
患者组治疗后的PANSS、SI、GI、EI及mRS评分下降,与治疗前相比有显著性差异(均P<0.01),见表1。
表1 治疗前后患者组各项评分比较(分,±s)
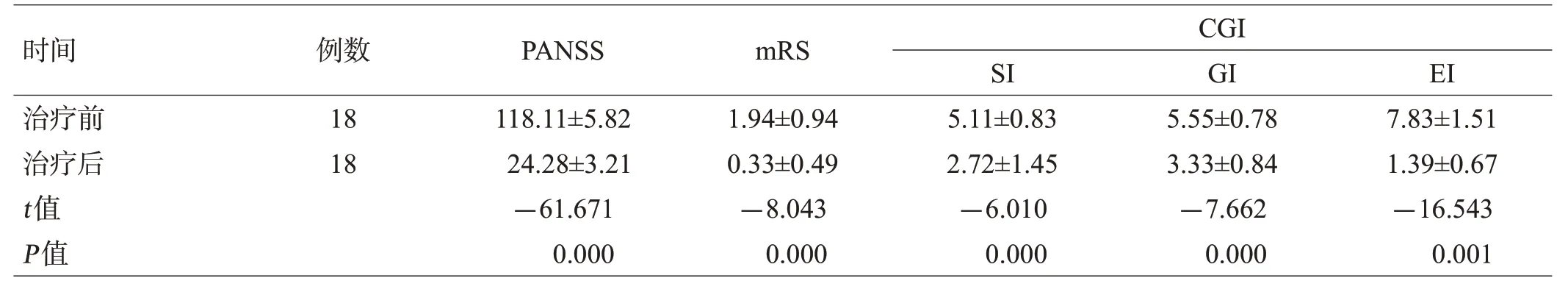
表1 治疗前后患者组各项评分比较(分,±s)
时间治疗前治疗后t值P值例数18 18 PANSS 118.11±5.82 24.28±3.21-61.671 0.000 mRS 1.94±0.94 0.33±0.49-8.043 0.000 CGI SI 5.11±0.83 2.72±1.45-6.010 0.000 GI 5.55±0.78 3.33±0.84-7.662 0.000 EI 7.83±1.51 1.39±0.67-16.543 0.001
2.2 代谢化合物主成分分析
对所有血清和尿液样本的总离子色谱图进行可视化检测后,提取所有峰信号强、重复性及稳定性好的数据进行降维处理,初步采用PCA方法对2组进行分析。经UPLC-MS/MS分析,对照组、患者组治疗前后血清中共检测到126个色谱峰,依据各色谱峰的分子离子峰及主要碎片峰的解析,通过数据库搜索、文献对照,获得了89个代谢化合物。结果表明,对照组与患者组用药前后能明显分开,表明其代谢轮廓都存在差异,且同一组别内部个体之间的差异不大,但主成分(principal component,PC)PC1(20%)、PC2(5.7%)的贡献率相加为25.7%,说明该模型不稳定,需进行其他有监督的判别分析统计方法,见图2A。同理分析,对照组、患者组治疗前后尿液中共检测到96个色谱峰,获得57个代谢化合物,代谢轮廓也能明显分开,但后续还需进一步判别,见图2B。
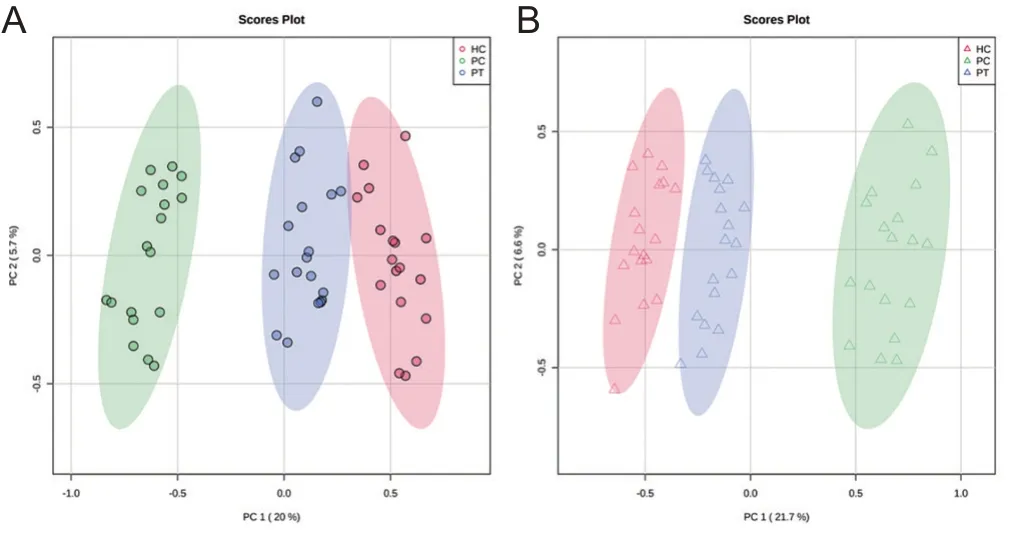
图2 对照组、患者组治疗前后PCA得分
2.3 血清代谢产物的变化
通过对对照组、患者治疗前后血清样本数据进行两两PLS-DA分析。对照组和治疗前沿第一主成分方向基本分离,表明2组血清代谢物存在明显差异(图3A)。根据VIP值(图3B),筛选VIP>1.5且差异有统计学意义(P<0.05)后确定11种差异代谢产物,分别是谷氨酰胺、牛磺酸、肌苷、γ-氨基丁酸、二十碳五烯酸、色氨酸、木糖、苯丙氨酸、肌酸、十八烯酸、丙酮酸作为抗NMDAR脑炎合并精神障碍患者的潜在生物标志物(表2),其中肌酸和木糖在患者体内浓度出现上升(FC<1),其他9种代谢产物在患者体内浓度下降(FC>1)。经过氯氮平的治疗,可以发现患者经过治疗后代谢基本轮廓发生了变化(图3C),筛选VIP>1.5(图3D)且经过统计分析,确定谷氨酰胺、牛磺酸、肌苷、木糖、甘氨酸、丝氨酸、γ-氨基丁酸这7种差异代谢物为患者治疗后的潜在生物标志物,其中谷氨酰胺、牛磺酸、肌酸、木糖、丝氨酸、γ-氨基丁酸都出现不同程度的回调(表2)。值得注意的是甘氨酸在对照组和患者之间也有变化,但由于VIP<1.5因此没有将它定义为潜在生物标志物,但在患者用药后检测到浓度变化明显,所以可将其归为治疗后的潜在生物标志物。

表2 对照组、患者组治疗前后血清中的差异代谢物
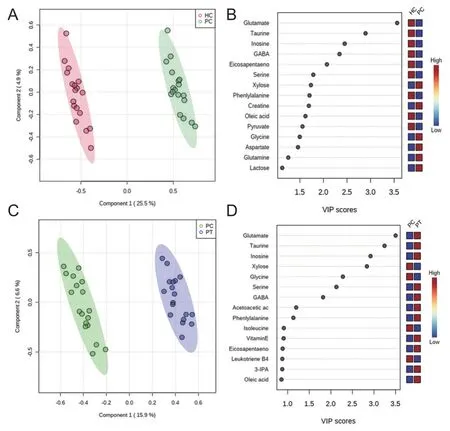
图3 对照组、患者组治疗前后血清样本的PLS-DA分析和VIP得分
2.4 尿液代谢产物的变化
对对照组、患者组治疗前后尿液样本进行两两PLS-DA分析显示,对照组和患者组治疗前沿第一主成分方向基本分离,表明2组尿液代谢物有明显差异(图4A)。根据VIP值>1.5(图4B)且差异有统计学意义(P<0.05)筛选后确定9种差异代谢产物,分别是谷氨酸、乙酰乙酸、牛磺酸、γ-氨基丁酸、甘氨酸、苯丙氨酸、谷氨酰胺、丙酮酸、尿酸作为抗NMDAR脑炎合并精神障碍患者即患者体内的潜在生物标志物(表3)。其中谷氨酸、甘氨酸、尿酸在患者体内出现上调(FC<1),另外6种化合物则出现浓度下降。氯氮平治疗后,患者代谢轮廓发生变化(图4C),同样结合VIP>1.5(图4D)且统计分析,确定谷氨酸、甘氨酸、牛磺酸、马尿酸、苯丙氨酸、苯甲酸这6种差异代谢物为患者治疗后的潜在生物标志物(表3),且谷氨酸、甘氨酸、牛磺酸、苯丙氨酸4种代谢物出现明显回调。
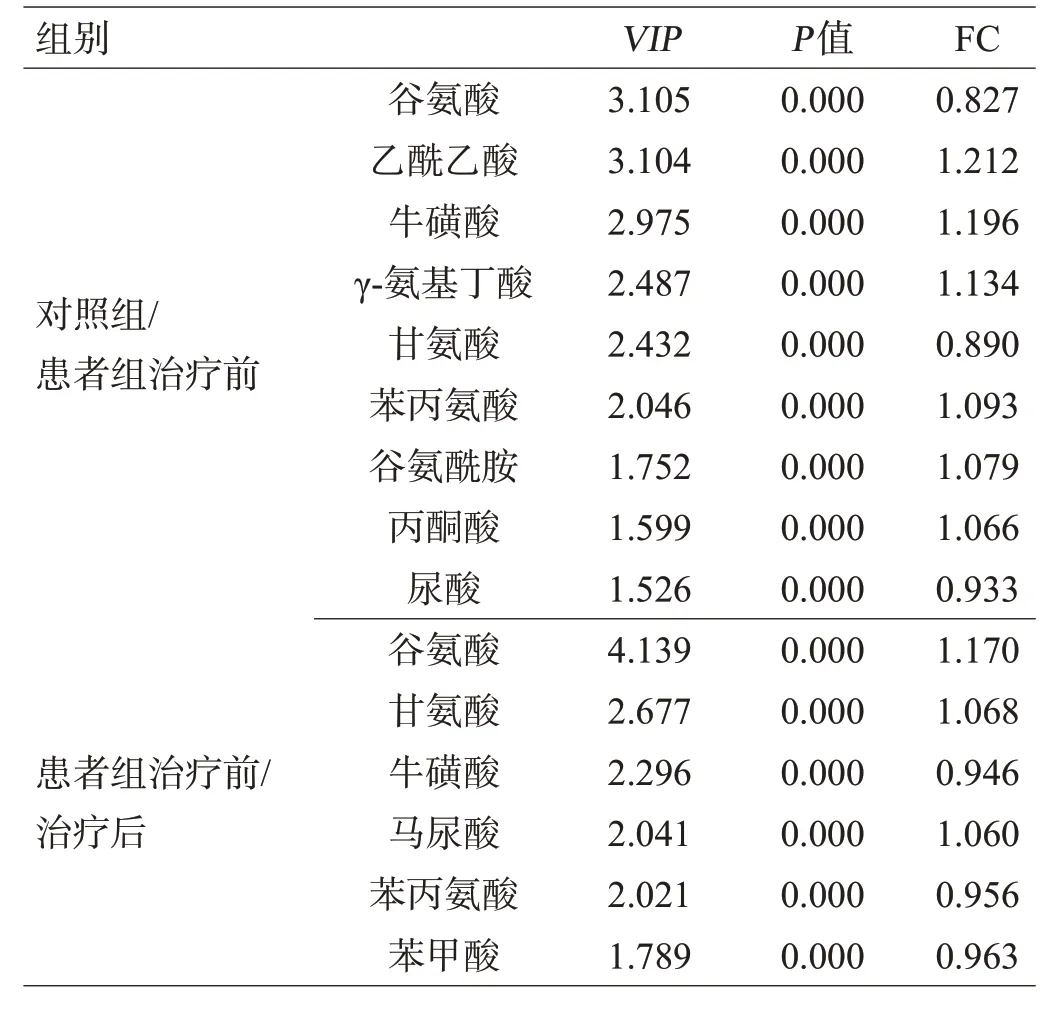
表3 对照组、患者组治疗前后尿液中的差异代谢物
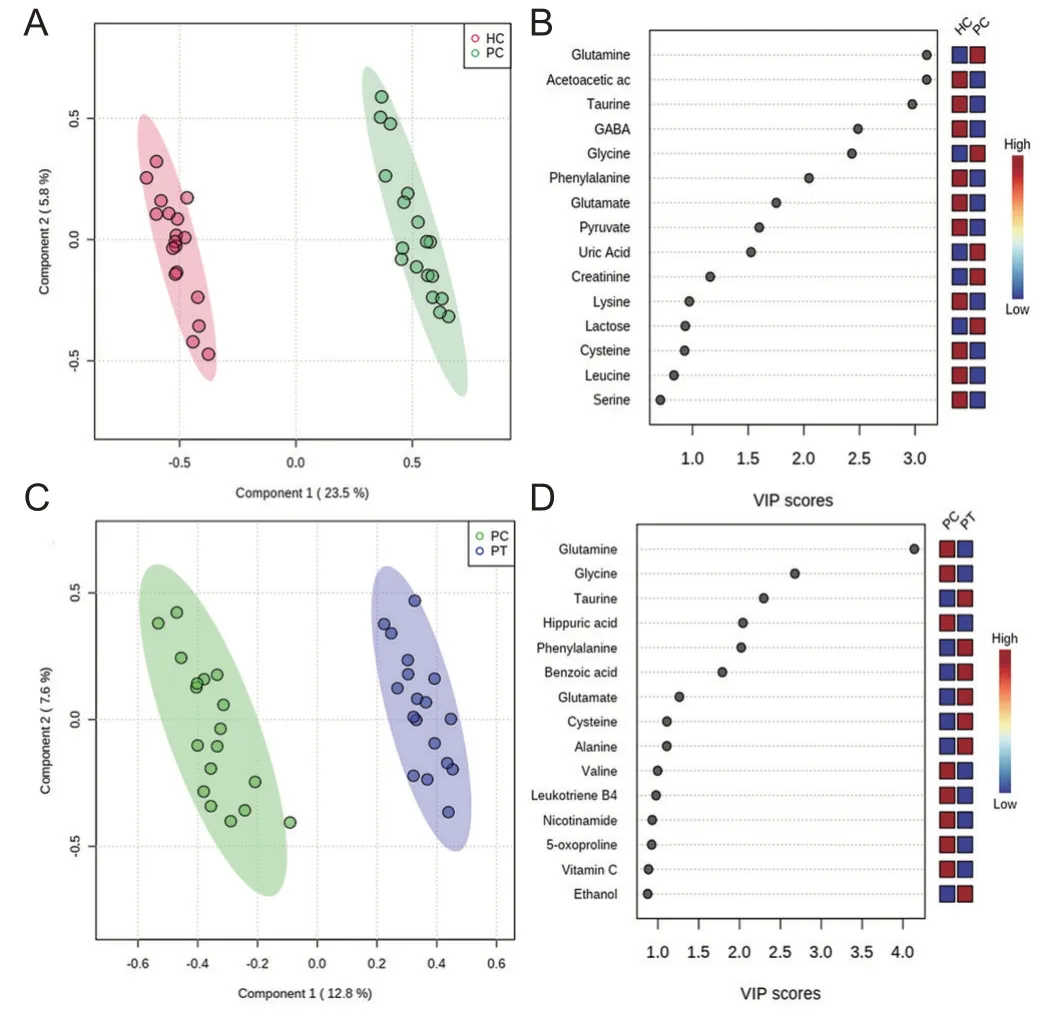
图4 对照组、患者组治疗前后尿液样本的PLS-DA分析和VIP得分
2.5 血清和尿液中生物标志物诊断能力评估
采用受试者工作特征(receiver operating characteristic,ROC)曲线和曲线下面积(area under curve,AUC)对治疗前后的患者组患者血清和尿液中检测到的潜在生物标志物进行评估。结果显示,血清中谷氨酰胺、牛磺酸、肌苷、γ-氨基丁酸、二十碳五烯酸、色氨酸对于病情有一定的诊断效能(图5A),尿液中的谷氨酸、乙酰乙酸、牛磺酸、γ-氨基丁酸、甘氨酸胺有一定的诊断效能(AUC>0.8)(图6A)。治疗后,患者血清中谷氨酰胺、牛磺酸、肌苷、木糖、甘氨酸、γ-氨基丁酸,经分析后具有评估药物效果的价值(图5B),尿液中谷氨酸、牛磺酸、马尿酸、苯丙氨酸这4种代谢产物也具有药效评估价值(图6B),其中甘氨酸在患者用药前后的血清和尿液都具有一定的评估药物效果的价值。
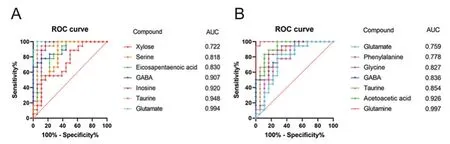
图5 患者组治疗前(A)后(B)血清中潜在生物标志物的ROC分析(AUC>0.7)
3 讨论
有报道称NMDAR功能减退是一种可能导致精神分裂症的机制[12],一些学者宣称NMDAR功能障碍是精神分裂症发病机制的“最终共同途径”[13],并与阳性和阴性症状有关。本研究显示患者组的PANSS评分显著高于对照组,说明自身免疫性脑炎合并精神障碍发病因素可能与精神分裂症类似,但具体的发病机制还有待进一步的研究证明。
本研究通过ROC曲线发现,谷氨酰胺、牛磺酸、γ-氨基丁酸都具有较准确的诊断能力,这3种物质主要作用于机体的氨基酸代谢。谷氨酰胺在谷氨酸-谷氨酰胺循环、神经胶质细胞葡萄糖利用和乳酸生成密切相关[14],同时也在神经递质传递过程中起重要作用,其含量的增高会影响神经系统的兴奋性[15]。与谷氨酰胺作用相反,γ-氨基丁酸是脑内重要的抑制性神经递质,对神经元的迁移、分化、增殖有一定的调节作用[16]。谷氨酰胺和γ-氨基丁酸的浓度异常会导致人体内谷氨酰胺-谷氨酸-γ-氨基丁酸循环受阻,引起细胞外谷氨酸积累和γ-氨基丁酸浓度降低,使脑内兴奋性与抑制性神经递质间传导失衡,兴奋性神经活动亢进,患者容易出现焦虑、失眠、记忆力减退、癫痫发作等症状[17],与抗NMDAR脑炎合并精神障碍患者的临床表现相似。因此推断,自身免疫性脑炎合并精神障碍发病因素最大程度上可能与谷氨酸代谢有关。牛磺酸又称β-氨基乙磺酸,是人体的一种必须氨基酸,主要由半胱氨酸、甲硫氨酸等含硫氨基酸在肝脏合成。在中枢神经系统中,牛磺酸作为神经递质,可参与神经细胞的功能活动,维持中枢神经系统内环境的相对稳态,具有神经保护作用[18]。研究表明,牛磺酸可以增强大鼠的学习和记忆能力[19],自身免疫性脑炎患者脑脊液中牛磺酸的降低会严重影响机体的记忆及认知功能[20],并对神经元的代谢产生影响。本文发现患者的血清和尿液中牛磺酸浓度都处在一个较低的水平,说明患者的神经元或者神经细胞可能受到损伤,因此出现一些认知缺陷。这些标志物的价值在于能辅助提高常规的临床和影像学的预测能力,可以更准确地预测疾病发生。
氯氮平是典型抗精神病药物,容易引起心肌炎、心肌病、粒细胞缺乏症和惊厥[21]等副作用,故较少使用在器质性精神障碍患者中,必须在三种抗精神病药物对抗NMDAR脑炎无效的基础上才建议使用[9]。同时,有部分自身免疫性脑炎合并精神症状的患者,在躯体症状控制后,精神症状难以消失,笔者发现使用氯氮平治疗这部分患者后,精神症状能明显控制,故本院通过严格病例筛选进行此项研究。氯氮平可能通过诱导的L-谷氨酸和D-丝氨酸星形胶质释放,参与NMDAR的功能,是抗NMDAR的主要激动剂之一[22]。本文首先通过PANSS、CGI量表的评定,肯定了氯氮平在抗NMDAR脑炎合并精神障碍患者治疗过程中发挥的积极作用。综合血清和尿液的代谢组学数据分析得出甘氨酸和牛磺酸在评估药物效果方面具有一定的准确性。甘氨酸是一种生糖氨基酸,可调节血糖浓度为机体提供能量[23],它在中枢神经系统中既可扮演兴奋性神经递质的角色,又可扮演抑制性神经递质的角色[24]。患者尿液中检测到甘氨酸浓度升高,说明甘氨酸水平的增高阻碍了能量代谢,影响了神经元机能,从而发病。氯氮平治疗后,患者血清和尿液中甘氨酸明显下降,提示能量代谢和神经元机能可能逐渐趋于正常。由于氯氮平用药的过程中,会给患者带来很多副作用,还可能诱发癫痫[9],需定期监测脑电图,因此很多医生不愿意选择该药物[25]。代谢物是机体疾病和药物治疗的最直观反应,它的变化揭示了机体整体的代谢状态[26],所以在患者体内找到生物标志物可用于监测氯氮平作用于患者的代谢途径和疗效,对于临床用药具有指导意义。
本文发现氯氮平治疗的确对抗NMDAR脑炎合并精神障碍患者产生了积极的影响。比较了健康人群与抗NMDAR脑炎合并精神障碍患者在用药前后,血清和尿液中代谢产物的变化情况,在对照和患者的血清和尿液中分别寻找到11种和9种差异代谢物,其中谷氨酰胺、牛磺酸、γ-氨基丁酸是共有的差异代谢物且具有较准确的诊断能力。患者用药前后的血清和尿液中分别得到7种和6种差异代谢物,其中甘氨酸和牛磺酸是共有的差异代谢物且与氯氮平药效有着较高的相关性。本研究属于小样本量的探索性研究,后续需扩大样本量,深入探讨抗NMDAR脑炎合并精神障碍患者与所服用药物的相关性及所用药物与各代谢物的相关性,以更好地为临床诊疗提供依据。
