赖氨酰氧化酶家族在肝细胞癌发生发展中的作用
覃小宾,李祖隆,曾胜澜,谭利婷,乐滢玉,毛德文
1 广西中医药大学 研究生院,南宁 530021; 2 广西中医药大学第一附属医院 肝病科,南宁 530023
肝细胞癌(HCC)是最常见的肝脏恶性肿瘤,2018年全球HCC新发70余万例,位居恶性肿瘤发病谱第6位,是全球第二常见的与癌症相关的死亡原因[1]。由于HCC发现时通常已为晚期,加之目前治疗手段有限,复发率极高,给我国造成了极大的经济负担。因此,HCC的早期监测识别及复发转移的防治仍是我国医学攻坚的重点。
肿瘤的发生和发展取决于肿瘤微环境,细胞外基质(extracellular matrix,ECM)作为肿瘤微环境的主要部分,与肿瘤细胞共同调控肿瘤微环境的异常表达,以及分泌多种生长因子、细胞因子和趋化因子,最终促进肿瘤的进展[2]。赖氨酰氧化酶(lysyl oxidase,LOX)是维持ECM稳态中的关键角色,通过催化胶原蛋白和弹性蛋白的共价交联以维持ECM的硬度和结构稳定性[3],在肿瘤中参与细胞信号和转录调节、肿瘤抑制和转移促进、上皮-间充质转化(epithelial-mesenchymal transition,EMT)和免疫调节等多种生物学过程,在HCC中表达增加并与预后不良相关[4]。本文对LOX家族成员在HCC中的作用进行综述,阐述其作为治疗靶点的可能机制及中药干预作用,以期为HCC的靶向药物研发提供参考。
1 LOX家族成员的结构
在哺乳动物中,LOX家族是由LOX和LOX样蛋白(LOXL1、LOXL2、LOXL3和LOXL4)组成的铜依赖性胺氧化酶,其成员均具有保守的铜结合位点、细胞因子受体样结构域和赖氨酸酪醌辅因子组成的高度保守的羧基末端(C端)结构域,因此显示出相似的胺氧化酶活性[5]。然而,LOX家族成员氨基末端(N端)结构域是可变的,几乎无序列同源性。LOX和LOXL1在N端均含有1个前肽序列,LOXL2~4则在该区域存在4个清道夫受体半胱氨酸富集区(图1)[5]。LOX及LOXL1的N端信号肽裂解产生的前原蛋白在内质网和高尔基体中发生N-连接的糖基化反应,然后通过分泌小泡的形式分泌至细胞外,被骨形态发生蛋白1或前胶原C金属蛋白酶水解后产生活性酶和前肽(LOX-PP),再重新进入细胞内以发挥其生物学活性[6]。尽管LOX-PP在催化LOX、LOXL1酶活性过程中具有重要作用,导致多种功能形式,但其对LOXL2~4的功能却毫无影响,这可能是LOX家族成员功能具有相关性但不完全相同的原因[7]。
2 LOX家族在HCC中的促进作用
LOX作为预后不良的一种预测因子在HCC中过表达,其促进HCC进展可能是通过促血管生成、重塑肿瘤微环境和诱导EMT等完成的[13]。
2.1 促进血管生成
缺氧是实体瘤的特征,异常血管生成不仅改善了肿瘤的缺氧,并且促进了癌症的进展。研究[14]表明血管生成因子(vascular endothelial growth factor,VEGF)及其相关受体是肿瘤血管生成的主要正向调节剂,与不良预后密切相关。
2.1.1 LOX与血管生成 LOX通过p38MAPK信号影响TGFβ介导的VEGF在HCC细胞中表达上调,LOX基因敲除则抑制了HCC细胞的增殖、迁移和侵袭,并降低了VEGF表达[13]。LOX的表达水平在HCC中与肝脏基质硬度呈正相关,过表达的LOX上调了整合素β1的表达,并激活PI3K/Akt的磷酸化,增加了VEGF表达;同时激活整合素αV/β5/Akt-核Sp1通路,上调血管内皮细胞中血管生成因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)的表达,使VEGF与VEGFR2结合增加诱导血管生成,促进HCC的进展[15-16]。
2.1.2 LOXL1与血管生成 LOXL1在肝内胆管癌内表达升高,其通过与精氨酸-甘氨酸-天冬氨酸域依赖性机制中的αvβ3整联蛋白结合,与调节血管生成的纤维蛋白5相互作用,增强黏着斑激酶(focal adhesion kinase,FAK)血管内皮细胞内MAPK信号通路,促进细胞增殖、集落形成和转移,并诱导血管生成,LOXL1的敲除则显示相反的效果[17]。
2.1.3 LOXL2与血管生成 LOXL2在HCC中过表达,诱导Snail信号-果糖-1,6-二磷酸酶通路上调缺氧诱导因子1(hypoxia-inducible factor-1,HIF-1)的亚基HIF-1α活性增加,导致HIF-1α的靶基因VEGF表达增强,促进血管生成导致HCC转移[18]。此外,LOXL2还可诱导内皮细胞沉积Ⅳ型胶原,并通过N端的重组清道夫受体富半胱氨酸结构域,使Ⅳ型胶原和纤连蛋白的相互作用独立于酶的交联活性,协调血管基底膜的支架,促进血管生成[19]。
2.1.4 LOXL4与血管生成 研究[20]表明,LOXL4在HCC中亦过表达,作为独立危险因素与预后不良显著相关,其在细胞外通过HCC来源的外泌体介导转移到亲代HCC细胞和内皮细胞上,从而增强HCC细胞的侵袭,促进血管生成,最终促进HCC转移。
靶向LOX家族成员在抗HCC血管生成方面取得了重要进展,然而LOXL3对血管生成的影响尚不清楚,且目前的研究大多集中于单独抑制VEGF途径上,存在一定的局限性。新一代多靶点抗血管生成剂有待进一步的深入研究,最大限度发挥抗血管生成疗法的潜力。
2.2 促进EMT
EMT导致上皮细胞失去其典型的极化状态,细胞黏附和迁移能力增加,细胞凋亡受到抑制[21]。因此,调控EMT被认为是治疗癌症的新策略。
2.2.1 LOX与EMT 缺氧诱导HIF稳定和下游信号传导,是EMT的重要驱动力[22]。HIF-1α诱导LOX在HCC内高表达,导致较高的复发率及较差的预后,其原因可能为LOX在HIF-1α介导下通过降低E-钙黏蛋白,增加波形蛋白、Slug蛋白以及TWIST蛋白的表达诱导EMT,导致早期肝内转移[23]。
2.2.2 LOXL2与EMT 与LOX作用相似,LOXL2也可通过降低E-钙黏蛋白表达来促进EMT,不同的是,LOXL2以Snail蛋白依赖的方式诱导EMT[24]。此外,部分LOXL2可以移入细胞核与E-钙黏蛋白启动子的E-pal元件特异性结合,同时激活FAK/Src信号,独立于其酶促活性而驱动EMT[25]。Wang等[24]研究报道了LOXL2表达较高的HCC患者总生存期较短,而Fan等[18]研究则认为LOXL2与HCC两年内的早期复发显著相关,但与HCC总生存期无关。二者存在争议,仍需进一步研究明确。
LOXL1、LOXL3及LOXL4被发现在肿瘤中过表达,且LOXL1、LOXL3均能通过与Snail蛋白相互作用抑制E-钙黏蛋白基因表达,诱导EMT以促进肿瘤增殖和转移[26-27]。目前尚未有报道称LOXL1、LOXL3在HCC中具有诱导EMT的作用,而LOXL4在肿瘤中是否能够诱导EMT仍需进一步探究。
2.3 重塑肿瘤微环境
肿瘤微环境的改变不仅表现为基质硬度上的改变,更是导致了免疫状态的改变,为肿瘤进展创造了有利条件。肿瘤微环境的调控不仅是目前的治疗方式,也是未来的探索领域。
2.3.1 LOX与肿瘤微环境 ECM重塑在肿瘤微环境中是调控肿瘤瘤体硬度的关键机制,而Ⅳ型胶原蛋白的交联则是ECM重塑中的重要过程。完整的Ⅳ型胶原蛋白网络增强了ECM的硬度,为组织提供抗张强度,促进肿瘤生长并保护癌细胞免受化学疗法诱导的凋亡[28]。Fang等[29]通过免疫组化及基于量子点的多重成像研究HCC患者肝组织,发现LOX的表达升高并诱导了肿瘤基质和癌巢周围边界中Ⅳ型胶原的线性重新排列,使ECM重塑并导致机械应力增加以驱动癌症侵袭。
2.3.2 LOXL2与肿瘤微环境 LOXL2通过整联蛋白介导的FAK使肿瘤微环境中的基质成纤维细胞活化,增加胶原收缩及平滑肌肌动蛋白的表达,导致组织硬度增加,活化Rho激酶并增强平滑肌肌动蛋白α收缩,调节细胞骨架重组,促进肝内转移,同时增强募集骨髓来源的细胞归巢到转移部位以促进肝外转移[30-31]。重要的是,随着成纤维细胞活化增加,LOXL2表达亦增强,反之LOXL2表达的增强又促进成纤维细胞活化增加,由此形成一种正向循环进一步促进肿瘤的侵袭和转移。此外,组织硬度的增加显著增强了肿瘤微环境中M2巨噬细胞的极化,导致肿瘤微环境的免疫抑制[32]。因此,靶向肿瘤衍生的LOXL2可能是防止癌症进展的新手段。
2.3.3 LOXL4与肿瘤微环境 LOXL4在肝内招募浸润的巨噬细胞,通过依赖于IFN介导的STATS激活程序性死亡配体(PD-L1)的表达,从而转化为免疫抑制表型,削弱细胞毒性T淋巴细胞介导的免疫监视,导致免疫抑制微环境,促进HCC的发生发展[33]。除了在HCC细胞之间转移,LOXL4还可在细胞内受TGFβ的诱导上调自身的表达,激活FAK/Src通路,促进HCC细胞与ECM中胶原蛋白的黏附,增强ECM硬度,导致HCC的迁移、侵袭和转移[20]。Busnadiego等[34]研究则认为LOXL4可能在内皮下基底膜的胶原蛋白Ⅳ组装中发挥作用从而促进细胞-基质黏附,其机制可能是通过Smad依赖和JunB/Fra2途径表达增加并参与血管基质重塑。
尽管LOX与LOXL1~4之间在功能上存在一定的相似性,但目前关于LOXL1、LOXL3在HCC微环境中的具体调节机制未见论述。基于LOX家族在HCC发生发展中的重要作用,引发了研究者对研发靶向LOX家族成员治疗HCC的新药的极大兴趣,但由于LOX家族在HCC中的作用较复杂,仍需进行大量的、更深入的研究以明确LOX家族在HCC中的具体效应机制,以指导临床药物研发。LOX家族成员在HCC中的促进作用总结详见表1。

表1 LOX家族成员在HCC中的促进作用
3 LOX在HCC中的抑制作用
在以往的报道[35]中,LOX被认为是Ras癌基因的表型抑制因子,而后研究者[36-38]也在结肠癌、胃癌和前列腺癌细胞系中观察到LOX表达降低,发现其启动子甲基化和杂合性丧失而失活可能与肿瘤发病机制相关,提示LOX是一种肿瘤抑制基因。但LOX、LOXL1~3在HCC中是否具有抑癌作用尚未可知,仍需进一步的研究明确其在HCC中的效应机制。
3.1 LOX-PP在HCC中的抑制作用 LOX-PP已被证明在多种癌症中具有抑制肿瘤发生的作用,其在HCC中低表达,是不良预后和晚期肿瘤的预测指标。LOX-PP过表达可下调基质金属蛋白酶(matrix metalloproteinase,MMP)9和MMP-2表达,阻断MAPK/ERK通路抑制癌细胞的侵袭和转移[39]。Nareshkumar等[40]首次报道了LOX-PP在VEGF刺激下和未转化的人脐静脉内皮细胞中的过表达均使细胞增殖阻滞在DNA合成期,降低F-肌动蛋白水平,减少FAK的磷酸化,抑制下游NF-κB信号的激活,抑制细胞增殖、迁移、黏附和管状形成,阻碍血管生成过程。因此,利用LOX-PP抗血管生成的作用可能为HCC治疗提供新的思路。
3.2 LOXL4抑制HCC LOXL4在包括HCC在内的多种癌症中过表达并促进肿瘤增殖和侵袭,但在膀胱癌和乳腺癌中可能起到肿瘤抑制因子的作用[41-42],因此,LOXL4在肿瘤中的作用仍有待进一步探究。在具有野生型p53的HCC中,p53的转录活性受到抑制,其转录活性的重新激活是治疗癌症的潜在策略[43]。研究[44]发现,LOXL4在5-氮杂胞苷处理的HCC细胞系中表达上调,通过其低等电点区域与p53的碱性结构域结合,诱导受损的p53重新激活,导致肿瘤细胞死亡,且LOXL4的表达与HCC患者总生存期呈正相关。因此,LOXL4被认为在癌症发生、进展和转移过程中具有促进或抑制的双重作用。在肿瘤发生过程中,LOXL4通过LOXL4-p53轴抑制肿瘤的生长,而在肿瘤进展过程中,p53可能会失去其功能,LOXL4的上调则会促进ECM重塑以促进肿瘤转移。
4 中药提取物通过调节LOX家族对HCC的干预作用
近年来,中医药在防治肿瘤方面取得了重大进展,中药通过抑制细胞增殖和转移、抗血管生成、调节免疫、诱导细胞凋亡和自噬等发挥抗肿瘤作用,具有多通路、多靶点、低毒副作用、费用低的优势,有效地减轻患者临床症状和延长生存期。现代药理学研究表明,部分中药提取物对LOX家族具有调节作用,从而起到抗HCC的作用。因此,对具有调节LOX作用的中药进一步探索有望为治疗HCC提供新的思路。
4.1 黄芩素 黄芩素是来自黄芩根的类黄酮化合物,具有抗氧化、抗细菌、抗病毒、抗炎和抗癌多种作用,广泛运用于各种肝炎及HCC、乳腺癌、胃癌及大肠癌等癌症治疗中[45]。研究[46]表明,黄芩素通过下调在肿瘤中高度表达的血管生成诱导剂61及糖原合成激酶3β,介导Snail和Slug蛋白的泛素化,使依赖于Snail发挥作用的LOXL2表达受到抑制,增加E-钙黏蛋白表达,导致EMT受到抑制,最终发挥抑制肿瘤转移的作用(图2),但具体机制仍有待进一步的深入研究。
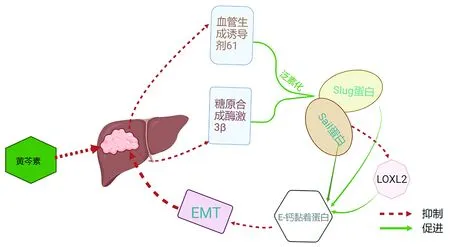
图2 黄芩素干预HCC的作用示意图
4.2 白藜芦醇 白藜芦醇是从虎杖、红葡萄等植物中提取的多酚化合物,具有抗氧化、抑制肿瘤细胞增殖和转移、抑制血管生成、诱导细胞凋亡等作用,可通过调节AMPK/SIRT1促进蛋白酶体的降解,抑制HIF-1α累积,下调LOX表达,有效抑制HIF-1α诱导的肝纤维化和炎症[47]。此外,白藜芦醇还可抑制CCl4诱导的肝纤维化小鼠中LOXL2的表达,减少ECM胶原沉积,与β-氨基丙腈联用可增强白藜芦醇的抗肝纤维化作用(图3)[48]。白藜芦醇在HCC中可能是通过对胶原沉积的调控来重塑ECM,改善肿瘤微环境从而起到抗HCC转移的作用,是潜在的治疗靶点。
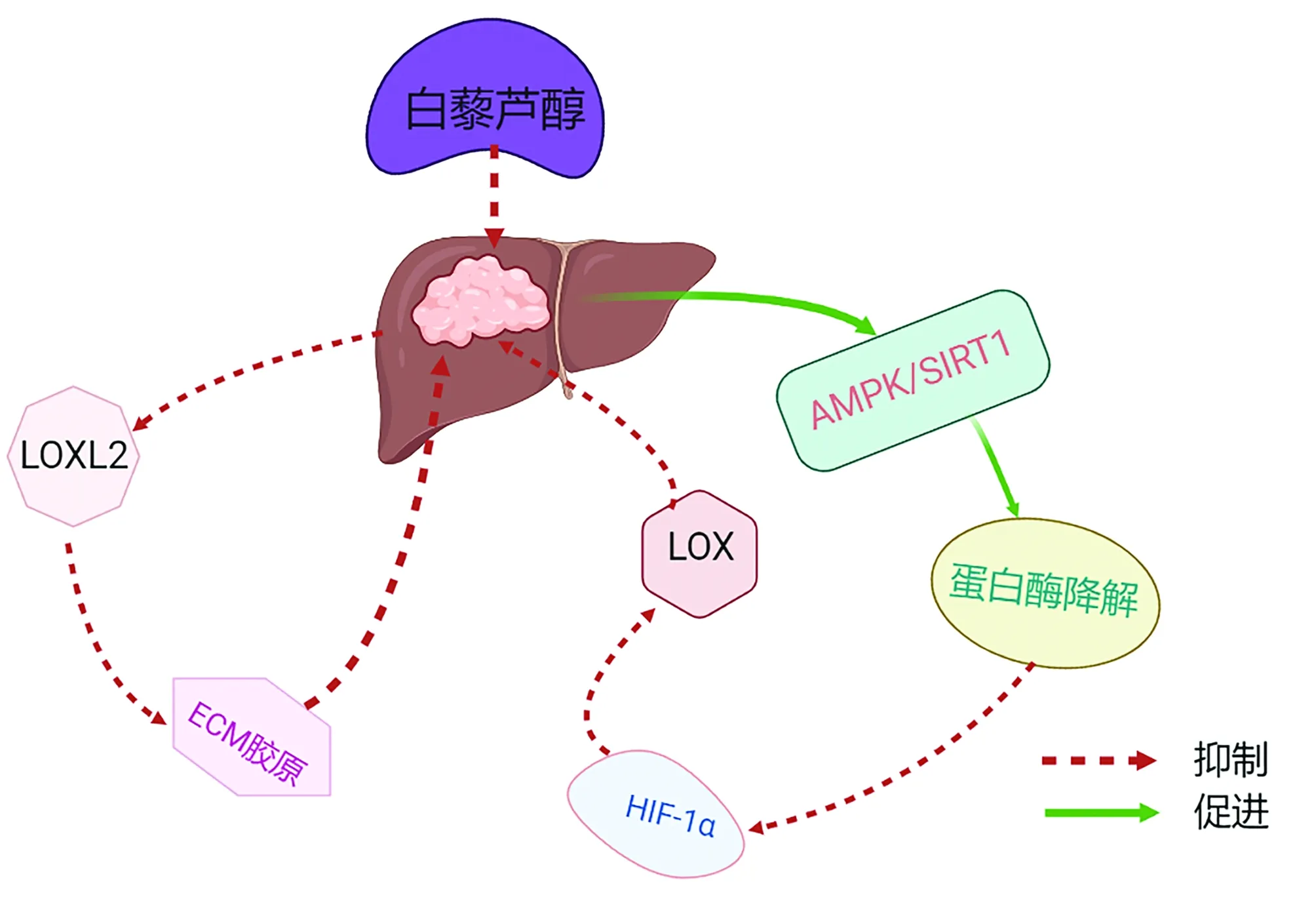
图3 白藜芦醇干预HCC的作用示意图
4.3 红景天苷 红景天苷是从中药红景天中分离出来的一种苯丙苷类化合物,具有抗氧化和抗缺氧特性,在多种恶性肿瘤中表现出显著的抗肿瘤活性。红景天苷在HCC中可呈剂量依赖性显著下调Notch1、Snail、COX-2、MMP-2、MMP-9基因表达,上调E-钙黏蛋白表达,从而抑制HCC细胞的侵袭和迁移(图4)[49]。体内外实验[50]显示,红景天苷与奥沙利铂共同给药显著抑制了HIF-1α信号通路,进而增加HCC细胞对铂类药物的敏感性,抑制缺氧诱导的EMT,提高了HCC患者的化疗疗效。鉴于此,笔者推测红景天苷对HCC的调控作用可能通过HIF-1α/LOXL2途径所实现,但仍需要进行更深入的研究。
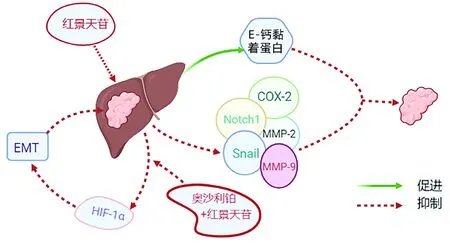
图4 红景天苷干预HCC的作用示意图
4.4 肉苁蓉苯乙醇苷 中药肉苁蓉不仅具有补肾阳、益精血功效,从现代药理学角度而言,其还具有抗肿瘤、调节免疫等多种特性,被广泛应用于免疫调节。肉苁蓉苯乙醇苷是肉苁蓉主要活性成分之一,有报道[51]称肉苁蓉苯乙醇苷可降低荷瘤小鼠血清中AFP水平,具有良好的抑瘤作用。近年来,肉苁蓉成为研发抗HCC药物的新思路。Wen等[52]研究发现,肉苁蓉苯乙醇苷联合奥沙利铂干预HepG2 HCC细胞模型可显著下调HIF-1α、LOXL2和TWIST蛋白表达水平,上调E-钙黏蛋白,改善HCC细胞的缺氧肿瘤微环境,同时提高HCC对化疗的敏感性(图5),与红景天苷的作用相类似。
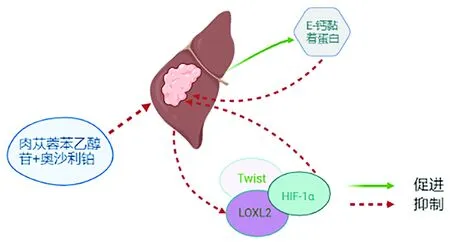
图5 肉苁蓉苯乙醇苷干预HCC的作用示意图
5 小结与展望
LOX家族成员氧化酶触发的血管增生反应和积极的ECM重塑,通过介导髓样细胞募集和建立转移前利基,重塑肿瘤微环境进一步加快肿瘤发生和转移,表明了其作为治疗干预靶点的潜力,特别是在预防转移方面,靶向该家族以防止肿瘤进展和转移是一种有前景的治疗策略。中药在防治HCC中具有一定的优势,部分中药提取物能够调节LOX家族,从而抑制肿瘤进展,成为HCC治疗的潜力药物。但目前关于中药调控LOX家族的具体作用机制尚不明确,大部分研究仅针对某一关键蛋白表达水平即作出结论,较少对系统的多通路多靶点多蛋白进行研究。
此外,LOX家族不同成员对不同类型的胶原蛋白具有不同的底物特异性,且与其他蛋白质形成相互作用网络,通过多个域协调不同的生物功能在癌症中被重新连接,影响多种信号通路和细胞功能。因此,目前更重要的是建立网络生物学研究来识别靶向LOX家族成员有效的生物标志物,深入了解LOX家族成员底物结合以及细胞反应所涉及的分子机制,确定何种干预以及何时进行干预能获得更好的疗效。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:毛德文、乐滢玉负责研究选题;曾胜澜、谭利婷参与收集数据,设计论文框架;覃小宾、李祖隆负责修订论文;毛德文、覃小宾负责拟定写作思路,指导撰写文章并最后定稿。

