多囊卵巢综合征合并非酒精性脂肪性肝病的机制与治疗
秦婷婷,张瑞华,张 雨,魏晓东,温晓玉
1 吉林大学第一医院 a.肝胆胰内科,b.小儿内分泌遗传代谢科,长春 130021; 2 吉林大学 基础医学院,长春 130000
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种复杂的内分泌和代谢性疾病,在我国育龄妇女中患病率为5.61%[1],胰岛素抵抗(insulin resistance,IR)与高雄激素血症(hyperandrogenism,HA)是该病的主要临床特征[2]。其临床表现具有高度异质性,包括月经不规律、多毛、痤疮、雄激素性脱发等,同时可伴有肥胖、血脂异常、血糖失调等代谢紊乱表现。非酒精性脂肪性肝病(nonalcoholic fatty liver diseases,NAFLD)在全球成人中患病率为6.3%~45%,是目前健康体检肝生物化学指标异常的首要原因,已成为我国乃至全球第一大慢性肝脏疾病[3]。2020年,国际肝病专家组就NAFLD的更名以及代谢相关脂肪性肝病的诊断标准达成共识,直接肯定NAFLD是代谢功能障碍相关的肝脏疾病[4]。世界不同地区及国家PCOS患者中NAFLD的发病率为34%~70%,而普通人群中女性NAFLD发病率仅为14%~34%[5]。国内各地区关于NAFLD在PCOS人群中的流行病学调查也不一致,在山东地区PCOS患者合并NAFLD的发生率约为32.9%,明显高于正常人群的18.5%;在上海地区为56.23%,显著高于正常人群的38%[6]。
不仅如此,IR和HA导致年轻PCOS女性的脂肪变性和纤维化风险增加,一项关于202例PCOS非糖尿病患者和101例年龄匹配的对照研究[7]显示,PCOS 患者的脂肪变性与腰围、胰岛素敏感性指数降低独立相关,FIB-4与非肥胖患者雄激素指数升高和肥胖患者胰岛素敏感性指数降低独立相关。Sarkar等[8]在对106例行肝活检的NAFLD患者的回顾性研究发现,患有PCOS的女性具有较高的极低密度脂蛋白(VLDL)和BMI。76%患有PCOS的女性和66%未患有PCOS的女性存在非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH),经年龄和BMI校正后,PCOS仍与严重肝细胞气球样变(OR=3.4,95%CI:1.1~10.6,P=0.03)和晚期纤维化(OR=7.1,95%CI:1.3~39,P=0.02)相关。在晚期纤维化的妇女中,与没有PCOS的妇女相比,有纤维化的妇女中位年龄年轻5岁(40岁 vs 45岁,P=0.02)。鉴于对PCOS人群中NAFLD的流行病学及发病机制的不断深入了解,本文就PCOS合并NAFLD的发病机制及相关治疗进行综述,以期提高临床医生对代谢性疾病的防治认识,为患者做出更好的诊疗指导。
1 PCOS合并NAFLD的发病机制
1.1 IR PCOS合并NAFLD发病机制尚不明确,目前认为IR可能是其发病重要机制。首先,IR在NAFLD的二次打击理论中发挥始动作用。有荟萃分析[9]显示,根据转氨酶的水平或超声检查诊断的NAFLD其发生代谢综合征的风险会增加约2倍。另一项荟萃分析[10]表明,NAFLD 的全球患病率为25.24%,与其相关的代谢综合征包括肥胖(51.34%),2型糖尿病(22.51%),血脂异常(69.16%),高血压(39.34%)和代谢综合征(42.54%)。由于NAFLD患者能量摄入和消耗不平衡导致脂肪堆积超过脂肪组织重塑的能力,促炎症因子、内质网应激和活性氧类可导致肝细胞JNK通路过度激活出现肝脏IR,其中部分原因是胰岛素信号分子 IRS1和 IRS2的丝氨酸磷酸化受到抑制[11]。其次,约有50%~80%的PCOS患者可观察到IR[12],这可能是由于部分患者的骨骼肌和脂肪组织出现胰岛素信号转导通路缺陷,而其他组织(如卵巢)的胰岛素敏感增强,胰岛素作为 “生殖激素”的作用被放大促使雄激素水平进一步升高[13]。高胰岛素血症会降低性激素结合球蛋白(sex hormone-binding globulin,SHBG)的肝脏产量,而性激素结合球蛋白是睾丸激素的主要结合蛋白,并会延长其代谢清除率,增加游离睾酮水平[14]。高雄激素反馈性促进高炎症水平以及PCOS患者代谢综合征发生,形成内分泌代谢的恶性循环。
IR在PCOS合并NAFLD发病过程中发挥着核心作用,如图1所示。
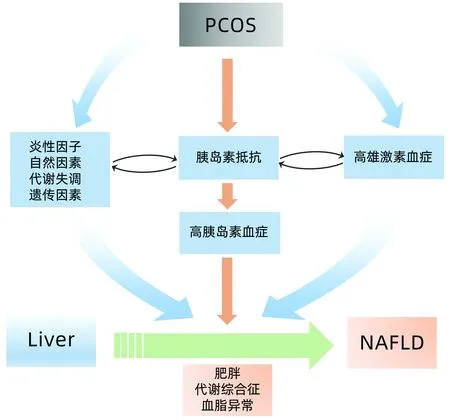
注:PCOS导致的HA增强两者相同的发病机制IR,从而导致NAFLD的发展。
PCOS脂肪组织中的IR可导致脂肪分解加速,游离脂肪酸向肝内运输增加导致肝细胞内脂肪堆积,这可能与胰岛素介导的IRS-PI3K-Akt信号通路的失调有关[11]。有关IR的体外研究[15]观察到SHBG和SHBG mRNA水平降低,同时IRS-1、IRS-2、PI3Kp85a、GLUT-3和GLUT-4的mRNA和蛋白水平也降低,表明SHBG可能作为一种激素或信号转导因子,参与局部和全身IR的PI3K/AKT途径。肝细胞核因子(hepatocyte nuclear factor 4 alpha,HNF-4α)是SHGB启动子重要的转录子,其与肝脂肪生成呈反比。当胰岛素水平升高时,将抑制HNF-4α表达,导致肝SHGB合成减少[14]。脂联素作为唯一被肥胖下调的脂肪因子,可通过减低肝脂质上调HNF-4α的表达来增加SHGB水平[16]。TNFα、IL-1β和肝脏的过氧化物酶体增殖物激活受体γ均可抑制HNF-4α降低肝SHGB mRNA水平[17]。因此,在PCOS合并NAFLD中出现的IR可能通过作用于HNF-4α介导相关通路来降低SHBG的肝生成,从而增加游离雄激素水平并加重IR[17]。
1.2 高雄激素血症 PCOS的具体发病机制尚不明确,其典型特征是功能性卵巢雄激素过多症,有超过50%的PCOS患者发生肥胖和/或IR相关的代谢综合征,伴随的代偿性高胰岛素血症具有组织选择性作用,将加重HA[18-19]。因此,HA或者IR与雄激素的相互作用也可能是PCOS患者合并NAFLD的发病机制(图1)。近年来研究显示,PCOS人群NAFLD高发病率与雄激素水平相关[20],甚至发现高雄激素型PCOS妇女NASH数量更多并且出现严重的肝细胞膨胀及肝纤维化[21]。
有研究[22-23]发现,内源性睾酮水平升高会降低腺苷单磷酸激活激酶(AMPK)磷酸化活性而显著损害AMPKα信号传导,使肝甘油三酯水平升高出现脂肪肝表现。HA会影响线粒体功能,抑制有氧呼吸过程,促进细胞凋亡和自噬相关的分子异常表达,如抑制电子转移复合体Ⅱ、丙酮酸脱氢酶和琥珀酸脱氢酶复合体a亚单位等,增加Bak mRNA,caspase-3/caspase-3比值以及Atg12蛋白表达,导致脂质沉积和肝脏炎症[24]。针对HA诱导NAFLD的分子机制,Seidu等[25]提出二氢睾酮诱导SCAP内含子8中的雄激素应答元件,SCAP-SREBP1相互作用升高,导致核 SREBP1增加,从而导致新生脂肪生成增加导致 NAFLD。
此外,一些研究[26-27]发现PCOS患者脂肪分布异常易合并肥胖,甚至即使是非肥胖PCOS患者也可出现内脏脂肪增多(包括肝脂肪),临床研究推测这可能与HA有关。虽然关于雄激素影响女性脂肪细胞的机制研究较少,但研究者们发现睾丸激素诱导人内脏脂肪细胞增殖和细胞周期基因过度表达,同时过度激活CMKLR1信号传导会导致脂质液滴积累,HA还可能引起儿茶酚胺刺激脂肪分解减少,加速异位脂肪积聚,导致内脏肥胖[28]。
2 PCOS合并NAFLD的治疗进展
迄今尚无有效的NAFLD治疗方法,因多数患者肝组织学改变处于单纯性脂肪肝阶段,治疗NAFLD的首要目标为减肥和改善IR,预防和治疗代谢综合征、2型糖尿病及其相关并发症,从而减轻疾病负担、改善患者生活质量并延长寿命[3]。PCOS是伴随女性一生的疾病,其近期治疗目标为调节月经周期、纠正内分泌代谢异常,远期目标为预防不孕、妊娠期并发症、代谢性疾病和老年癌症的风险等。因此,积极改善IR和控制高雄激素血症并调整月经周期对于PCOS合并NAFLD的患者极为重要,以下对此进行总结。
2.1 生活方式干预 生活方式干预对于PCOS患者和NAFLD患者都是关键的基础治疗方式。有研究[29-30]表明,通过饮食、运动达到减重后,30%PCOS合并不孕的患者可恢复排卵并自然妊娠,且BMI下降后可改善PCOS患者的妊娠结局及糖脂代谢并发症。对于NAFLD患者,1年内减重3%~5%可以改善代谢综合征组分和逆转单纯性脂肪肝,体质量下降7%~10%可显著降低血清氨基酸转移酶水平并改善NASH,但是体质量下降10%以上并维持1年才能逆转肝纤维化[3]。此外,有研究[31]提出怀孕初期母亲肥胖后,婴儿在青春期患NAFLD的可能性增加。因此,积极改善生活方式对于PCOS合并NAFLD患者尤为重要,尤其是对于肥胖或超重的女性。
2.2 IR的药物治疗
2.2.1 二甲双胍 二甲双胍作为改善外周组织对胰岛素敏感性的药物,使循环胰岛素水平降低,临床已广泛应用于PCOS患者的治疗。Gangale等[32]对42例PCOS合并NAFLD患者进行为期12个月的二甲双胍治疗,转氨酶水平、胰岛素抵抗指数(homeostatic model assessment of insulin resistance,HOMA-IR)、游离脂肪酸水平明显下降,雌二醇和SHGB水平明显上升,可有效降低此类患者的代谢综合征发病风险。虽然二甲双胍对PCOS相关NAFLD有上述积极作用,但对NAFLD肝组织学未见改善[33]。近年来发现二甲双胍除了调节PCOS患者代谢紊乱外,还具有促排卵的作用。一项包括36例青春期PCOS患者的随机对照试验[34]显示,二甲双胍治疗后排卵率比对照组(口服避孕药)高2.5倍(P≤0.001),排卵正常率高6倍(71% vs 12%,P≤0.001),治疗后排卵率升高与治疗中肝脂肪损失相关。因此,PCOS患者及早治疗有助于减少肝内脂肪形成,有可能改善患者排卵异常。
2.2.2 噻唑烷二酮类药物 噻唑烷二酮类(thiazolidinedione,TZD)适用于二甲双胍无效或不耐受的患者,常见药物如罗格列酮、吡格列酮。一项纳入643例PCOS患者的Meta分析[35]报道,吡格列酮相较于二甲双胍更能改善PCOS患者的月经周期和排卵。同样有回顾性研究[36]报道,在口服二甲双胍和抗雄激素药物的基础上加用吡格列酮可显著改善PCOS患者的IR、血脂异常、血清睾酮水平、慢性炎症状态以及NAFLD的发生率。但TZD药物能使患者体质量增加、钠水潴留,且致癌风险增加,仅用于糖尿病患者。目前,美国正在开展一项关于新型的过氧化物酶体增殖物激活受体激动剂Saroglitazar magnesium用 于 治 疗 PCOS合并NAFLD的 临 床 试 验 (NCT03617263)。
2.2.3 胰高血糖素样肽-1(GLP-1)受体激动剂 GLP-1受体激动剂作为新型降糖药物,目前已被美国食品药品监督管理局批准用于治疗2型糖尿病和非2型糖尿病患者减重。研究[37]发现,利拉鲁肽治疗PCOS合并NAFLD(n=19)患者6个月后,体质量下降3%~4%,肝纤维化标志物Ⅲ型胶原原氨基末端肽水平显著降低,但并无肝活检证实肝组织学改变。对72例肥胖的PCOS患者进行为期26周利拉鲁肽随机双盲对照治疗试验[38]显示,利拉鲁肽可以降低肝脂肪含量升高SHBG水平,减少游离睾丸激素,但对胰岛素水平和胰岛素敏感性未见显著影响。
目前,在GLP-1受体激动剂治疗PCOS效果的最新进展中,建议单独使用或与二甲双胍联合使用,艾塞那肽和利拉鲁肽是治疗PCOS的良好选择,特别是为超重或肥胖、糖耐量异常、有心血管疾病或其伴随风险因素和/或正在接受不孕症治疗的PCOS女性制订治疗策略,可以考虑此类药物治疗[39]。此外,最近TheNewEnglandJournalofMedicine发表的NASH患者皮下注射司马鲁肽的安慰剂对照试验[40],结果显示与安慰剂相比,司马鲁肽治疗导致 NASH消退患者的比例更高,但该试验未显示纤维化阶段改善的患者百分比在组间存在显著差异。因此,对于PCOS合并NAFLD女性伴有肥胖时可优先考虑此类药物治疗。
2.2.4 钠葡萄糖共转运蛋白2(SGLT-2)抑制剂 SGLT-2抑制剂,除通过抑制近端肾小管细胞中SGLT-2增加尿糖排泄外,还可以降低糖毒性和脂毒性,以减少炎症反应和内脏脂肪,从而改善IR[41]。近期针对患有PCOS的肥胖女性口服恩格列净与二甲双胍治疗12周的随机对照研究[42]表明,与二甲双胍相比,恩格列净治疗在减重和减少脂肪含量方面效果更加显著;恩格列净组的SHBG和雌二醇水平显著增加,但游离脂肪酸和血清总睾丸激素水平未见明显降低。降糖药物对NAFLD治疗效果最新随机对照试验系统评价[43]中,纳入关于SGLT-2抑制剂7个随机对照临床药物试验,支持SGLT-2抑制剂可以改善血清肝酶水平和肝脂肪含量的结论。同时,部分格列净类药物表现出改善NAFLD患者肝纤维化的趋势[44]。因此,使用此类药物进行治疗已显示出令人鼓舞的结果,对于PCOS相关NAFLD治疗效果值得期待。
2.3 高雄激素治疗
2.3.1 复方口服避孕药(COC) COC可有效改善高雄激素血症,调整月经周期,是PCOS的主要治疗药物之一。除COC外,抗雄激素治疗的常用药物还有螺内酯、氟他胺、非那雄胺等。小剂量螺内酯已被证实可以改善来曲唑诱导的PCOS相关的内分泌代谢紊乱和炎症相关并发症,可能与调整雄激素-脂联素状态有关[45]。
2.3.2 肌醇 肌醇是一种天然的糖醇,作为胞内第二信使参与信号传导,由多个异构体组成,其中肌肉肌醇在体内分布最广,可以促进葡萄糖的摄取和提高卵泡刺激素活性,其衍生物D-手性肌醇改善卵巢中胰岛素相关的雄激素合成。此外,肌醇也被用作NAFLD患者的非处方膳食补充剂,这可能是由于人体内肌醇含量增加后会增强肌醇磷酸聚糖介导的信号传导,从而强化胰岛素途径[46]。在一项系统综述[47](4项随机对照试验,100例患者)中,肌醇与安慰剂相比,自发排卵的可能性显著增加(RR=2.32,95%CI:1.14~4.73)。另一项对90例NAFLD患者进行为期12周松醇(D-手性肌醇的单甲基化形式)治疗的随机双盲对照试验[48]结果显示,与安慰剂组相比,松醇组患者肝脂肪含量、肝酶、甘油三酯浓度显著降低,但谷胱甘肽过氧化物酶水平显著升高。因此,肌醇对于PCOS和NAFLD患者的治疗均有积极作用,而其不良反应仅限于小概率的胃肠道反应,但目前尚未开展PCOS合并NAFLD患者的肌醇治疗,需要进一步的相关研究。
2.3.3 维生素D 维生素D作为性类固醇激素,除参与调节钙磷代谢外,在生殖生理和PCOS发病中可能发挥关键作用[49]。有小型研究[50]提示,30例超重PCOS女性进行每周50 000 IU治疗量维生素D3,为期12周治疗后,可改善血清25(OH)D水平,并降低其多毛症评分和雄激素水平。
2.4 调脂治疗 PCOS合并NAFLD患者常有代谢综合征,贝特类可用于NAFLD患者高甘油三酯血症的治疗,以降低血脂和预防急性胰腺炎,但需警惕其肝毒性。除非患者有肝衰竭或肝硬化失代偿,他汀可安全用于NAFLD和NASH患者降低血清LDL-C水平以防止心血管事件,目前无证据显示他汀可以改善NASH和肝纤维化[3]。对于PCOS的治疗,阿托伐他汀可降低总睾酮水平,升高SHBG浓度等;辛伐他汀联合二甲双胍治疗比单药二甲双胍治疗PCOS显著降低总睾酮、LDL等[51]。
2.5 抗氧化治疗 PCOS患者接受ω-3脂肪酸治疗,可显著改善HOMA-IR、甘油三酯、LDL-C、VLDL-C 和 HDL-C,但不影响血清葡萄糖水平[52]。目前ω-3脂肪酸治疗NAFLD多项临床研究中,美国一项临床试验(NCT02941549)[53]结果表明ω-3脂肪酸显著降低超重患者总胆固醇、糖化血红蛋白、血浆葡萄糖和炎症标志物水平。
2.6 调节肠道菌群治疗 基于肠道微生物群失调理论,PCOS患者应用益生菌超过8周的随机对照试验[54]结果提示,益生菌可以改善患者的BMI、空腹血糖及HOMA-IR并降低睾酮水平;针对益生菌对NAFLD/NASH的治疗效果,目前的临床试验[55]可见患者的转氨酶及脂肪肝程度得到改善,但对组织学特征的影响结果甚少。因此,益生菌在NAFLD和PCOS中的治疗作用尚未确定。
3 小结与展望
综上所述,PCOS患者患NAFLD的风险增加,二者在病理生理机制、代谢异常表现和治疗上均有相互联系。诊治PCOS患者时应考虑到合并NAFLD的可能性,特别是对于伴有IR、代谢综合征和肥胖相关风险因素的患者,可考虑进行相应肝功能和/或超声检查,以利于早期发现,并进行生活方式干预及相关治疗。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:秦婷婷、温晓玉负责拟定写作思路;秦婷婷、魏晓东、张瑞华、邵玥明、张雨负责检索文献,资料分析;秦婷婷负责撰写文章;温晓玉负责修改文章并最终定稿。

