无胆道重建肝切除术后胆漏危险因素的Meta分析
刘 飞,李 海,巫 强
成都医学院第一附属医院 肝胆胰外科,成都 610500
目前肝切除术已成为肝脏良恶性疾病的主要治疗方式之一,尽管肝切除术后并发症的发生率明显降低,但胆漏的发生率未见明显改变[1-3]。胆漏可造成腹腔感染、膈下脓肿甚至肝衰竭等严重并发症,造成患者住院时间延长甚至死亡,是肝切除术后主要并发症之一[4-5]。但对肝切除术后胆漏的诊疗仍缺乏规范统一的方法,常常延误最佳治疗时机,加重患者病情[6],因而明确胆漏的危险因素,从预防入手,尽可能的降低术后胆漏的发生显得尤为重要。
本研究运用Meta分析的方法进一步明确无胆道重建肝切除术后胆漏的相关危险因素,旨在为临床防治胆漏提供参考。
1 资料与方法
1.1 文献检索 计算机检索中国知网、万方、维普、PubMed、Embase、Web of Science、Cochrane Library等数据库,收集从建库至2021年4月国内外关于无胆道重建肝切除术后胆漏相关危险因素的研究报道。检索过程由2名研究者独立完成,如有分歧则通过协商解决,必要时与第三人协商。中文检索词包括:“肝切除”“胆漏”“危险因素”等,英文检索词包括:“hepatectomy”“liver resection”“bile leakage”“biliary leakage”“risk factor”等。对所有纳入文献的参考文献进行手动检索以扩大检索范围。
1.2 纳入与排除标准
1.2.1 纳入标准 (1)治疗方式为肝切除术,不限疾病种类和研究类型;(2)研究目的为分析肝切除术后胆漏危险因素的研究报道;(3)语言仅限于中文和英文;(4)提供了胆漏组和未发生胆漏组病例数量,且对相关因素进行了比较;(5)资料完整,数据详实,纳入及排除标准类似。
1.2.2 排除标准 (1)研究中纳入了肝切除伴有胆道重建的病例;(2)缺乏对照组的研究;(3)会议论文、重复报道、病例报告、综述等;(4)信息缺失、质量严重不足;(5)研究内容与本研究不符。
1.3 文献筛选与资料提取 文献筛选和资料提取均由2名研究者独立完成,过程中所产生的分歧通过协商解决,必要时由第三方裁定。检索所得文献均通过阅读“题目-摘要”进行初步筛选,通过初筛的文献逐一仔细阅读全文予以进一步筛选。一般资料包括:第一作者、发表年份、国家、样本量、患者的性别、年龄以及胆漏和未发生胆漏的例数等。
1.4 文献质量评价 使用纽卡斯尔-渥太华量表(the Newcastle-Ottawa scale,NOS)进行文献质量评价,分别从患者选择、试验组的可比性及结果评估3个方面进行文献质量评分,总分9分,评分≥5分认为是高质量研究[7]。
1.5 统计学方法 应用RevMan 5.4软件对数据进行Meta分析。采用I2统计量法和Q检验法进行异质性检验(P<0.1或I2>50%考虑存在异质性),根据异质性检验结果选用固定效应模型或随机效应模型合并数据,计算OR及95%CI,P<0.05为差异有统计学意义。当存在显著异质性时,进行敏感性分析,即通过每次剔除单项研究来评估该研究对于合成效应量的影响变化,比较剔除前后有无显著差异性,以寻找敏感性的来源并评估研究的稳定性。采用Egger检验法进行发表性偏倚分析,P>0.1提示不存在发表偏倚。
2 结果
2.1 文献筛选流程与纳入文献基本特征 通过检索获得文献677篇,根据纳入及排除标准进行剔除,再经质量评价,最终纳入16篇文献[2,8-22]。其中3篇为中文文献,13篇为英文文献,均为回顾性研究。总病例数16 036例,其中胆漏组1330例,未胆漏组14 706例,胆漏总发生率为9%。文献筛选流程详见图1。纳入文献的基本特征及质量评价见表1。
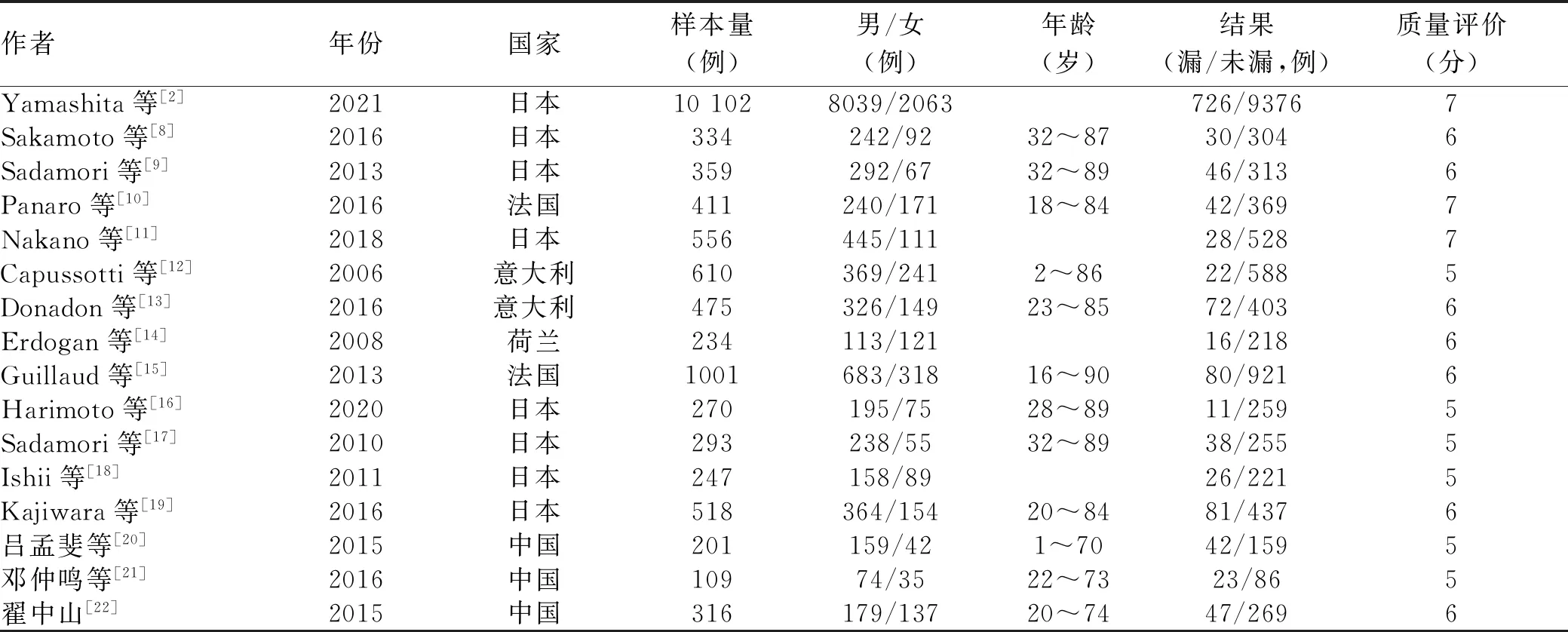
表1 纳入研究的基本特征及质量评价
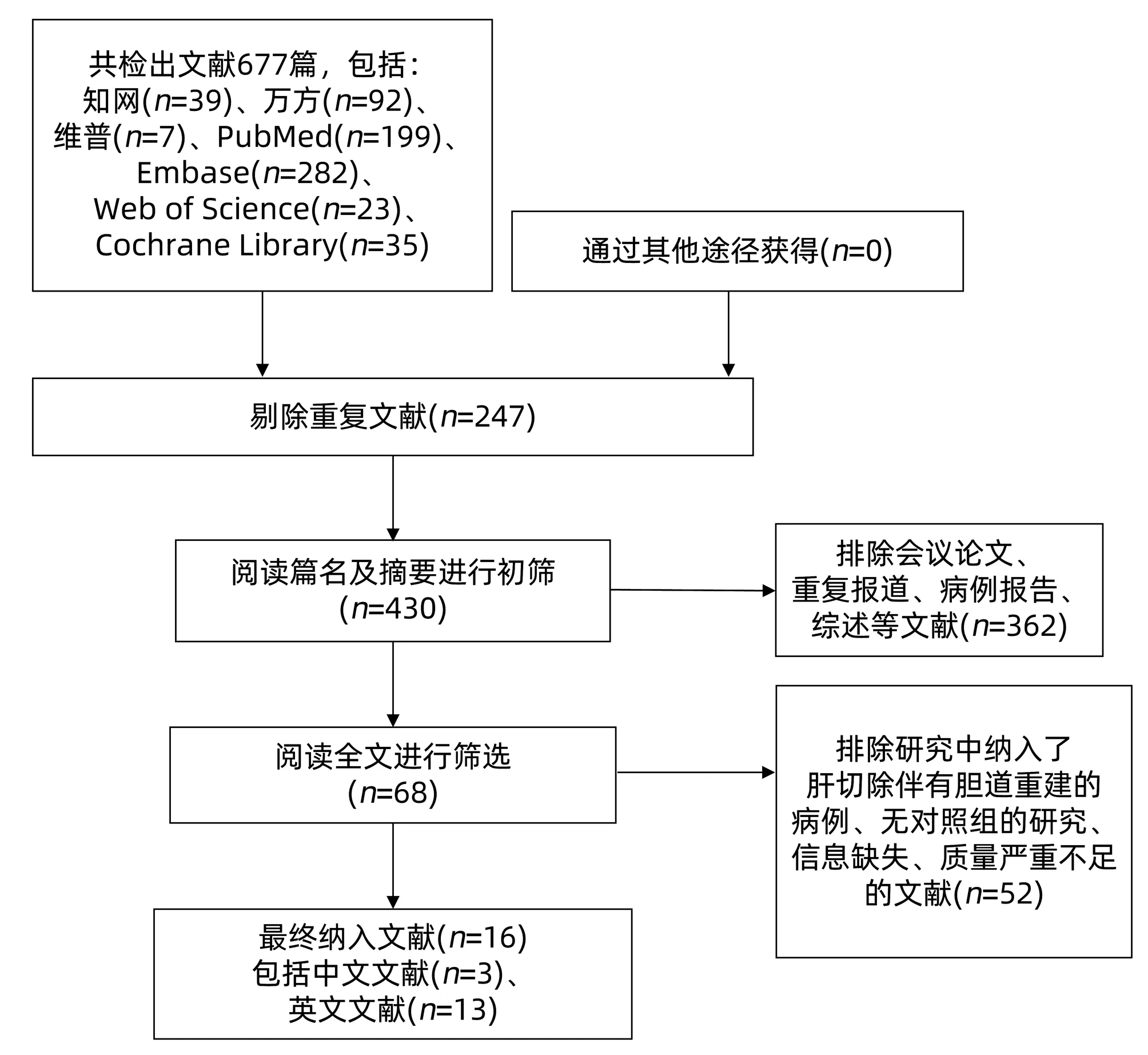
图1 文献筛选流程图
通过全文阅读和资料归纳提取后,选取了13项指标进行Meta分析,分别为:性别、肝硬化、糖尿病、术前肝功能(Child-Pugh A/B分级)、解剖性肝切除、半肝切除(左/右)、Ⅰ段切除、中央肝切除(S4、S5、S8)、左三肝切除、术中输血、术前化疗、既往肝脏手术史。
2.2 Meta分析结果
2.2.1 性别 共13篇文献[2,8-9,11-14,16-18,20-22]研究因素涉及性别。试验组为男性,对照组为女性。各研究之间无异质性(I2=0,P=0.82),采用固定效应模型进行合并分析,结果显示,两组比较差异具有统计学意义(OR=1.27,95%CI:1.09~1.48,P=0.003)(图2)。
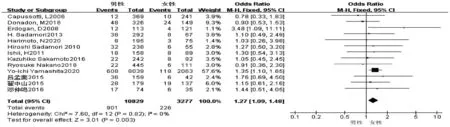
图2 性别对胆漏影响的Meta分析森林图
2.2.2 肝硬化 共8篇文献[8,12-14,16,20-22]研究因素涉及肝硬化。试验组为有肝硬化,对照组为无肝硬化。各研究之间存在显著异质性(I2=82%,P<0.001),运用排除法进行敏感性分析,对纳入文献进行逐一剔除后,结果未发生实质性变化。采用随机效应模型进行合并分析,结果显示,两组比较差异无统计学意义(OR=0.79,95%CI:0.36~1.73,P=0.55)(图3)。
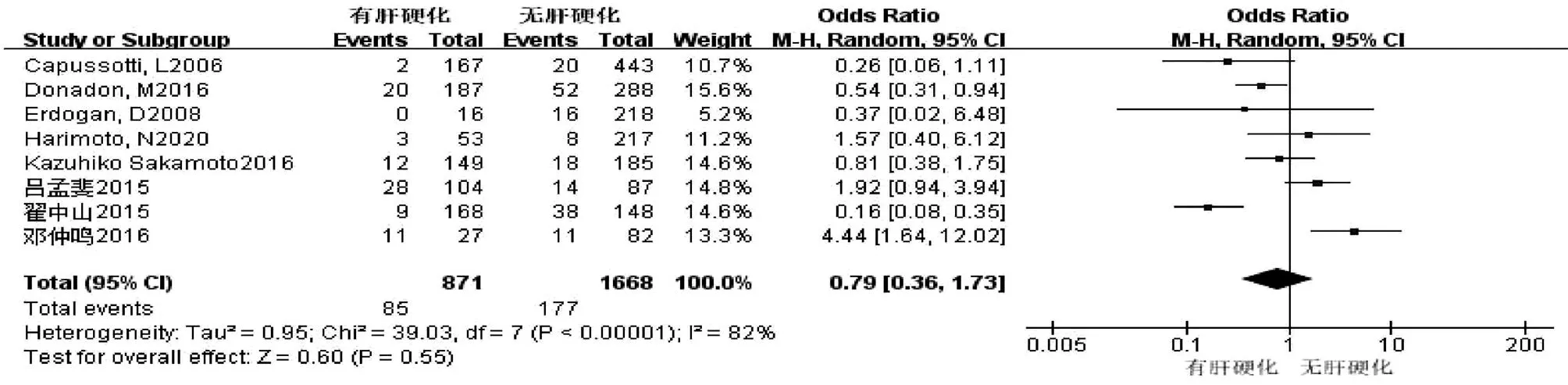
图3 肝硬化对胆漏影响的Meta分析森林图
2.2.3 术前肝功能Child-Pugh A/B 共有8篇文献[9,11,16-19,21-22]研究因素涉及术前肝功能Child-Pugh A/B分级,且所有文献均排除了术前Child-Pugh C级患者。试验组为Child-Pugh A级患者,对照组为Child-Pugh B级患者。各研究之间无异质性(I2=0,P=0.44),采用固定效应模型进行合并分析,结果显示,两组比较差异无统计学意义(OR=0.69,95%CI:0.46~1.02,P=0.06)(图4)。
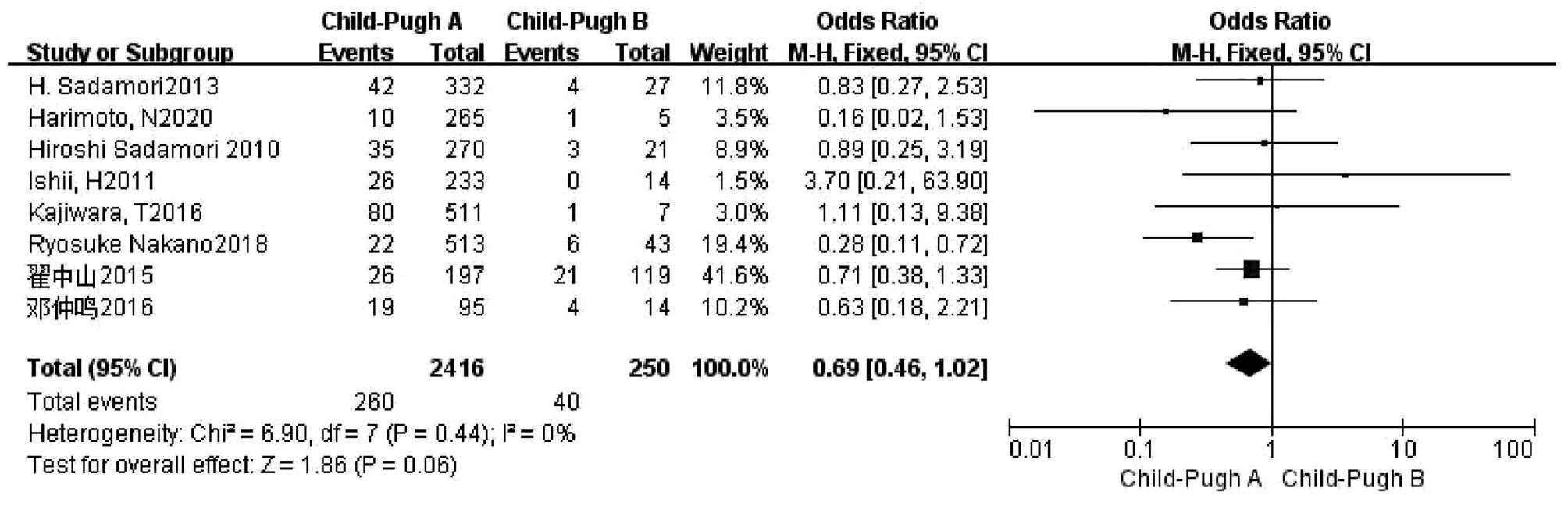
图4 术前肝功能Child-Pugh A/B级对胆漏影响的Meta分析森林图
2.2.4 糖尿病 共9篇文献[2,8-9,11,16-17,19,20,22]研究因素涉及糖尿病。试验组为有糖尿病,对照组为无糖尿病。各研究之间无异质性(I2=0,P=0.89),采用固定效应模型进行合并分析,结果显示,两组比较差异有统计学意义(OR=1.23,95%CI:1.07~1.41,P=0.003)(图5)。
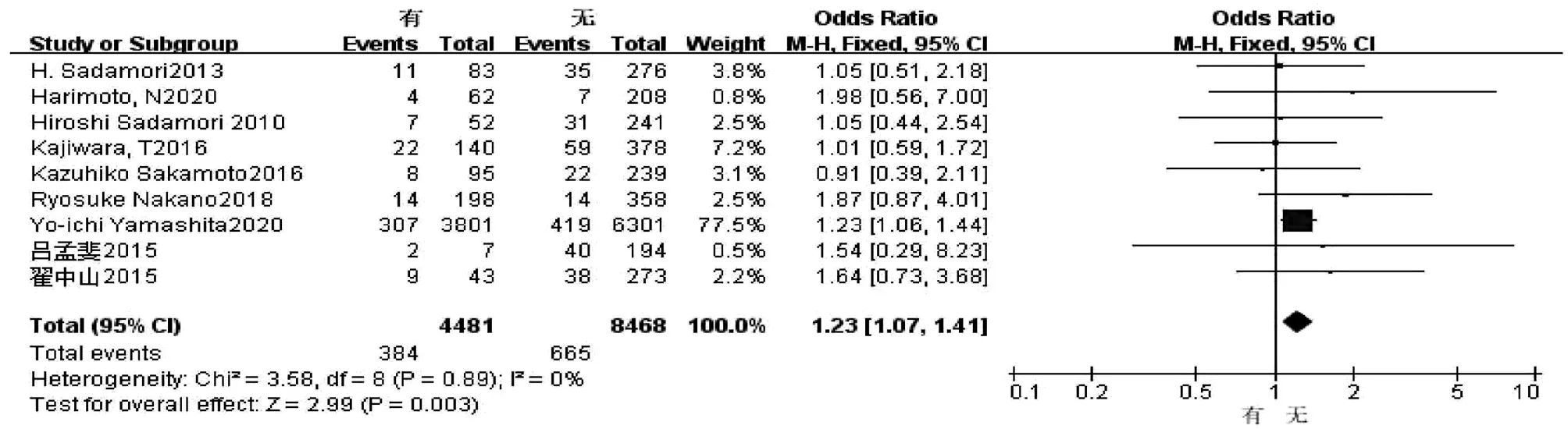
图5 糖尿病对胆漏影响的Meta分析森林图
2.2.5 术前化疗 3篇文献[2,11,18]研究因素涉及术前化疗。试验组为术前有化疗史,对照组为术前无化疗史。各研究之间无异质性(I2=0,P=0.96),采用固定效应模型进行合并分析,结果显示,两组比较差异无统计学意义(OR=1.35,95%CI:0.97~1.89,P=0.08)(图6)。
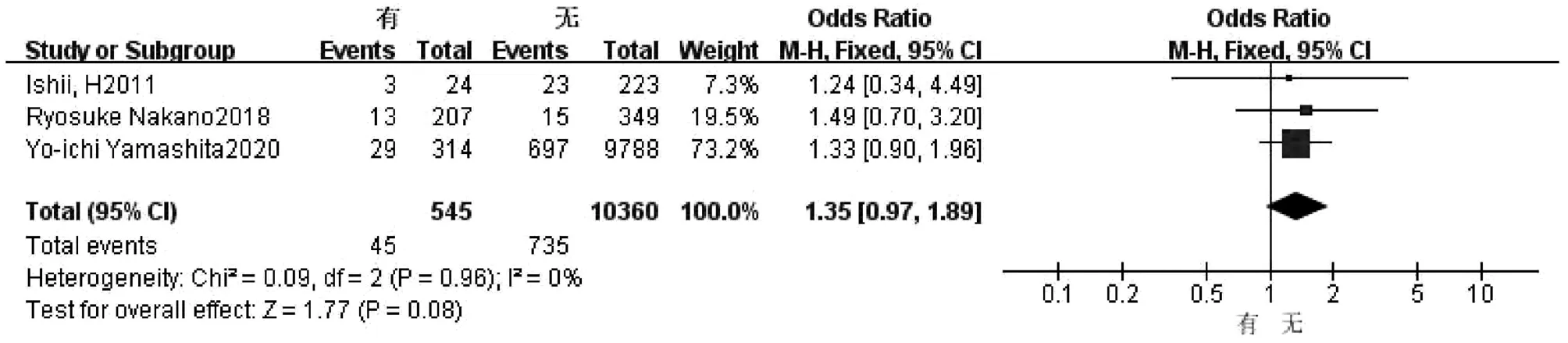
图6 术前化疗对胆漏影响的Meta分析森林图
2.2.6 既往肝脏手术史 共5篇文献[8,14-15,17,22]研究因素涉及既往肝脏手术史。试验组为既往有手术史,对照组为既往无手术史。各研究之间无异质性(I2=34%,P=0.20),采用固定效应模型进行合并分析,结果显示,两组比较差异有统计学意义(OR=2.50,95%CI:1.74~3.59,P<0.001)(图7)。

图7 既往有肝脏手术史对胆漏影响的Meta分析森林图
2.2.7 解剖性肝切除 共5篇文献[9,12-13,16-17]研究因素涉及解剖性/非解剖性肝切除因素。试验组为解剖性肝切除,对照组为非解剖性肝切除。各研究之间无异质性(I2=0,P=0.65),采用固定效应模型进行合并分析,结果显示,两组比较差异有统计学意义(OR=1.58,95%CI:1.09~2.30,P=0.02)(图8)。
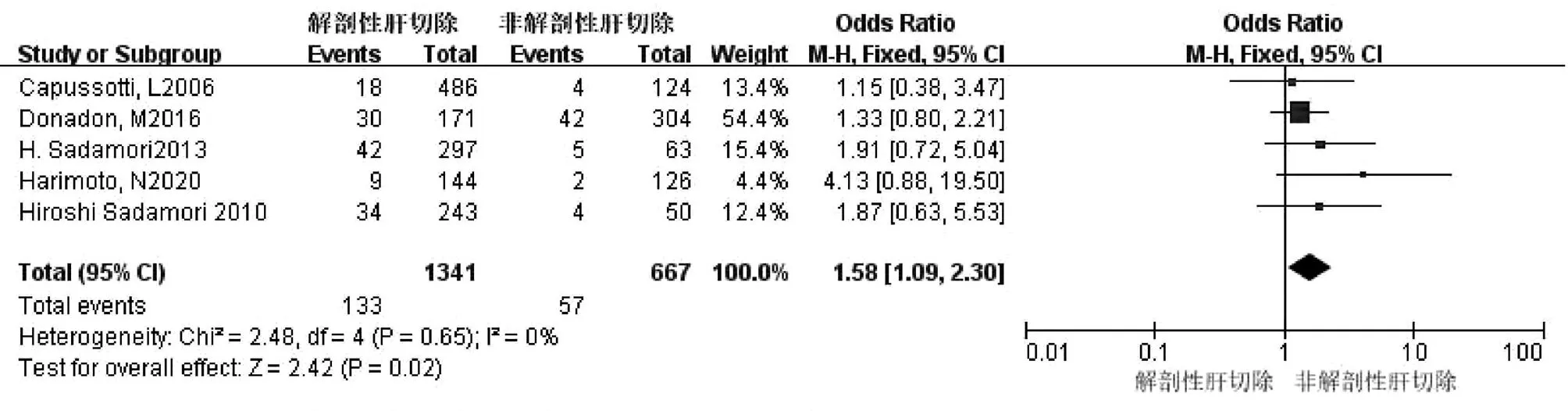
图8 解剖性/非解剖性肝切除对胆漏影响的Meta分析森林图
2.2.8 右半肝切除 共6篇文献[2,8,11-12,14,18]研究因素涉及右半肝切除。试验组为右半肝切除,对照组为非右半肝切除。各研究之间存在轻度异质性(I2=66%,P=0.01),运用排除法进行敏感性分析,对纳入文献进行逐一剔除后,结果未发生实质性变化。采用随机效应模型进行合并分析,结果显示,两组比较差异无统计学意义(OR=1.03,95%CI:0.55~1.91,P=0.93)(图9)。
2.2.9 左半肝切除 共6篇文献[2,8,11-12,14,18]研究因素涉及左半肝切除。试验组为左半肝切除,对照组为非左半肝切除。各研究之间无异质性(I2=30%,P=0.21),采用固定效应模型进行合并分析,结果显示,两组比较差异无统计学意义(OR=0.90,95%CI:0.72~1.13,P=0.35)(图10)。
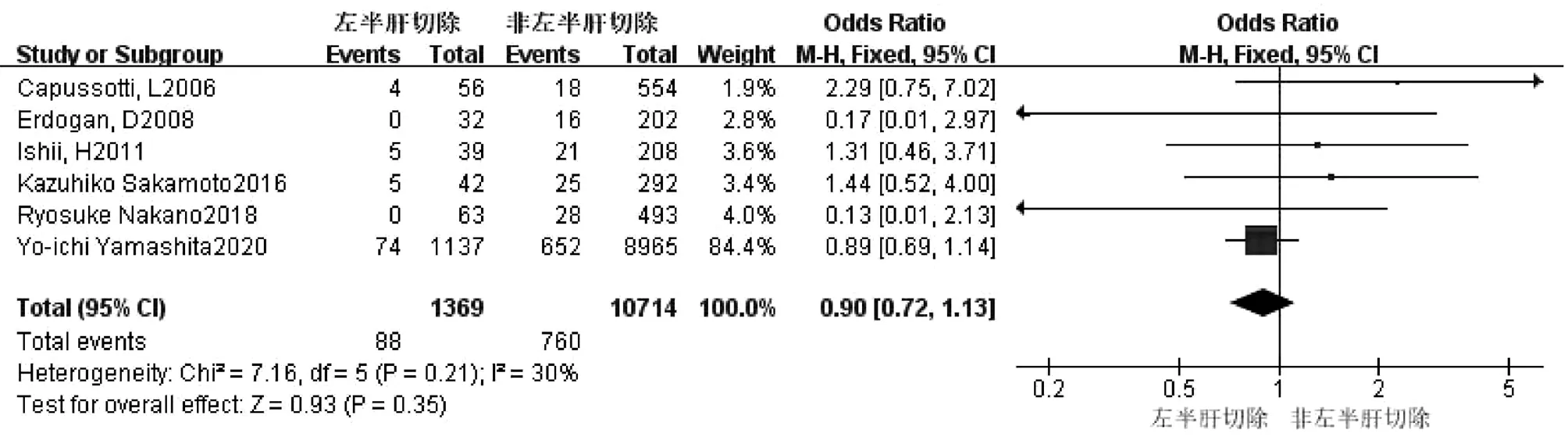
图10 左半肝切除对胆漏影响的Meta分析森林图
2.2.10 Ⅰ段肝切除 共5篇文献[2,8,12-13,15]研究因素涉及Ⅰ段切除。试验组为Ⅰ段肝切除,对照组为非Ⅰ段肝切除。各研究之间存在轻度异质性(I2=61%,P=0.04),运用排除法进行敏感性分析,对纳入文献进行逐一剔除后,结果未发生实质性变化。采用随机效应模型进行合并分析,结果显示,两组比较差异有统计学意义(OR=2.56,95%CI:1.50~4.40,P<0.001)(图11)。
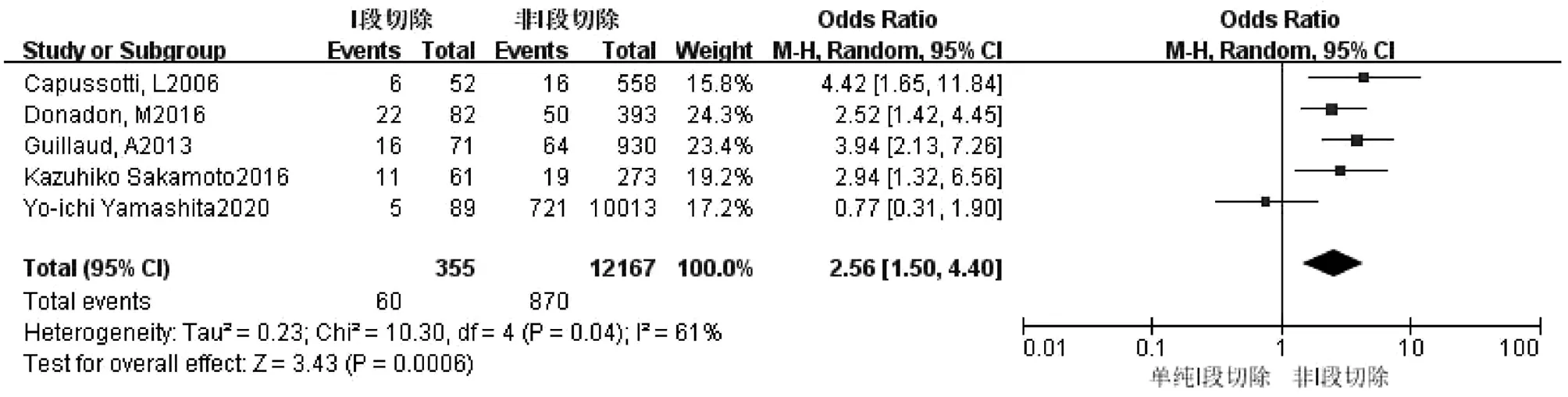
图11 Ⅰ段肝切除对胆漏影响的Meta分析森林图
2.2.11 中央肝切除(S4、S5、S8) 共5篇文献[2,11-12,15,18]研究因素涉及中央肝切除。试验组为中央肝切除,对照组为非中央肝切除。各研究之间无异质性(I2=21%,P=0.28),采用固定效应模型进行合并分析,结果显示,两组比较差异有统计学意义(OR=3.51,95%CI:2.80~4.40,P<0.001)(图12)。
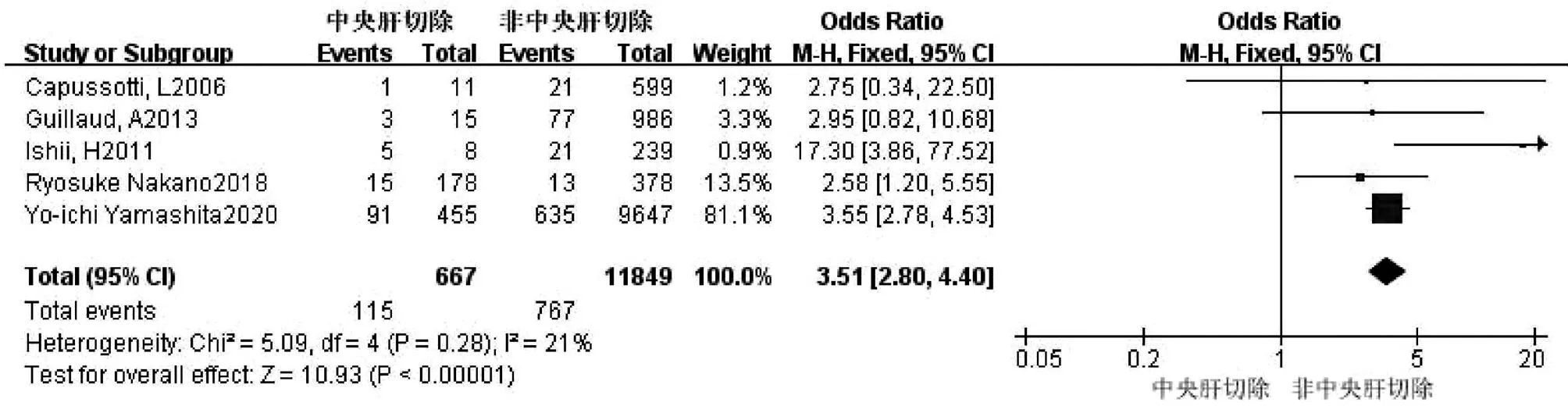
图12 中央肝切除对胆漏影响的Meta分析森林图
2.2.12 左三肝切除 共4篇文献[2,9,17,18]研究因素涉及左三肝切除。试验组为左三肝切除,对照组为非左三肝切除。各研究之间异质性较小(I2=50%,P=0.11),采用固定效应模型进行合并分析,结果显示,两组比较差异有统计学意义(OR=3.53,95%CI:2.32~5.36,P<0.001)(图13)。
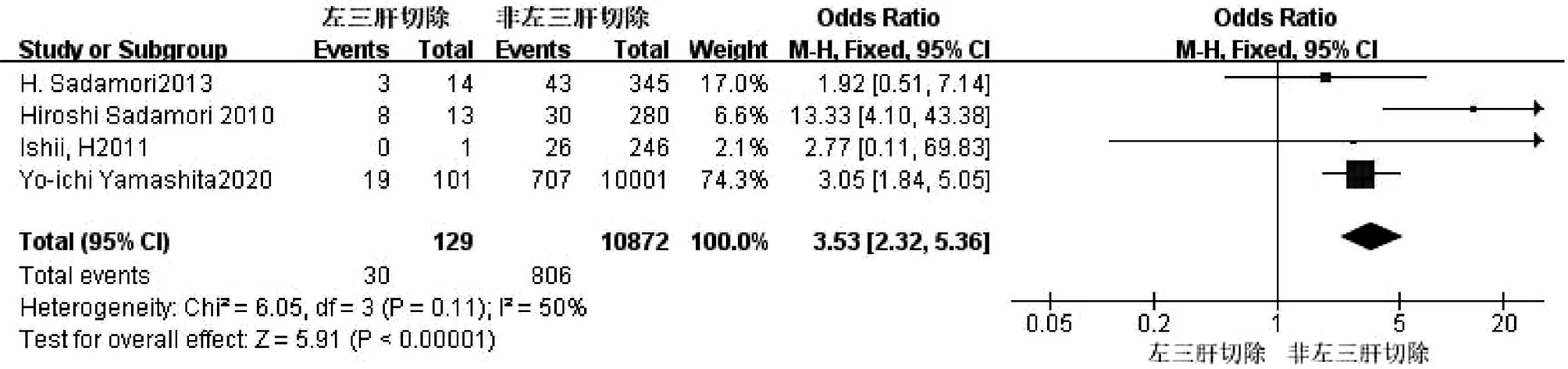
图13 左三肝切除对胆漏影响的Meta分析森林图
2.2.13 术中输血 共5篇文献[13-17]研究因素涉及术中输血。试验组为有术中输血,对照组为无术中输血。各研究之间无异质性(I2=0,P=0.93),采用固定效应模型进行合并分析,结果显示,两组比较差异有统计学意义(OR=2.64,95%CI:1.93~3.60,P<0.001)(图14)。
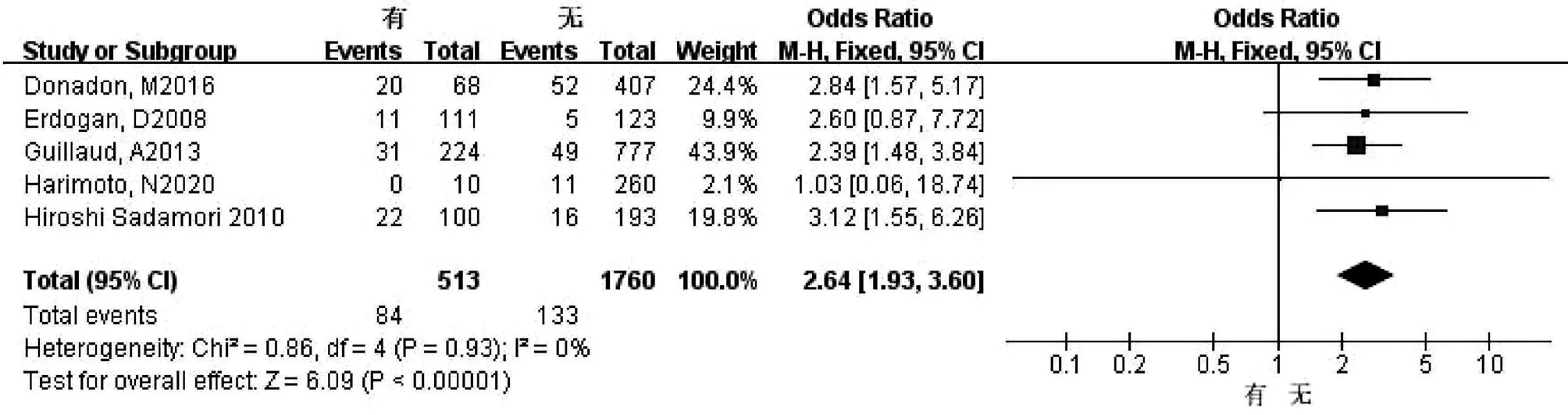
图14 术中输血对胆漏影响的Meta分析森林图
2.3 偏倚分析 Egger检验结果显示,解剖性肝切除(P=0.158)、Child-Pugh A/B(P=0.777)、右半肝切除(P=0.680)、左半肝切除(P=0.964)、Ⅰ段肝切除(P=0.742)、中央肝切除(P=0.796)、左三肝切除(P=0.892)、性别(P=0.545)、术中输血(P=0.515)、糖尿病(P=0.759)、既往手术史(P=0.529)、术前化疗(P=0.901)、肝硬化(P=0.944)均不存在发表偏倚。
3 讨论
胆漏是肝切除术后的常见并发症,严重影响患者预后。有报道[23]显示肝切除术后胆漏的发生率为3.1%~28.0%,这与以往的研究[2-3,24]结果相似。在本研究中,总体胆漏率约为9%,表明随着肝脏外科的发展,胆漏依然是一个十分棘手的问题。尽管近年来对于肝切除术后胆漏相关危险因素的研究已经从单纯对手术因素的讨论扩展至整个围手术期,但众多研究之间对于胆漏危险因素的认识仍存在较大争议[2,25-27]。
本Meta分析结果表明男性、糖尿病、既往肝脏手术史、术中输血是肝切除术后胆漏的高危因素,且解剖性肝切除相较于非解剖性肝切除更容易发生术后胆漏,中央肝切除、Ⅰ段肝切除、左三肝切除相对于其他手术方式具有更高的胆漏风险。而肝硬化、术前肝功能分级、术前化疗史不是术后胆漏的危险因素,左/右半肝切除术相较于非左/右半肝切除术胆漏的风险并未明显增加。
既往研究[28-29]多认为性别并不是胆漏的危险因素,但本研究分析显示男性更容易发生胆漏,这可能受BMI的影响[30],然而笔者未能提取到相关数据进一步分析。既往肝脏手术造成肝周粘连、肝脏解剖结构紊乱等,使得术中组织辨别困难,手术难度增加,易发生术后胆漏[27,31],因而对于有肝脏手术史的患者,术者应加强围手术期管理,术中仔细操作,必要时可运用胆漏试验(即逆行胆管灌注脂肪乳、水、亚甲蓝等特异性物质,观察创面有无渗出,检查有无胆漏)等多种方法,以预防术后胆漏的发生。虽然糖尿病被认为是外科手术并发症的高危因素[32-34],但糖尿病是否会增加肝切除术后胆漏的发生率一直颇具争议[32-38]。本研究表明糖尿病患者术后更容易发生胆漏。肝切除的类型与胆漏的关系仍不明确,是目前讨论的焦点问题。研究[4,39-41]多认为胆漏与肝切除位置(如中央肝切除)和切面面积大小(切面面积越大,胆漏风险越高)有关。但还需更多的更高质量的研究进一步明确,以尽可能地降低术后胆漏的发生率。
本研究中,肝硬化、术前肝功能分级、术前化疗并不是胆漏的危险因素,这与以往的研究[1,42-44]存在差异。笔者认为随着对围手术期管理的重视与规范化,尤其是肝切除术后越来越重视患者的营养支持与肝功能的改善[45],使得术前营养水平、肝功能情况等已不再是影响术后胆漏的主要因素。但对于术前化疗应引起足够的重视。因为随着肝切除适应证的拓宽,越来越多的肿瘤患者,诸如结肠癌肝转移的患者,多在应用全身化疗后有机会进行手术治疗[46],故术前化疗是否会增加术后胆漏的发生这一问题亟需解决。尽管本研究分析结果显示术前化疗不是胆漏的危险因素,但纳入文献仅3篇,因而降低了证据力度,未来还需更多的研究论证该问题。同时由于笔者没有提取到相应的数据分析对于不同性质肝脏疾病是否会影响胆漏的发生,此问题亦需更多的研究探讨。
本研究也存在诸多不足。首先,研究时间跨度大,可能存在文章检索不全,造成资料收集不全面。同时,因胆漏的诊断缺乏统一的标准,纳入文献采用的诊断标准并不统一,可能会对结果造成影响,降低证据力度。其次,因各研究报道中纳入的因素较多,本研究只提取了部分可进行合并的指标,尤其是对于手术相关指标相对缺乏,导致结果不全面。最后,结局指标中肝硬化、Ⅰ段肝切除与右半肝切除的各研究之间存在异质性,敏感性分析并未找到异质性来源,同时也未能获得更多的数据进行亚组分析,采用随机效应模型进行合并,使得证据力度降低。
综上所述,男性、糖尿病、既往肝脏手术史、解剖性肝切除、中央肝切除、Ⅰ段肝切除、左三肝切除、术中输血是肝切除术后发生胆漏的危险因素,对于此类患者,术者应更加重视对于术后胆漏的预防。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:刘飞负责论文构思、文献检索、资料提取、撰写论文;李海负责文献的二次检索及修改文章;巫强指导撰写文章并最后定稿。

