肝癌术后重症患者围手术期低血压的危险因素分析
王 斌,梁汉生,冯 艺,安友仲
北京大学人民医院 a.重症医学科,b.麻醉疼痛医学科,北京 100044
2020年世界卫生组织全球癌症统计数据[1]显示,我国肝恶性肿瘤发病超过41万例,占我国恶性肿瘤发病第5位;死亡人数高达39万,位居我国恶性肿瘤死亡人数第2位。外科手术是目前治疗肝癌的主要手段[2-3]。随着越来越多复杂的肝癌术式进入临床,更多危重患者有机会接受手术治疗。此类手术创伤大,病情复杂,围手术期循环不稳定和低血压是导致患者病情重、预后差的重要因素[4],术后多转入重症监护病房(ICU)。目前,针对肝癌术后转入ICU重症患者围手术期低血压的相关研究尚不多见。本研究旨在通过回顾性分析肝癌术后重症患者的临床资料,明确围手术期低血压发生的危险因素以及围手术期低血压对预后的影响。
1 资料与方法
1.1 研究对象 收集2014年1月—2019年12月于本院因原发性肝癌或转移性肝癌行手术治疗后转入ICU患者的临床资料。纳入标准:(1)年龄≥18岁;(2)入院诊断为肝癌并行手术治疗;(3)外科手术后转入ICU继续治疗,慢性健康与急性生理评分≥10分。排除标准:(1)资料不全者;(2)围手术期发生麻醉意外或呼吸心跳骤停等意外事件者。肝脏手术类型主要为肝部分切除和少量右半肝切除、左半肝切除、肝中叶切除等。将术中或术后需要血管活性药物(去甲肾上腺素、多巴胺、苯肾上腺素、肾上腺素)持续泵入维持血压者纳入低血压组,其他患者纳入非低血压组。
1.2 研究方法 收集所有患者预后相关信息,包括院内病死率、ICU住院时间、总住院时间、机械通气时间以及发生急性肾损伤、低氧血症、肺部感染、心肌损伤情况;同时收集所有患者临床资料,包括性别、年龄、BMI、肝脏手术史、合并症(糖尿病、高血压、冠心病、慢性肾功能不全)、肝脏基础疾病(乙型肝炎、丙型肝炎、肝硬化、脾大、腹水、脂肪肝)、术前实验室检查(Alb、WBC、Hb、PLT、PT、APTT和纤维蛋白原水平)、手术情况(手术时间、开腹手术、腹腔镜手术、肝门阻断时间、多部位手术)、麻醉情况[美国麻醉医师协会(American Society of Anesthesiologists,ASA)分级以及全凭静脉麻醉、诱导后低血压、术中最低体温、失血量等情况]。
急性肾损伤定义为术后48 h内患者肌酐上升≥26.5 μmol/L或7 d内肌酐上升至基础值的1.5倍以上或尿量<0.5 mL·kg-1·h-1持续超过6 h者[5]。低氧血症定义为术后血气检查氧分压/吸入氧浓度<300 mmHg者[6];麻醉诱导后低血压定义为麻醉诱导后平均动脉压下降超过30%。肺部感染定义为术后胸部X线或CT检查可见肺部渗出并伴有咳嗽咳痰及发热和WBC水平升高者[7]。心肌损伤定义为术后48 h内出现肌钙蛋白i或肌酸激酶同工酶-MB异常者。肝硬化定义为既往合并病毒性肝炎或大量饮酒等相关病史,实验室检查示血清Alb水平下降、胆红素升高、PT延长或B超、CT检查可见明确影像学表现或内镜发现食管胃底静脉曲张或肝活组织检查有肝小叶形成者[8]。患者手术操作类型包括开腹手术、腹腔镜手术,经历开腹、腹腔镜中任何1项或多项。
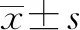
2 结果
2.1 一般资料 共纳入因原发性肝癌或转移性肝癌行手术治疗后转入ICU患者422例,其中男282例,女140例,年龄21~91岁,其中低血压组107例,非低血压组315例。
2.2 预后指标 整体院内病死率为1.9%(低血压组3.7%,非低血压组1.3%)。相较于非低血压组,低血压组患者ICU住院时间更长,机械通气时间更长,术后发生急性肾损伤、低氧血症者、肺部感染更多(P值均<0.001)(表1)。

表1 两组患者预后指标比较
2.3 临床资料 相较于非低血压组,低血压组患者合并冠心病和腹水者更多,术前Alb、PLT和纤维蛋白原水平更低,手术和肝门阻断时间更长,开腹手术者更多,失血量更大(P值均<0.1)(表2)。

表2 两组患者临床资料比较
2.4 多因素分析 将上述有统计学意义的临床指标纳入logistic多因素回归分析,结果显示,手术时间、失血量是肝癌术后患者围手术期发生低血压的独立危险因素,更高的术前Alb水平是其保护性因素(P值均<0.05)(表3)。
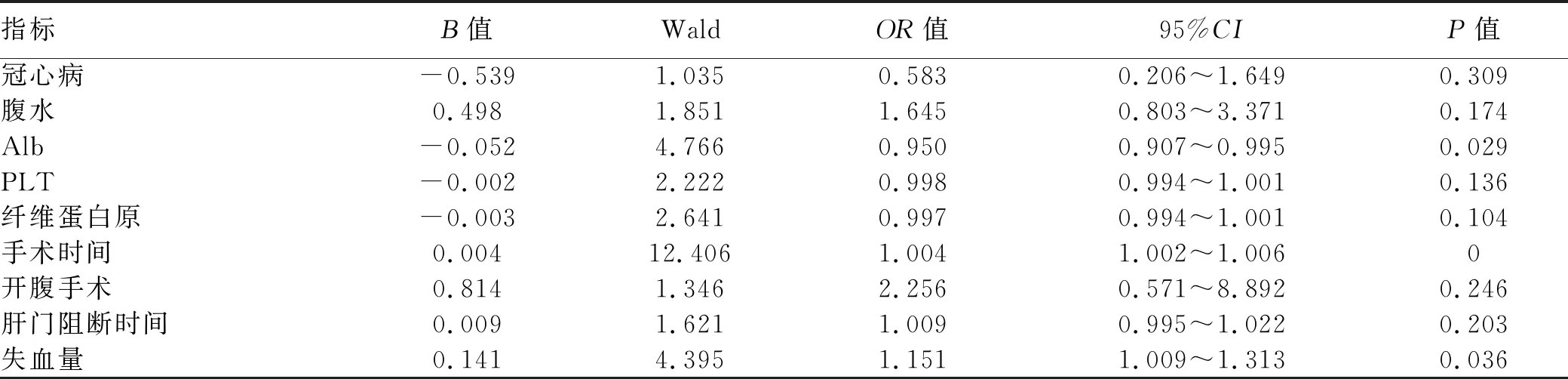
表3 肝癌术后患者围手术期发生低血压的多因素分析
3 讨论
在我国,肝恶性肿瘤发生率呈增长趋势,肝癌外科手术数量也随之增加。肝癌重症患者更多合并凝血功能障碍、代谢紊乱、低蛋白血症及腹水等合并症,术中及术后更易出现出血和低血压等情况[9],术后多转入ICU进行支持治疗。因此,探析肝癌术后重症患者围手术期出现低血压的相关危险因素并分析其对预后的影响,将为临床治疗提供有益证据。
本研究中,肝癌术后转入ICU重症患者围手术期低血压发生率高达25.4%,总体病死率为1.9%,其中低血压组病死率达3.7%;低血压组患者机械通气时间和ICU住院天数均较非低血压组显著延长,AKI、低氧血症和肺部感染人数明显多于非低血压组。上述结果与既往研究[10]相符,即使很短时间的低血压也会导致组织灌注不足,增加术后发病率和病死率。外科手术过程中出现低血压的情况较为常见,而动脉血压降低可能导致心脏、肾脏等重要脏器出现缺血而导致脏器功能损伤[11],还会加重全身炎症反应[12]。气管插管时间延长和全身炎症反应的发生也将增加患者肺部感染及低氧血症等并发症的风险[13],导致患者住院时间延长和病死率增加。
本研究显示,行肝癌手术的重症患者围手术期低血压的独立危险因素为手术时间和失血量,而更高的Alb水平是其保护性因素。
手术时间往往与手术复杂程度和创伤呈正比,本研究患者多为开腹手术,手术时间的延长将导致液体蒸发增加,而这类液体丢失为隐性丢失,更易导致容量不足。手术时间延长同时意味着全身麻醉时间延长,更多麻醉药物的应用使血管张力下降、心脏功能抑制,进而导致低血压[14]。由于麻醉诱导等因素可导致血压迅速降低,术中输液多在手术初期速度较快,而后期速度减慢,且常以晶体液为主,而晶体液在血管内半衰期较短,随着手术时间的延长,大量血管内液体渗出至组织间隙,血管内容量下降更易出现低血压。手术时间延长,患者气管插管时间延长,肺部感染的概率增加,患者术后感染性休克的风险也会增加。
出血量增加可导致失血性休克的风险增加。有研究[15]显示,手术时间延长与失血量呈正相关,一方面与手术延长导致组织和血管损伤带来的直接失血有关,另一方面与手术后炎症反应导致血管渗漏造成的隐性失血关系。也有研究[16]显示,手术时间延长与手术经验有一定相关性,经验的相对不足亦可导致手术损伤和失血增加。既往研究[17-18]显示,大出血患者术后低血压等合并症发生率增加,住院时间延长,病死率增加,与本研究结果相近。
术前更高的Alb水平是肝癌患者围手术期发生低血压的保护性因素。血清Alb水平可以反映患者的一般营养状况和肝储备功能[19]。较高的白蛋白水平提示患者肝脏基础疾病相对较轻,肝功能、出凝血功能较好,手术中出血风险较低;肿瘤侵犯范围可能也相对较小,利于手术的实施,缩短手术时间。此外,Alb本身具有多重生物功能,更高的Alb水平有利于提高血浆胶体渗透压,减少血管内液体外渗,保障血管内容量水平[20],同时还可提高机体免疫力,降低感染发生风险,从而降低感染性休克的发生率。
在单因素分析结果中,低血压组相较于非低血压组患者合并冠心病和腹水者更多、术前血小板和纤维蛋白原水平更低、肝门阻断时间更长、开腹手术者更多,上述特征亦应引起重视。随着我国人口老龄化时代,越来越多的外科患者合并冠状动脉粥样硬化性心脏病,手术应激刺激下可能诱发心肌梗死及心功能不全。针对此类患者,应加强术前超声或心肌酶筛查,以发现潜在心肌缺血患者,提前干预。同时,术前充分补充液体,防止麻醉诱导后低血压,减少心血管事件[21]。临床上肝癌患者合并腹水者多见,应积极行腹部超声排查腹水,对合并腹水患者积极补充人血白蛋白,补足有效循环血容量,有利于患者围手术期循环状态稳定。肝硬化患者往往合并肝功能减退、脾功能亢进,PLT、纤维蛋白原水平下降多见,出血风险高。针对此类患者,术前需积极输血、补充凝血底物调整患者凝血状态,备足手术用血以应对术中出血增加风险。肝门阻断时回心血量减少,血压降低,且肝脏代谢麻醉药物能力下降,麻醉药物对循环的抑制进一步凸显。同时,肝门阻断时间延长导致患者代谢性酸中毒的可能性增加,进一步加剧了低血压发生风险。因此,肝门阻断时间应尽量缩短,阻断肝门时需提醒麻醉医师减少麻醉药用量、加快输液速度以及准备好碳酸氢钠等纠酸液体以应对低血压风险。开腹手术患者液体蒸发量增加,为维持循环稳定,围手术期应注意补充隐性丢失的液体量。
综上所述,肝癌术后重症患者围手术期低血压发生率高,低血压患者ICU住院、机械通气时间延长,AKI、低氧血症、肺部感染发生率增加。手术时间延长和失血量增加是肝癌术后患者围手术期发生低血压的独立危险因素,而术前较高的Alb水平是其保护性因素。因此,行肝癌手术前,应充分设计个性化手术方案,缩短手术时间,调整肝功能,维持术前较高的Alb水平,或可减少患者低血压的发生,从而改善预后。本研究系回顾性研究,且样本量有限,研究结论尚需大样本前瞻性研究加以验证。
伦理学声明:本研究方案于2021年2月7日经由北京大学人民医院伦理委员会审批通过,批号:2021FHB024-001。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:王斌、安友仲、冯艺负责研究设计;王斌、梁汉生负责收集分析研究数据;王斌负责起草、修改文章关键内容。

