炮制工艺对山楂多糖含量影响研究
张光辉,孟庆华
(陕西中医药大学,陕西 咸阳 712046)
山楂又名山里果、山里红,落叶乔木,蔷薇科山楂属,主要分布在我国北方如辽宁、吉林、内蒙古、河北、山东、陕西、山西、河南等地。山楂营养丰富,富含有机酸、多糖、维生素C、胡萝卜素、齐墩果酸、山楂素等三萜类烯酸和黄酮类等。多糖是由单糖分子相互缔合而成的有机高分子化合物,其具有提高免疫力、降血脂、降血压、抗癌、抗氧化等活性。李丹丹[1]等对山楂多糖提取工艺进行了优化,确定提取温度90℃、液料比25∶1、提取时间93 min山楂多糖的得率为53.77%;钟丽霞[2]等对山楂多糖提取工艺进行了优化,发现山楂粗多糖具有一定的降血糖、降血脂作用,其对胰脂肪酶抑制率、α-葡萄糖苷酶的IC50分别为(22.50±0.79)mg/mL、(99.22±0.89)μg/mL;马蕾[3]等用不同浓度浓度的多糖溶液处理人结肠癌细胞(HCT116)12 h,发现其可以显著增加凋亡细胞的比例;商飞飞[4]等研究了山楂多糖的组成主要为要单糖组成为半乳糖、鼠李糖、阿拉伯糖、葡萄糖和半乳糖醛酸,并发现盐洗多糖的体外抗氧化和抗糖化活性明显强于水洗多糖;郑朋朋[5]等优化了大别山山楂提取工艺条件,通过体外抗氧化实验发现山楂多糖具有清除羟基自由基、DPPH自由基和ABTS自由基的能力。本实验通过水提醇沉法提取山楂多糖,利用响应面软件对提取工艺进行优化,并考察不同炮制方法对山楂多糖含量的影响。
1 实验
1.1 仪器与试剂
KQ-400KDE超声波清洗器(昆山市超声仪器有限公司);旋转蒸发仪(郑州瑞科特仪器设备有限公司)型MS系列电子天平(梅特勒);UV1780型紫外可见分光光度计(上海斯迈欧分析仪器有限公司);SJIA-10N-50A型冷冻干燥箱(宁波双嘉仪器有限公司);DHG-9075A烘箱(吴江市永联机械设备厂)。
D-无水葡萄糖标准品(批号 110833-201509卡迈舒上海生物科技有限公司);苯酚(AR);硫酸(AR);石油醚(AR);三氯甲烷(AR);乙醇(AR);正丁醇(AR);山楂(购于西安市药材市场,经陕西中医药大学专家鉴定符合2015《中国药典》一部规定)。
1.2 山楂多糖的提取纯化
将山楂去籽烘干粉碎至粗粉,用10倍体积石油醚回流脱脂3次,每次2 h,常温自然晾干。称量脱脂山楂粉20.00 g置于烧杯中,按一定料液比超声水提取3次,过滤,合并滤液并减压浓缩,加入10倍无水乙醇静置过夜醇沉,抽滤,滤渣冷冻干燥,称重得山楂粗多糖。称取山楂粗多糖1.00 g加水溶解,加入5 mL正丁醇,20 mL三氯乙烷40℃水浴震荡20 min离心,上层清液醇沉抽滤冷冻干燥,得精制山楂多糖。
1.3 标准曲线的绘制
准确称取0.0100 g葡萄糖标准品,加蒸馏水溶解定容至100 mL容量瓶,得到0.10 mg/mL的标准溶液。用吸量管移取0.10 mL、0.20 mL、0.40 mL、0.50 mL、0.60 mL、0.80 mL分别注入10 mL容量瓶,再加入1.00 mL5%的苯酚、5.00 mL浓硫酸水浴显色30 min,最后加蒸馏水定容至10 mL,得到不同浓度的葡萄糖标准溶液,用蒸馏水按上述方法显色校正仪器,于490 nm处测定不同浓度标准溶液吸光度,绘制标准曲线,得线性回归方程:y=51.45x-0.0096,而R2=0.9974>0.99,表明在1~8 μ g/mL范围内线性关系良好。
1.4 多糖含量测定
采用苯酚-浓硫酸法测定山楂多糖含量。准确称量25.00 mg山楂多糖纯品,溶解定容至50 mL容量瓶,摇匀。移取1.00 mL山楂多糖溶液,按照1.3方法显色测定吸光度,按照回归方程结合公式(1)计算多糖含量。
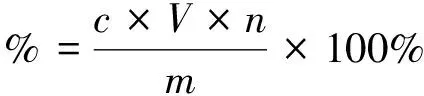
(1)
m精制山楂多糖质量,单位g;n稀释倍数。
1.5 多糖提取工艺优化
1.5.1 单因素试验 称取干燥的生山楂粗粉,以多糖提取率为评价指标,考察液固比(1∶20、1∶30、1∶40、1∶50、1∶60、1∶70)、超声时间(0.5 h、1.0 h、1.5 h、2.0 h、2.5 h、3.0 h)、提取温度(40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃)对山楂多糖的影响。
1.5.2 响应面试验 通过单因素实验筛选,以液固比(A)、超声时间(B)和提取温度(C)为考察因素,生山楂多糖提取率(Y)为评价指标,设计3因素3水平响应面试验,各因素与水平见表1。

表1 响应面因素水平
2 结果与讨论
2.1 单因素试验
2.1.1 固液比对提取率的影响
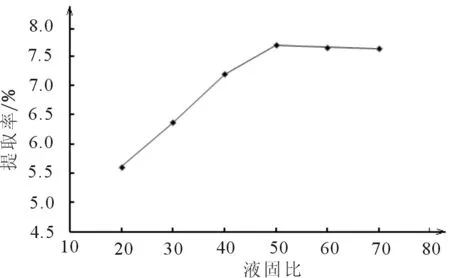
图1 固液比对提取率的影响
单因素实验表明,随着液固比增加,提取率先逐渐增大,后略有减小,主要原因液固比增大,山楂中的多糖可以尽可能的被浸提出来,之后减小可能是由于在醇沉时少部分多糖溶解在水中的原因,故选择液固比50∶1。
2.1.2 超声时间对提取率的影响 单因素实验表明,随着超声时间增长,提取率在1.5 h达到最大,之后提取率变化基本不变,说明山楂多糖在1.5 h基本被溶出,故选择超声提取时间为1.5 h。
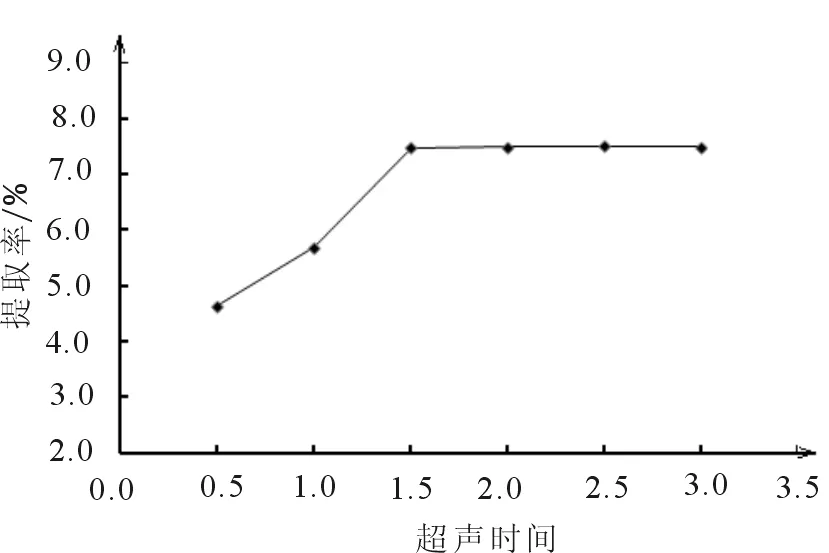
图2 超声时间对提取率的影响
2.1.3 温度对提取率的影响
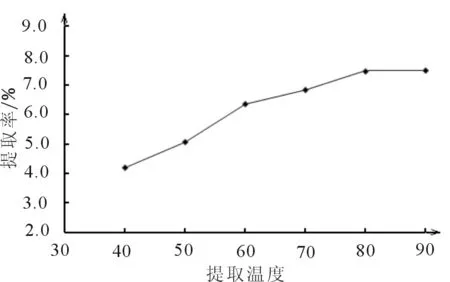
图3 温度对提取率的影响
单因素实验表明,温度越高提取率越大,当温度达到80 ℃之后,提取率基本保持不变,故选择提取温度为80 ℃。
2.2 响应面试验结果
2.2.1 响应面试验设计及结果 表2中17组实验有5组重复性实验,可用于实验误差的估算。依据响应面软件,以多糖提取率为响应值,拟合的多元线性回归方程:Y=7.68+0.31A+0.28B+0.13C-0.16AB+0.050AC-0.058BC-0.30A2-0.26B2-0.079C2。由表3可知,模型P=0.0009 (P<0.01),差异具有统计意义,失拟项P=0.0013(P<0.01),说明误差小,拟合度良好。比较各项F值知各因素对山楂多糖提取率的影响大小为:液固比>超声时间>提取温度。
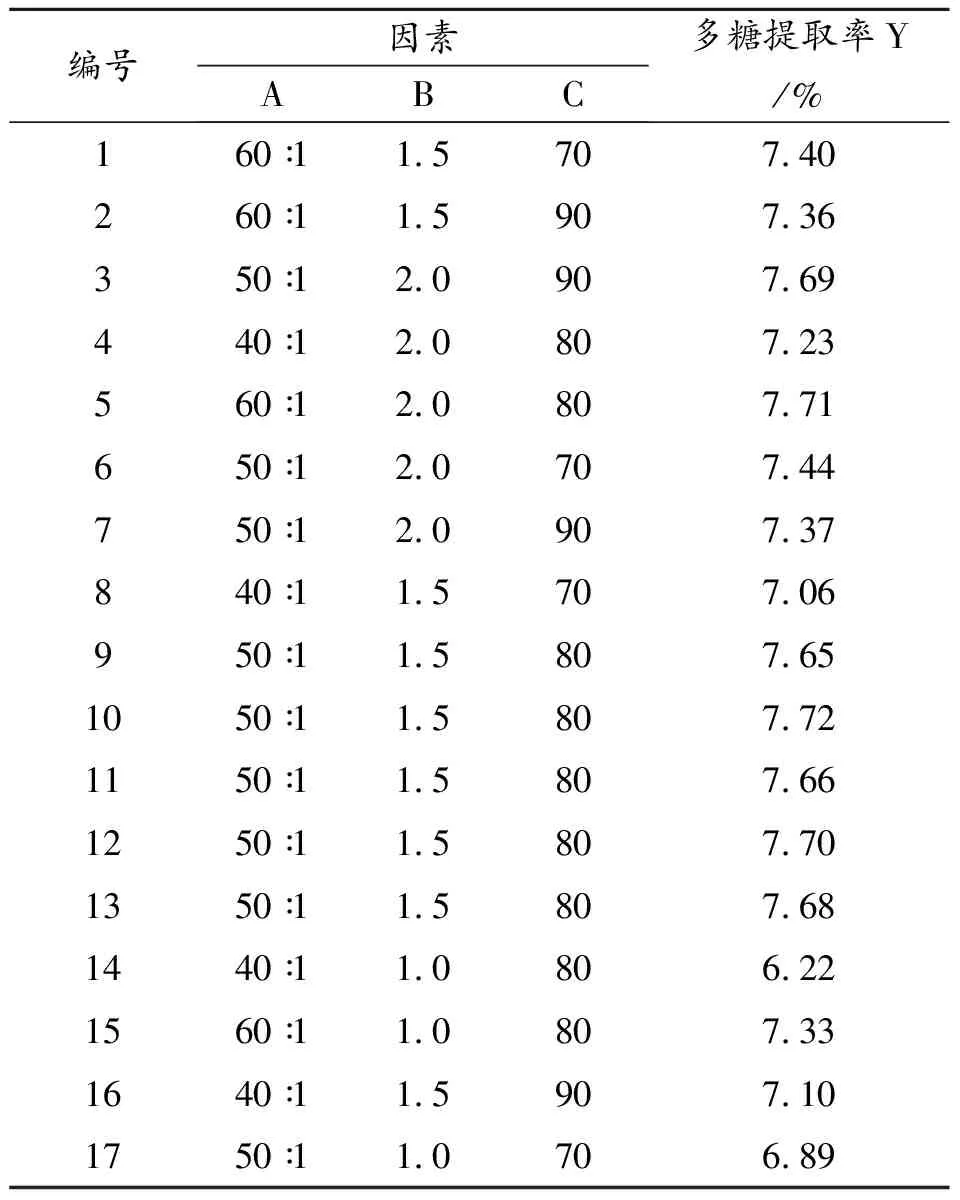
表2 响应面试验设计与结果

表3 响应面回归分析的结果
2.2.2 响应面分析 通过响应面软件预测多糖最佳提取工艺为:液固比52.3:1、超声时间1.62 h、提取温度81.1 ℃,多糖提取率为7.79%,各因素对提取率的响应结果见图4-6。
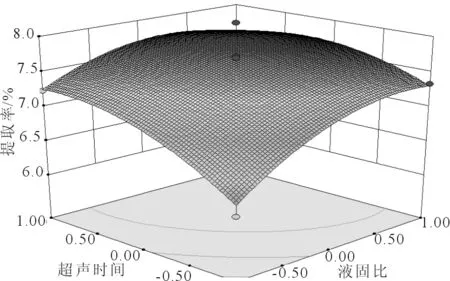
图4 液固比与超声时间对提取率的影响
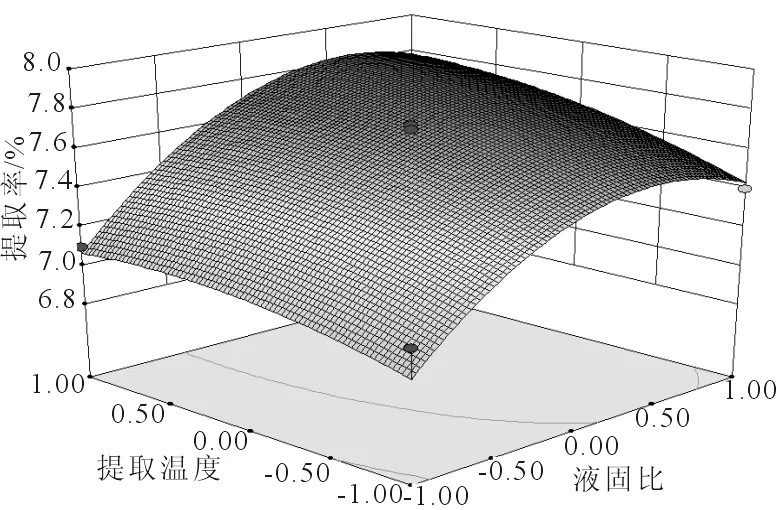
图5 液固比与提取温度对提取率的影响
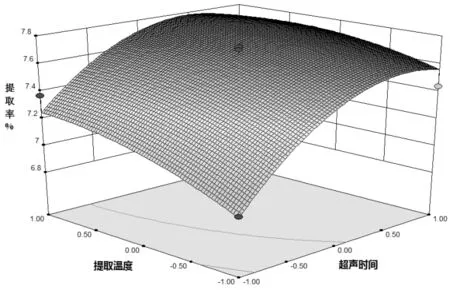
图6 提取温度与超声时间对提取率的影响
2.3 验证试验
为便于实验操作,将预测工艺修正为:液固比52:1、超声时间1.5 h、提取温度81 ℃进行实验,山楂多糖提取率为7.73%,与预测值7.79%接近,表明该工艺方法可行。
2.4 炮制工艺对山楂多糖含量影响
取山楂炭、焦山楂、炒山楂和生山楂烘干去籽粉碎,按照1.1和1.4方法处理计算多糖含量,结果见表4。
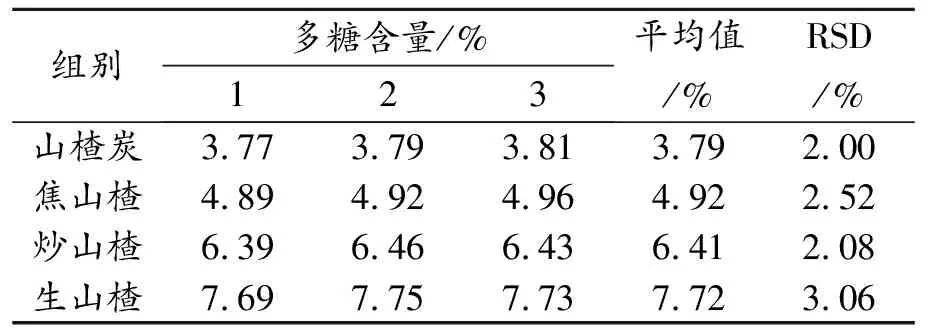
表4 炮制工艺与山楂多糖含量关系
由表4可知,炮制方法不同山楂多糖含量亦有所不同,山楂炭多糖含量最低(3.79%),生山楂多糖含量最高(7.72%),主要原因推测可能是温度过高,或加热时间过长使得山楂多糖碳化。
2.5 方法学考察
精密度试验: 移取0.5 mg/L生山楂多糖溶液1份显色,按1.4方法连续测定吸光度6次,计算得多糖提取率分别为7.67%、7.73%、7.69%、7.70%、7.73%、7.71%,平均值7.71%,RSD=2.34%( n =6),说明该方法精密度良好。
稳定性试验: 移取0.5 mg/L生山楂多糖溶液1份显色,按1.4方法每间隔5 min测定吸光度,计算得多糖提取率分别为7.69%、7.72%、7.75%、7.69%、7.71%、7.68%,平均值7.71%,RSD=2.58%( n =6),说明该方法稳定性良好。
重复性试验: 移取0.5 mg/L生山楂多糖溶液6份,按1.4方法测定吸光度,计算得多糖提取率分别为7.64%、7.73%、7.75%、7.69%、7.73%、7.68%,平均值7.73%,RSD=3.03%( n =6),说明该方法重复性良好。
3 结论
通过单因素实验筛选,利用响应面软件对山楂多糖提取工艺进行优化,确定最佳提取工艺为:液固比52.3∶1(mL∶g)、超声时间1.62 h、提取温度81.1 ℃,多糖提取率为7.79%,在此条件下,不同炮制山楂多糖提取率分别为:生山楂7.72%、炒山楂6.41%、焦山楂4.92%、山楂炭3.79%。该工艺实现了山楂多糖的快速准确测定,可以作为山楂炮制质量控制参考依据之一。

