PjFPS和Pjβ-AS双基因协同作用对珠子参皂苷生物合成的影响
陈 勤,刘美佳,刘迪秋,曲 媛,崔秀明,葛 锋,*
(1.昆明理工大学 生命科学与技术学院,云南 昆明 650500;2.云南省三七资源可持续利用重点实验室,云南 昆明 650500)
珠子参()为五加科人参属药用植物,具有补肺养阴、祛瘀止痛、止血的作用,是重要的常用中药材,为历版《中国药典》收录。三萜皂苷是珠子参的主要活性成分,目前已从珠子参中分离出的40多种皂苷,分为达玛烷型(人参皂苷Rb1、Re、Rd等)和齐墩果酸型(竹节参皂苷Ⅳ和Ⅳa等)两个大类。人参属的大部分药材,如人参、三七、西洋参等主要含达玛烷型皂苷,而珠子参与其他人参属植物在三萜皂苷成分方面有显著差异,其主要含齐墩果烷型皂苷,使得珠子参具有特殊的临床应用和独特价值。因此,探讨珠子参皂苷的生物合成途径,以及开展皂苷合成的调控研究对丰富人参属植物三萜生物合成的认识具有重要意义。
已有研究表明,在植物次生代谢调控过程中,与单一关键酶的影响相比,双酶协同调控的效果更好,譬如鲨烯合酶基因()与羟甲基戊二酰辅酶A还原酶基因()在三七中同时过表达,三七皂苷的合成量比单独过表达更多;在灵芝中,鲨烯环氧酶基因()和共表达比和单独过表达更能促进灵芝酸的产生。人参属药用皂苷为三萜皂苷,主要通过甲羟戊酸(MVA)途径合成,参与三萜皂苷骨架形成的法尼基焦磷酸合成酶(FPS)是三萜皂苷生物合成的关键酶之一。此外,齐墩果烷型皂苷是珠子参的主要生物活性成分,齐墩果烷型皂苷合成支路的第一个关键酶——-香树脂醇合酶(-AS)可能会显著影响PJS的合成。研究表明,珠子参-基因(-)在水稻中表达,可使水稻合成齐墩果酸;在人参中,通过RNA干扰下调-基因表达,可导致齐墩果烷型皂苷含量减少,达玛烷型皂苷含量增加。这些结果说明,调控-的表达可以有效影响齐墩果烷型皂苷的生物合成。本研究在珠子参细胞中成功实现和-基因的同时过表达,以探讨三萜骨架形成关键酶基因协同皂苷合成分支重要基因调控三萜皂苷合成的有效性和可行性。
1 材料与方法
1.1 实验材料
从云南省丽江市玉龙县获取珠子参药材,经云南大学虞泓教授鉴定为五加科人参属珠子参()。取珠子参药材根部为外植体,诱导愈伤组织,愈伤组织在含有2.0 mg·L2,4-二氯苯氧乙酸(2,4-D)和1.0 mg·L激动素(KT)的MS琼脂培养基上培养,每45 d传代一次。皂苷标准化合物来自国家标准物质标准样品信息中心,其他化学品购于生工生物工程(上海)股份有限公司。
1.2 过表达载体的构建
通过异硫氰酸胍法提取珠子参总RNA,逆转录合成cDNA。(GenBank登录号KP684141)和-(GenBank登录号KP658156)通过特异性引物(表1)扩增。-的RT-PCR如下:94 ℃ 5 min,94 ℃ 30 s,56 ℃/54 ℃ 30 s,72 ℃ 70 s,32个循环。72 ℃延伸7 min。扩增片段,经Ⅰ和Ⅰ酶切后插入pCAMBIA2300s,构建重组载体pCAMBIA2300s-。同样,-S由Ⅰ和Ⅰ酶切后以相同方式构建pCAMBIA2300s--重组载体。通过冻融法将分别具有卡那霉素和潮霉素抗性的过表达载体pCAMBIA2300s-和pCAMBIA1300s--转化根癌农杆菌LBA4404感受态细胞。
1.3 PjFPS转基因细胞系与PjFPS/β-AS转基因细胞系的建立
参照文献[15]的方法,进行珠子参细胞的遗传转化。选取生长状态良好(细胞无颗粒状且呈现淡黄色)的珠子参细胞转接于含有40 mg·L乙酰丁香酮的MS预培养培养基上,并置于25 ℃暗培养3 d。随后,将预培养3 d的珠子参愈伤组织细胞完全浸没于活化的含有重组质粒pCAMBIA2300S-的LBA4404农杆菌菌液中,于25 ℃、110 r·min振荡培养20 min。振荡培养结束后,将珠子参细胞转接至含有40 mg·L乙酰丁香酮的MS共培养基上,于25 ℃黑暗条件下共培养3 d。共培养结束后,用含有400 mg·L头孢霉素的无菌水清洗5~6次,以充分去除农杆菌。清洗结束后,用无菌滤纸吸干珠子参愈伤组织细胞表面的液体。将珠子参细胞转接至含有400 mg·L头孢霉素的MS除菌培养基上,放置于25 ℃黑暗条件下除菌培养15 d。培养结束后,将珠子参愈伤组织细胞转接至含有50 mg·L硫酸卡那霉素和25 mg·L潮霉素的MS琼脂培养基上选择培养上(开始记录生长时间),可以得到稳定过表达基因的细胞系。再通过相同的方法将重组质粒pCAMBIA1300s--转入已过表达的转基因细胞系中,细胞系在含有50 mg·L硫酸卡那霉素和25 mg·L潮霉素的MS琼脂培养基上选择培养后(开始记录生长时间),得到稳定过表达-基因的细胞系。
采用基因组PCR技术进一步验证转基因阳性细胞系。采用CTAB法提取生长了35 d左右的珠子参细胞基因组DNA。用转基因细胞转移DNA(T-DNA)区的卡那霉素抗性基因(II)和潮霉素磷酸转移酶基因(II)检测阳性细胞系,所用引物见表1。
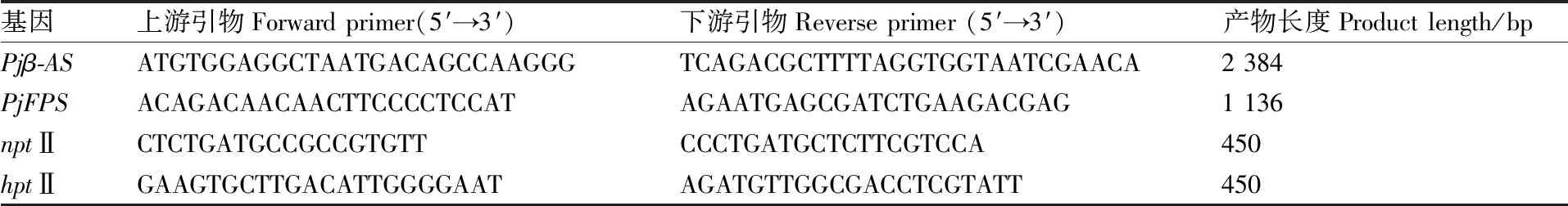
表1 PCR引物Table 1 Primers used for PCR
1.4 实时荧光定量PCR分析
当细胞生长到35 d时,通过qRT-PCR检测关键酶基因(-、、、、和)的转录水平。18(GenBank登录号D85171)序列作为内参基因,所用引物见表2。反应程序:95 ℃ 2 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。每个样重复3次。用2法计算不同细胞中基因相对表达水平。
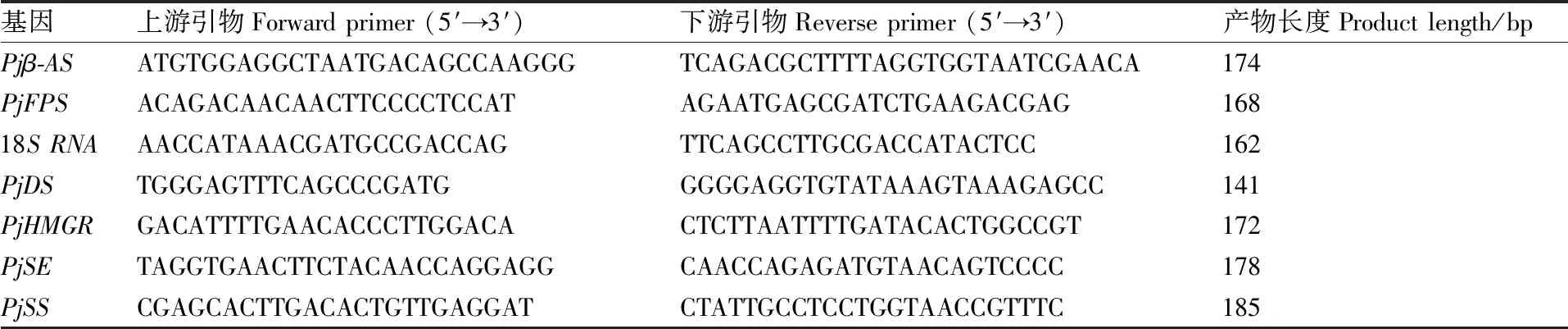
表2 qRT-PCR引物Table 2 Primers used for qRT-PCR
1.5 转基因珠子参细胞酶活性测定
为了研究转基因与未转基因的珠子参细胞系中关键酶FPS和-AS活性的变化情况,对FPS和-AS活性进行了测定。酶活性测定方法如下:取1 g生长了35 d左右新鲜愈伤组织加入2 mL BufferA 进行研磨,BufferA由0.1mol·L蔗糖、0.05 mol·L氯化钠、0.04 mol·L磷酸二氢钾、0.03 mol·LEDTA钠盐组成,pH 值7.2。在4 ℃、12 000×离心2次,每次离心15 min,弃上清,沉淀加入500 μL BufferB和50%甘油,手动匀浆,37 ℃温浴60 min,得到含有可溶性PjFPS和β-AS的蛋白溶液;Buffer B由0.1 mol·L蔗糖、0.05 mol·L氯化钠、0.04 mol·L磷酸二氢钾、0.03 mol·LEDTA钠盐、0.02 mol·L二硫苏糖醇(DTT)构成,pH值7.2。用考马斯亮蓝法分别测定PjFPS和β-AS蛋白的浓度。将上述蛋白进行如下操作:890 μL反应缓冲液,100 μL NADPH溶液,10 μL蛋白提取液(0.2 mg·L),37 ℃温浴20 min后,随后加入底物以启动酶催化反应,反应时间60 min,用紫外分光光度计在340 nm处测定吸光度。根据以下公式计算FPS和β-AS活性,酶活性(μmol·min·mg)=(-)/6.22×0.20×60。
1.6 总三萜皂苷的定量分析
取不同浓度的珠子参总皂苷溶液与香草醛-冰乙酸和高氯酸溶液进行反应,测定不同浓度珠子参皂苷标品在550 nm的吸光度,以吸光度为横横坐标(),珠子参皂苷标准品浓度为纵坐标()制作标准曲线。
取20 g生长60 d左右的新鲜珠子参细胞在55 ℃干燥至恒重。用体积分数70%甲醇超声后离心,蒸发甲醇,之后将提取物溶解于10 mL蒸馏水中,用相同体积的水饱和正丁醇再次抽提,蒸发正丁醇,得到总皂苷。将0.1 g珠子参总皂苷溶于10 mL甲醇,加入显色剂香草醛-高氯酸测定总皂苷含量,在550 nm处测定吸光度,根据标准曲线定量。
1.7 单体皂苷的HPLC分析
标准曲线制作。以Rd标准曲线为例,将Rd溶解于甲醇,配制成1 mg·mL溶液,取不同体积(2、4、6、8、10、15 μL)的溶液进行HPLC检测,以峰面积为横坐标(),浓度为纵坐标()制作标准曲线。
采用高效液相色谱法(HPLC)测定单体皂苷(人参皂苷Rb1和Rd,竹节参皂苷IV和IVa)的含量。色谱柱为Waters-XTerra-MS-C18(5μm,250mm×4.6mm,USA),流动相为0.05%磷酸水溶液和乙腈。梯度洗脱:0—20 min,20%乙腈;20—30 min,20%~35%乙腈;30—40 min,35%乙腈;40—50 min,35%~40%乙腈;50—60 min,40%~100%乙腈。流速为1.0 mL·min,柱温30 ℃,检测波长为203 nm。使用标准曲线用于定量分析。将1.6节制得的珠子参细胞系总皂苷溶液经0.45 μm滤膜过滤后,采用上述高效液相色谱条件测定珠子参细胞中重要单体皂苷含量。
1.8 数据处理
数据以平均值±标准偏差表示。采用检验对数据进行分析,<0.05表示对照组和转基因细胞之间差异显著。
2 结果与分析
2.1 PjFPS和Pjβ-AS在珠子参中的表达
我们前期研究已经获得了过表达基因的珠子参细胞系,以该细胞系为基础,进一步实现了-基因的过表达,获得同时过表达-双基因的细胞系。通过扩增位于载体T-DNA区的II和II抗性基因,筛选出4株-转基因细胞(T1、T2、T3和T4)(图1)。以上述T1~T4株系的cDNA为模板进行和-基因相对表达量的分析,结果表明,与未转基因细胞系相比,4株阳性细胞系中和-基因的相对表达量均有一定程度的提高(图2),其中,T3株系和T4株系的和-基因相对表达量增加最为显著,基因相对表达量最高为对照组的8倍左右,而-基因相对表达量最高为对照组的10倍左右。此外,在和-基因过表达细胞中,皂苷合成主代谢流和下游分支代谢流相关的其他关键酶基因(、、和)的表达量也出现了不同程度提高(图2)。
2.2 PjFPS和Pjβ-AS活性分析

A,nptⅡ基因的PCR结果;B,hptⅡ基因的PCR结果;M,DL2000 DNA marker;1,对照组细胞;2,携带hptⅡ基因空载的转基因细胞系;3~6,PjFPS/β-AS转基因细胞。A,PCR result of nptⅡ;B,PCR result of hptⅡ;M,DL2000 DNA marker;1,Cell lines of control;2,Transgenic cell lines containing empty vector of hptⅡ gene;3-6,PjFPS/β-AS-transgenic cells.图1 转基因珠子参细胞中nptⅡ和hptⅡ的PCR分析Fig.1 PCR analysis of nptⅡ and hpt Ⅱ in transgenic P. japonicus cells

FPS,法尼基焦磷酸合成酶基因;SS,鲨烯合酶基因;β-AS,β-香树脂醇合成酶基因;HMGR,3-羟基-3-甲基戊二酸单酰辅酶A还原酶基因;SE,鲨烯环氧化酶基因;DS,达玛烯二醇合成酶基因。WT,对照组细胞系;T1、T2、T3和T4,PjFPS/β-AS过表达细胞系;T5,转空载体转基因细胞系。*和**分别表示与对照组相比在P<0.05和P<0.01水平差异显著。下同。FPS,Farnesyl pyrophosphate synthase gene;SS,squalene synthase gene;β-AS,β-amyrin synthase gene;HMGR,3-hydroxy-3-methyl glutaryl coenzyme A reductase gene;SE,squalene cyclooxygenase gene;DS,damacendiol synthase gene.WT,wild-type cell line;T1,T2,T3 and T4,four PjFPS/β-AS overexpression cell lines;T5,trans-empty vector transgenic cell line.* and ** meant significant differences between control (non-transgenic cells)and transgenic cell lines at the level of P<0.05 andP<0.01.The same as below.图2 转PjFPS/β-AS珠子参细胞关键酶基因的相对表达水平Fig.2 Relative expression levels of key enzyme genes inP. japonicus cells
单独过表达和-同时过表达的珠子参细胞株系生长到第35天,进行PjFPS和Pjβ-AS活性测定,结果见图3。仅过表达的转基因珠子参细胞中,PjFPS活性是对照组珠子参细胞株系的2~3倍(图3-A),各阳性细胞系PjFPS活性的变化与基因表达的变化趋势基本吻合。与对照组细胞系和转空载体的细胞系相比,-同时过表达的阳性细胞系中PjFPS和Pjβ-AS活性均有一定程度的提高,其中,T3细胞系的PjFPS活性是对照组的3倍(图3-B),Pjβ-AS活性是对照组的7倍(图3-C)。综合和-基因的表达水平和酶活性,说明目标关键酶基因的转录水平和翻译水平都获得了预期结果,成功在珠子参细胞中提高了皂苷合成关键酶PjFPS和Pjβ-AS的表达水平。

WT,对照组细胞系;F1、F2、F3和F4,PjFPS转基因细胞系;F5,转空载体细胞系。下同。WT,Wild-type cell line;F1,F2,F3 and F4,PjFPS transgenic cell lines;F5,Trans-empty vector cell lines.The same as below.图3 珠子参细胞系中FPS和β-AS活性Fig.3 Activities of FPS and β-AS in P. japonicus cell lines
2.3 PjFPS和Pjβ-AS过表达促进珠子参总皂苷的合成
单独过表达的珠子参细胞,其三萜皂苷的生物合成量明显提高,部分细胞系中PJS含量是对照组的2倍(图4-A)。此外,同时过表达和-基因的细胞中,三萜皂苷的生物合成过程得到了更为显著的增强,其PJS含量明显高于单独过表达的细胞系,是单独过表达细胞系的1.5倍;而与WT细胞系相比,PJS含量是对照组的2.5倍。说明在珠子参细胞中同时过表达和-基因可以更有效地促进珠子参皂苷的合成,其调控皂苷合成的效果比单独转基因的效果更佳,说明-确实是PJS合成途径的重要关键酶基因,对齐墩果烷型皂苷的合成起到了刚性调节。
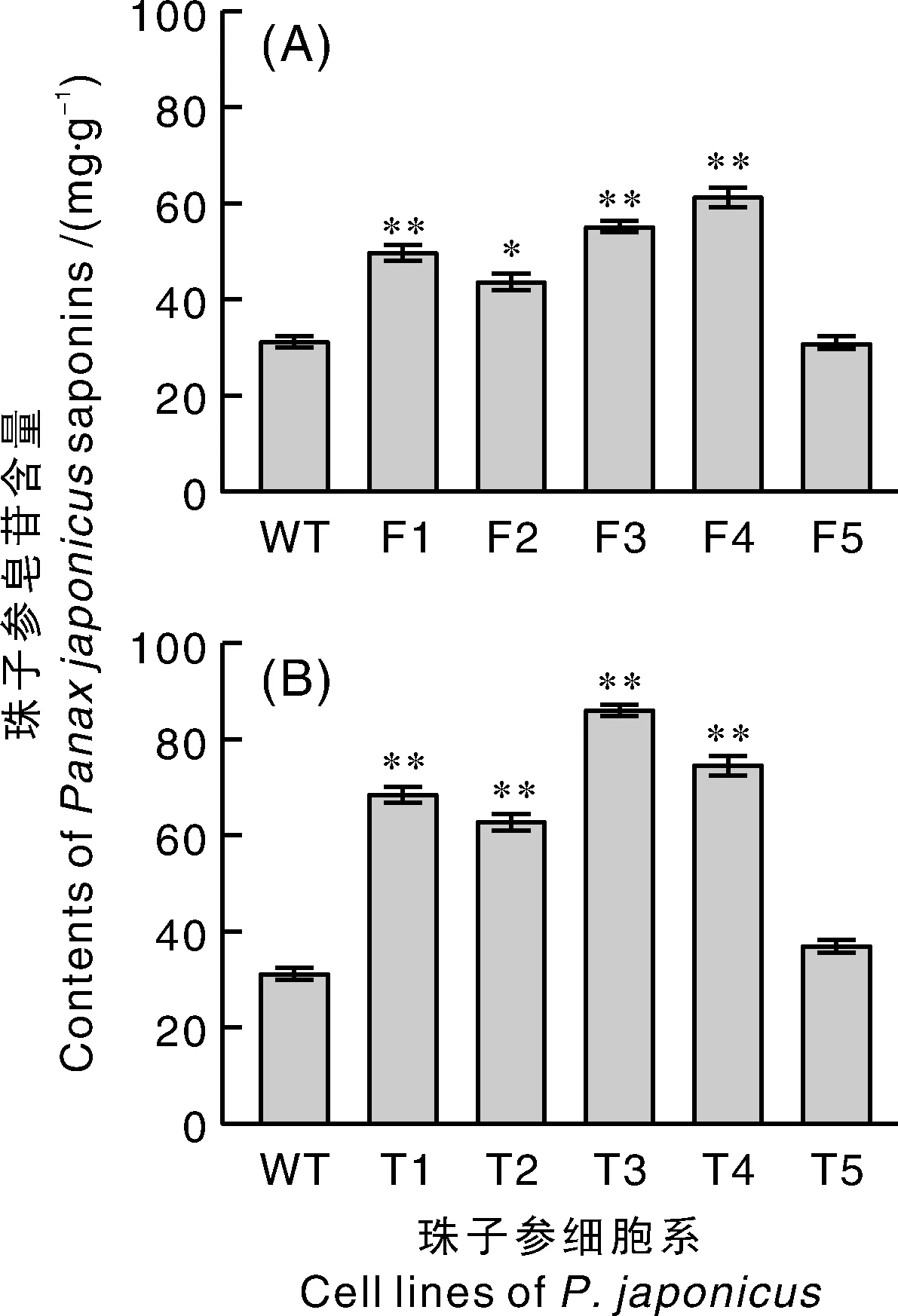
图4 过表达皂苷合成关键酶基因珠子参细胞的总皂苷含量Fig.4 Content of total saponins in transgenic P. japonicus cells
2.4 PjFPS和Pjβ-AS过表达促进了珠子参细胞单体皂苷的生物合成
珠子参中具有代表性的单体皂苷Rd、Rb1、竹节参皂苷Ⅳ和Ⅳa的含量在所有转基因细胞系中均有所增加,包括单独过表达或-同时过表达的细胞(图5)。在转基因细胞系中,达玛烷型和齐墩果烷型皂苷的含量均高于WT细胞系,F4中Rd和Rb1的含量分别约为WT细胞系的2.4倍和2.0倍。在-转基因细胞中,竹节参皂苷Ⅳ和Ⅳa的含量显著提高,而达玛烷型皂苷含量低于单独过表达的细胞,其最大含量分别是对照组细胞的2.2倍和2.0倍。这些结果表明,在珠子参中同时过表达和-基因比单独表达能更有效地促进齐墩果烷型单体皂苷的生物合成,尤其是-的过表达能够定向增加齐墩果烷型皂苷合成支路的代谢流,获得更多的齐墩果烷型皂苷。
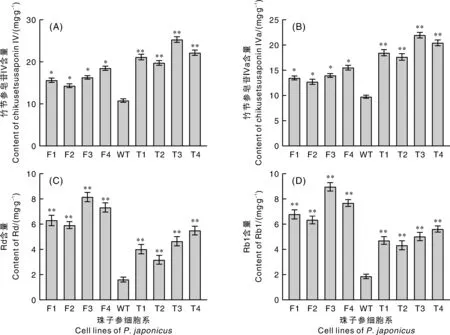
图5 珠子参细胞系中单体皂苷的含量Fig.5 Contents of monomer saponins in P. japonicus cell lines
3 讨论
珠子参作为一种重要的中药,具有抗炎、抗癌、保护心肌血管等多种药理活性,珠子参皂苷是其主要活性成分。珠子参皂苷骨架合成途径中的关键酶基因已被挖掘。人参、三七、西洋参和珠子参是人参属的主要药用植物,它们具有类似的人参皂苷骨架合成途径。三七中过表达可增强三七皂苷的含量;人参中过表达基因可以提高总皂苷含量。在酿酒酵母中的研究证明,1和-基因共表达比单独表达-可以更有效地增加-香树脂醇的含量,说明三萜合成主代谢流增加可有效促进分支代谢物的合成。在本研究中,-作为齐墩果烷型皂苷生物合成分支中的第一个酶基因,同时过表达和-比单独过表达更加有利于珠子参皂苷的合成,说明利用2个酶基因调控人参属植物三萜皂苷的生物合成可能是一种更有价值的策略。
在珠子参中过表达-S可促进齐墩果烷皂苷的生物合成,表明-是齐墩果烷型皂苷生物合成分支中的关键酶基因。当-和在珠子参细胞中共表达时,与单独过表达的细胞相比,齐墩果酸型皂苷(竹节参皂苷Ⅳ和Ⅳa)含量显著增高,而达玛烷型皂苷、人参皂苷Rb1和Rd的含量却有所降低。达玛烷型皂苷和齐墩果烷型皂苷的生物合成共享前体2,3-氧化鲨烯。当齐墩果烷型皂苷合成支路第一个关键酶基因-表达增加时,更多的2,3-氧化鲨烯分流到了齐墩果烷型皂苷合成支路,进而减少了达玛烷型皂苷合成支路所需的2,3-氧化鲨烯,导致达玛烷型皂苷合成量的减少。类似的研究结果在人参皂苷的合成调控中也有所发现,譬如RNAi介导的-基因表达下调,直接导致齐墩果烷型皂苷合成量减少,使得更多的代谢流进入达玛烷型皂苷合成支路,迫使参与达玛烷型皂苷生物合成的关键基因表达水平上调,进而增加了达玛烷型皂苷合成支路的皂苷含量。
与对照组细胞相比,所有转基因细胞系中与皂苷生物合成相关基因(、、和)的转录水平均增强,它们的上调使珠子参皂苷含量的提高趋于合理。尽管我们未对、和基因进行人为干预,但在-转基因细胞系中,、和的表达水平均略高于转基因细胞系,推测和-可能是三萜皂苷合成的重要限速步骤,2个基因的同时过表达,显著增加了细胞可以处理的代谢流水平,进而在一定程度上激活了整条皂苷合成途径。
本研究探讨了和-在珠子参三萜皂苷生物合成中的调控作用,证明和-是珠子参皂苷生物合成途径中的关键酶基因,是皂苷合成的重要调节步骤。此外,结合前人已有研究,发现人参属主要物种的皂苷骨架合成具有相似性和共性,未来可进一步深入开展人参属物种的统筹研究,从“属”的层面探讨皂苷合成的共性与个性。

