成人缺铁性贫血患者消化道肿瘤的危险因素分析
沈晶晶 徐永灿 陈叶龙
[摘要] 目的 探讨成人缺铁性贫血(IDA)患者中消化道肿瘤的患病率及危险因素。方法 回顾性分析2016年1月至2019年12月湖州市中心医院血液科就诊的初治IDA患者154例,分为消化道肿瘤组和良性病变组,比较两组临床特征,并通过多因素logistic回归模型分析危险因素。结果 消化道肿瘤组患者的年龄、铁蛋白、血红蛋白(Hb)、癌胚抗原(CEA)和乳酸脱氢酶(LDH)与良性病变组比较,差异有统计学意义(P<0.05),多因素分析显示年龄、CEA是缺铁性贫血患者消化道肿瘤的影响因素(P<0.05)。结论 消化道肿瘤是IDA的重要原因,而高龄及CEA增高是缺铁性贫血患者消化道肿瘤的危险因素,在临床中需要密切关注。
[关键词] 消化道肿瘤;缺铁性贫血;癌胚抗原;血红蛋白
[中图分类号] R735 [文献标识码] B [文章编号] 1673-9701(2022)05-0105-04
[Abstract] Objective To investigate the prevalence and risk factors of digestive tract tumors in adult patients with iron deficiency anemia (IDA). Methods A total of 154 newly diagnosed patients with IDA admitted to the department of hematology of Department of Hematology, Huzhou Central Hospital, from January 2016 to December 2019 were retrospectively analyzed. And they were divided into the digestive tract tumor group and the benign lesion group. The clinical features of the two groups were compared, and the risk factors were analyzed by multivariate logistic regression model. Results There were statistically significant differences in patient’s age, ferritin, hemoglobin (HB), carcinoembryonic antigen (CEA) and lactate dehydrogenase (LDH) between the digestive tract tumor group and the benign lesion group (P<0.05). Multivariate analysis showed that age and CEA were influence factors of digestive tract tumor patients (P<0.05). Conclusion Digestive tract tumor is an important cause of IDA, and advanced age and increased CEA are risk factors of digestive tract tumor in patients with iron deficiency anemia, which need close attention in clinical practice.
[Key words] Digestive tract tumor; Iron deficiency anemia; Carcinoembryonic antigen; Hemoglobin
缺铁性贫血(iron deficiency anemia, IDA)是最常见的一种贫血,它的病因有机体内铁丢失过多、需求增加以及吸收不良而导致储存铁不足,不能满足红细胞正常生理功能,机体无法代偿后影响血红蛋白合成等。其临床表现为红细胞体积小,并且胞内血红蛋白含量低于正常[1]。贫血会影响到日常的学习生活,严重的会造成精神方面的影响,很多患者有原发基础性疾病,如胃溃疡、月经量过多、痔疮等,但有部分来自消化道的隐匿性出血是成人IDA的常见原因。在铁缺乏患者中消化道肿瘤患病率比血清铁和血红蛋白正常患者更常见。据研究报道[2],IDA患者胃肠道恶性肿瘤的患病率为10%~17%。我国消化道肿瘤发病率高,占恶性肿瘤的50%左右,虽然相关的诊治技术也在不断地提升,但许多消化道肿瘤发现时已发展到晚期,预后较差。Tan等[3]報道IDA可以作为消化道肿瘤的预测因子。本研究通过回顾性分析旨在发现IDA的原因以及IDA患者中消化道肿瘤的患病率及预测危险因素,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2019年12月湖州市中心医院血液科收治的154例IDA患者,每组各77例。其中男56例,女98例,年龄36~85岁,平均(52.45±11.69)岁。纳入标准[4-5]:①符合《血液病诊断及疗效标准》第4版制定的缺铁性贫血诊断标准者;②年龄≥18岁者;③病历资料完整者。排除标准[6-7]:①临床资料不全者;②肝肾功能不全者。本研究通过医院医学伦理委员会批准执行,且患者对本研究知情同意。
1.2 诊断标准
IDA的诊断标准(满足以下第1项以及第2~9项中任意2项及以上,即能诊断IDA)[4]是:①小细胞低色素性贫血:男Hb<120 g/L,女Hb<110 g/L,红细胞有血红蛋白减少表现;②有典型的临床表现和缺铁原因;③血清铁蛋白<14 μg/L;④血清铁<8.95 μmol/L,总铁结合力>64.44 μmol/L;⑤运铁蛋白饱和度<0.15;⑥骨髓铁染色外铁消失,铁粒幼细胞<15%;⑦红细胞游离原卟啉(FEP)>0.9 μmol/L,血液锌原卟啉(ZEP)>0.9 μmol/L,或FEP/Hb>4.5 μg/g;⑧血清可溶性运铁蛋白受体(sTRF)水平>26.5 nmol/L(2.25 mg/L);⑨铁剂治疗有效。
1.3 方法
统计所有IDA患者消化系统症状和体征,进行血常规、铁蛋白(SF)、血乳酸脱氢酶(LDH)、粪便潜血、癌胚抗原(CEA)等检查,对其中恶性病变患者和良性病变患者的辅助检查做单因素比较,再对其中有关联的因素行多因素logistic回归分析。
1.4 统计学方法
使用SPSS 20.0统计学软件进行数据分析,计量资料以均数±标准差(x±s)表示,组间比较用t检验;计数资料采用[n(%)]表示,组间比较采用χ2检验,采用多因素logistic回归模型分析危险因素,P<0.05为差异有统计学意义。
2 结果
2.1 IDA病因分析
154例患者中最常见的IDA病因:胃肠病变、消化道肿瘤、消化道息肉、痔疮、慢性肾功能不全、风湿免疫、膳食不足、血小板减少、月经过多。男患者最常见的病因以胃肠病变为主,共43例(27.9%),对于女患者,月经过多是主要原因,共44例(44.8%)。
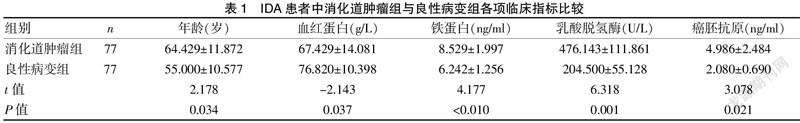
2.2 IDA患者中消化道肿瘤者与良性病变者各项临床指标比较
IDA 患者中消化道肿瘤者与良性病变患者的铁蛋白、年龄、癌胚抗原、血红蛋白(Hb)、乳酸脱氢酶比较,见表1。表1指出消化道肿瘤患者的年龄、铁蛋白、血红蛋白、癌胚抗原和乳酸脱氢酶与良性病变者差异有统计学意义(P<0.05)。
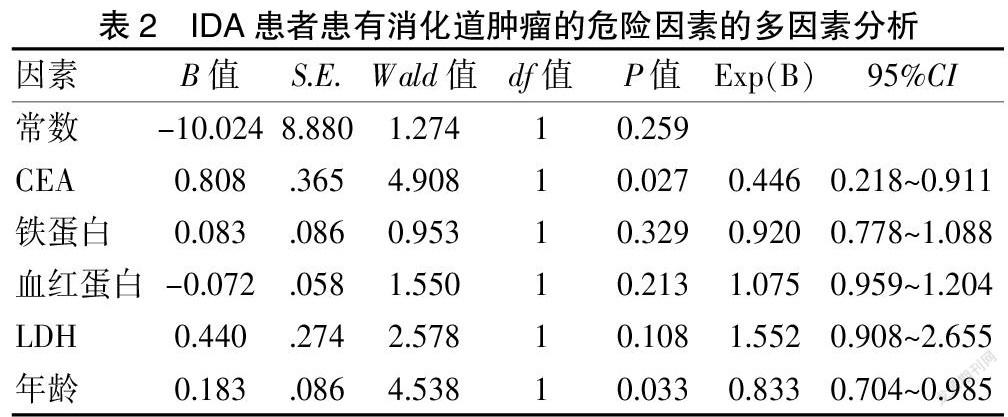
2.3 IDA患者患有消化道肿瘤的危险因素的多因素分析
将患者的年龄、各临床指标进行多因素logistic回归分析,结果显示铁蛋白、血红蛋白、LDH对消化道肿瘤无影响(P>0.05),CEA和年龄有影响(P<0.05)。见表2。
3 讨论
缺铁性贫血是最常见的贫血类型,也是危害人体健康常见病之一,其病因多样,有的较为隐蔽。常见病因有:消化道慢性失血导致铁丢失增多,铁需要量增加而铁摄入不足,铁的吸收不良,游离铁流失增加等因素。非肿瘤因素导致的缺铁性贫血预后一般较好,如治疗得当可达到完全治愈。缺铁性贫血常见于消化系统疾病,主要由消化系统慢性失血以及各种原因导致的吸收功能障碍所引起。比如吸收功能障碍常见于胃切除术患者以及慢性胃炎患者,而消化系统慢性失血最多检验消化道溃疡和消化系统肿瘤患者。通常因消化系统溃疡、慢性胃炎等原因引起的缺铁性贫血首先会有消化系统症状,而消化系统肿瘤患者常伴有慢性失血,并且以缺铁性贫血为首要症状,消化系统症状不明显,故易导致消化道肿瘤的漏诊和延迟诊断。患缺铁性贫血的老年人首先要进行骨髓穿刺检查,并且联合其他检测排除消化道肿瘤,粪便潜血试验便是一种常见的检测方法,但慢性失血它可以是间断性的,需要多次检查避免漏诊,对于老年患者,诊断不明确的前提下,哪怕粪便潜血试验阴性,也要进行内镜检查,其次肛门指诊和内镜检查的联合运用会起到事半功倍的效果。
近些年已经发现越来越多IDA和消化道肿瘤的关联[2-3]。故需要加强对IDA患者消化道肿瘤的早期筛查尤其对于高危因素患者,但是在临床工作中由于经济以及身体或其他因素考虑,并非所有IDA患者都可以经过全面的检查。医务人员如果能够找寻出消化道肿瘤的高危因素来辅助诊断,就能大大提高消化道肿瘤的早期诊断效率,但是在此方面没有很多公开的数据,故本研究主要是为此目的而设计的。
本研究发现IDA患者中消化道肿瘤的患病率为7.1%,与之前朱辞等[8]的研究相仿,通过多因素分析显示年龄和CEA升高与成人IDA患者消化道肿瘤发生率有密切联系,与国内学者周萍等[9]报道结果相符。伴随年纪的增长,免疫功能也会逐渐下降,另外各种危险因素也会随着年龄的增长,在体内不断蓄积,最终导致消化道肿瘤的发生。1965年Gold等首次发现了癌胚抗原,它在各种消化系统肿瘤,比如结肠癌、胰腺癌、肝癌等都具有较高的检出率,患病者指标会明显升高。正常的癌胚抗原在通过胃肠道时会失活不容易检出,但癌细胞分泌的癌胚抗原血液、淋巴,可以进行血清CEA的检测。作为目前应用最广泛的肿瘤标志物之一,正常生理情况下含量较低,其异常增高与癌细胞数量增殖有关[10-13],由于消化道肿瘤患者常伴随慢性失血,故其HB要明显低于良性病变患者。通常恶性肿瘤患者,由于其肿瘤细胞代谢旺盛,经常发生细胞破坏。所以在恶性肿瘤患者中,本研究发现乳酸脱氢酶升高,消化系统肿瘤也是如此。虽然有文章指出LDH与胃消化道肿瘤密切相关,但本研究未发现两者有密切联系,故认为LDH水平不随年龄和其他因素而改变。
本次研究也有不足之处,入组本次研究的都是IDA患者,对于没有贫血但缺铁的患者未入组,存在一定偏差。由于是回顾性研究,只能从病例资料中获取有限的数据,消化道肿瘤的危险因素远不止本文所述,比如饮食、行为、其他因素的影响,饮食一直与消化道肿瘤有着密切联系,多地的流行病学调查表明不良饮食习惯(如吃饭过快,过烫,腌制食物,夜宵等)也是消化道腫瘤的危险因素[14-16]。影响血清癌胚抗原检测结果的因素有很多,比如药物、体内炎症等,所以不能仅看数值升高就判定有患癌风险,而是要结合患者自身情况及病情,必要时定期复查,看数值是否明显增高,如有升高就需要做全面体检,这样才能给临床消化道肿瘤的诊断提供更好的准确的信息。
为了提高缺铁性贫血患者消化道肿瘤的检出率,有报道指出,血清肿瘤标志物的检测对预测肿瘤的发生、转移和复发都有着重要的指导作用。然而,单个肿瘤标志物的特异性不高,所以它的预测价值相对较小。因此,本研究可以利用多种标记物联合检测,通过互补效应,克服上述缺点。怀疑消化道肿瘤患者首先会进行血清癌胚抗原检测,同时联合CA19-9、CA50、CA125、CA72-4等。CEA是消化道肿瘤的主要标志物,75%~85%的结肠癌患者明显增高。CEA对于胃癌、肺癌、大肠癌、胰腺癌等有着积极的诊断意义。最近有报道指出,CA125在大肠癌患者中也会升高,单次检出大肠癌的阳性率为8.0%~30%。CA72-4也是提示胃癌的重要肿瘤标志物。它对胃癌特异性较高,敏感性可达30%~80%。此外糖类抗原CA50特异度低,在其他肿瘤患者体内也会出现升高,因此CA50的变化通常不能作为临床诊断的参考。CA19-9是胃肠腺癌中发现的一种抗原,它的特异性也较低。胃癌、结直肠癌和肝癌患者中均会出现CA19-9升高。有报道指出[17],血清癌胚抗原和CA19-9水平的增高这个情况通常会出现在恶性肿瘤患者身上。如果血清癌胚抗原和铁蛋白同时升高,应尽快进行内镜和胃肠道造影,以确定是否有消化道肿瘤。肿瘤标志物的联合检测对于其早期诊断具有积极的指导作用。
其次不良生活习惯如饮酒也是消化道肿瘤的危险因素,过量饮酒不仅会破坏胃黏膜,又会使胃黏膜增加对致癌物的敏感性,进而增加胃黏膜上皮细胞异质化的机会。幽门螺杆菌、遗传因素等其他影响因素也促使消化道肿瘤的发生,一些人具有家族遗传性,约有5%的肿瘤具有家族遗传性,如有肿瘤家族史,会使消化道肿瘤发生率增加[18]。
细胞的癌变是由许多内外因素共同作用的结果,多数科学家认为对高危人群进行干预,对于肿瘤的防治有着积极的意义,而且能使患者受益。所以对有消化道肿瘤家族史者,需要进行每年一次的常规筛查[19]。一项基于人群的队列研究[20]报道有缺铁性贫血的患者消化道肿瘤发生率比无缺铁性贫血患者要高,这与我们的研究相似,Nahon等[21]也报道随着年龄的增加,消化道肿瘤的发生率也相应增加,这与我们得出的结果相符合。目前大多数消化道肿瘤尚缺乏有效的治疗方法,重治疗、轻预防造成医疗资源不能有效利用,因为IDA可能是消化道肿瘤患者最早期表现之一,对于老年IDA患者出现CEA升高,要尤为重视,当其来就诊时,合理安排必要检查如无痛胃肠镜显得尤为重要,同时也可联合肿瘤标志物的检测[24-26]。缺铁性贫血不是疑难杂症,但因其发病原因复杂,原发病易被首发的贫血症状所掩盖。因此,临床医生不能局限于缺铁性贫血的诊治,更应该首先排查缺铁性贫血的原因,尤其是由于消化系统肿瘤引起的缺铁性贫血,避免不必要的漏诊,从而获得早期手术的机会。
综上所述,成人IDA患者的消化道肿瘤患病率并不罕见,在老年IDA患者中CEA水平高,消化道肿瘤的风险就会更高,因此建议能够对此类患者进行全面的消化道检查,以排除消化道肿瘤可能性。
[参考文献]
[1] 蔡华菊,王宁玲,刘亢亢,等.血清铁调素在婴幼儿缺铁性贫血诊断中的临床意义[J].中国实验血液学杂志,2016, 24(2):546.
[2] Coban E,Timuragaoglu A,Meric M. Iron deficiency anemia- in the elderly; prevalence and endoscopic evaluation of the gastrointestinal tract in outpatients[J].Acta Haematol,2003,110:25-28.
[3] Tan YM,Rosmawati M,Ranjeev P,et al.Predictive factors by multivariate analysis for colorectal cancer in Malaysian patientsundergoing colonoscopy[J].J Gastroenterol Hep- atol,2002,97:590-593.
[4] 沈悌,趙永强.血液病诊断及疗效标准[M].4版.北京:科学出版社,2018:8.
[5] Bradley JM,Le BN,Moore GR.Ferritins:Furnishing proteins with iron[J]. Biol Inorg Chem,2016,21:13-28.
[6] 彭咏,谢永林,周芳.口服胃肠超声检查联合血清肿瘤标记物对中老年胃癌的诊断价值[J].中国医药科学,2020, 10(13):155-158.
[7] 陈朝阳.HBsAg、CEA及CA19-9在结直肠癌肝转移诊断及预后转归中的价值[J].临床医学研究与实践,2020, 5(2):139-141.
[8] 朱辞,王岩,葛飞娇,等.中国胃癌患者贫血的多中心前瞻性临床研究[J].中国肿瘤临床与康复,2014,21(8):897-901.
[9] 周萍,王聪,赵车冬,等.CEA、CA199、CA125、CA724联合检测对胃癌的临床诊断价值[J].实用癌症杂志,2017, 32(9):1427-1429.
[10] 王刚,张茜,张延京.肿瘤标志物的联合检测在肺癌诊断中的价值[J].中华实验与临床病毒学杂志,2015,29(6):537-539.
[11] 倪军,郭子健,张力.单独与联合检测四项肺癌血清肿瘤标志物在肺癌诊断中的价值[J].中华内科杂志,2016, 55(1):25-30.
[12] 陈韩,陈思思,许伍铭,等.血清肿瘤标志物检测在肺癌诊断中的应用价值[J].中国卫生检验杂志,2016,26(10):1373-1376.
[13] Molina R,Marrades RM,Auge JM,et al.Assessment of a combined panel of six serum tumor markers for lung cancer[J].Am J RespirCrit Care Med,2016,193(4):427-437.
[14] 吴扬,喻华芝,郑伟,等.浙江省常见恶性肿瘤危险因素分析[J].中国肿瘤,2012,21(4):258-263.
[15] 吴华斌,明恒泰,刘爱,等.江苏省肿瘤高发地区肝癌影响因素病例对照研究[J].江苏预防医学,2012,23(2):26-28.
[16] 张晓怡,沈毅,韩雅斌,等.桐乡市常见恶性肿瘤危险因素分析[J].浙江预防医学,2014,26(2):150-153.
[17] 莫辉,徐岷.microRNA-1290在消化系统肿瘤中的研究进展[J].中国医药导报,2020,17(29):48-51.
[18] Wong VC,Ko JM,Qi RZ,et al.Abrogated expression of DEC1during oesophageal squamous cell carcinoma progres- sion is age and family history related and significantly associated with lymphnode metastasis[J].Br J Cancer,2011, 104(5):841-849.
[19] Cuyun CGB,Katz ML,Ferketich AK,et al.Dietary intake, food processing,and cooking methods among amish and non-amishadults living in ohio appalachia:Relevance to nutritional risk factors forcancer[J].Nutrition and Cancer,2011,63(8):1208-1217.
[20] Ioannou GN,Rockey DC,Bryson CL,Weiss NS.Iron defici- encyand gastrointestinal malignancy:A population-based cohort study[J].Am J Med,2002,113:276-280.
[21] Nahon S,Lahmek P,Lesgourgues B,et al. Predictive factors of GIlesions in 241 women with iron deficiency anemia[J]. Am J Gastroenterol,2002,97:590-593.
[22] 毛愛芹,张育荣,李宝奇,等.CA19-9、CA72-4 和CEA在阿帕替尼治疗胃癌患者中的变化及意义[J].标记免疫分析与临床,2018,25(5):657-660.
[23] 王国栋,武爱文,李子禹,等.联合检测术前与术后CEA CA19-9 CA72-4对不同分期胃癌根治术后复发的预测价值[J].中国肿瘤临床,2017,44(7):324-330.
[24] 左婷婷,郑荣寿,曾红梅,等.中国胃癌流行病学现状[J].中国肿瘤临床,2017,44(1):52-58.
[25] 宋哲,贾楠,陈宝胜,等.联用IGF-1、CEA、CA19-9 指标进行直肠癌患者临床病理分期预判的效果分析[J].检验医学与临床,2018,15(8):1162-1164.
[26] 杨丽萍,田家强.肿瘤标志物CA19-9、AFP、CEA 及CA724 联合诊断老年消化系统恶性肿瘤的价值研究[J].国际检验医学杂志,2018,39(16):2026-2029.
(收稿日期:2021-03-09)

