机械通气联合肺表面活性物质对呼吸窘迫综合征早产儿脑氧代谢的影响分析
吴丹
呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)属急性肺损伤严重阶段,为早产儿常见并发症,主要表现为极度呼吸困难、心率增速等症状,随着病症的发展,可引发严重缺氧、二氧化碳潴留,死亡率较高[1]。相关研究表示[2],缺氧状态下会引发脑水肿、脑神经损伤,在新生儿中长时间脑缺氧会影响其脑神经系统发育,影响患儿脑代谢能力及正常生长发育能力,需尽早治疗。肺细胞表面缺乏肺表面活性物质(pulmonary surfactant,PS)为患儿组织呼吸功能重要影响因素,需在通气治疗下给药,以改善患儿肺功能状态[3]。常规PS 为在手动气囊加压下给药,但此种通气状态可能会受到人为因素的干扰,出现肺顺应性瞬间变化,影响给药安全性。而机械通气治疗可保证通气稳定性,确保给药过程稳定、安全[4]。为此,本次研究选取本院2019 年1 月~2020 年12 月收治的106 例呼吸窘迫综合征早产儿,探究机械通气联合PS 对患儿脑氧代谢的影响。
1 资料与方法
1.1 一般资料 选取本院2019 年1 月~2020 年12 月 收治的106 例呼吸窘迫综合征早产儿作为研究对象,以随机数字表法分为对照组和观察组,各53 例。对照组男25 例、女28 例;胎龄26~35 周,平均胎龄(29.69±2.20)周;出生体重896~1764 g,平均出生体重(1085.47±227.17)g;出生1 min Apgar 评分1~7 分,出 生1 min 平 均Apgar 评 分(4.26±1.33) 分;X 线 胸片呼吸窘迫分级:Ⅲ级37 例、Ⅳ级16 例。观察组男 26 例、女27 例;胎龄26~34 周,平均胎龄(29.43± 2.08)周;出生体重867~1753 g,平均出生体重(1062.88± 231.05)g;出生1min Apgar 评分1~7 分,出生1 min 平均Apgar 评分(4.18±1.25)分;X 线胸片呼吸窘迫分级:Ⅲ级36 例、Ⅳ级17 例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究已得到医院伦理委员会审批,患者对研究知情自愿参与,并已签署知情同意书。
1.2 纳入及排除标准 纳入标准:①均符合新生儿呼吸窘迫综合征诊断标准[5];②胎龄26~35 周;③胸部X 线检查呼吸窘迫Ⅲ级~Ⅳ级;④持续正压通气下仍呼吸衰竭,出生后6 h 内需接受气管插管机械通气治疗。排除标准:①合并后鼻孔闭锁、膈疝等先天性疾病;②合并先天性心脏病;③合并脓毒症;④合并遗传代谢性疾病;⑤研究期间死亡。
1.3 方法 所有患儿均使用PS 治疗,给予猪肺磷脂注射液(意大利凯西制药公司,注册证号H20080429),对患儿进行气管插管,在齿龈外4~5 cm 处局部消毒,以无菌注射器吸取200 mg/kg 猪肺磷脂注射液,经气管插管向下推注药物,依据患儿临床表现、呼吸困难程度重复使用,总使用次数≤3 次。
对照组应用手动通气,给药前断开呼吸机与气管导管连接处,连接气囊,气囊手动加压正压通气 [16~18 cm H2O(1 cm H2O=0.098 kPa)],并匀速推注猪肺磷脂注射液,注射完毕后持续手动加压5 min,后连接呼吸机辅助通气,呼吸机辅助通气参数与观察组相同。观察组应用持续正压通气,给药前至给药完成均持续予以机械通气治疗,吸气峰压为15~18 cm H2O,呼吸末正压为4 cm H2O,频率为40~50 次/min,氧浓度分数(FiO2)为30%~60%。
1.4 观察指标 ①比较两组不同时间点脑氧代谢情况,使用近红外光谱仪(型号为Spectrum Two N)监测不同时间点(T0、T1、T2、T3)的ScO2。②比较两组不同时间点(T0、T1、T2、T3)tcPO2,均使用监测仪(丹麦雷度,型号为TCM CombiM)实施无创连续监测。③比 较两组康复用时,包括机械通气时间、NICU 住院时间。④比较两组并发症发生率,并发症包括肺炎、肺出血、颅内出血、视网膜病变。
1.5 统计学方法 采用SPSS22.0 统计学软件进行数据统计分析。计量资料以均数±标准差 ()表示,采用t 检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 两组患儿不同时间点脑氧代谢情况比较 T0 时,两组患儿ScO2水平比较,差异无统计学意义(P>0.05);T2 时,两组患儿ScO2水平高于本组T0、T1、T3 时,差异有统计学意义(P<0.05);T1、T2、T3 时,观察组患儿ScO2水平高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 两组患儿不同时间点ScPO2 比较(,%)

表1 两组患儿不同时间点ScPO2 比较(,%)
注:与本组T2 时比较,aP<0.05;与对照组比较,bP<0.05
2.2 两组患儿不同时间点tcPO2比较 T0 时,两组患儿tcPO2水平比较,差异无统计学意义(P>0.05);T2时,两组患儿tcPO2水平高于本组T0、T1、T3 时,差异有统计学意义(P<0.05);T1、T2、T3 时,观察组患儿tcPO2水平高于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患儿不同时间点tcPO2 比较 (,mm Hg)
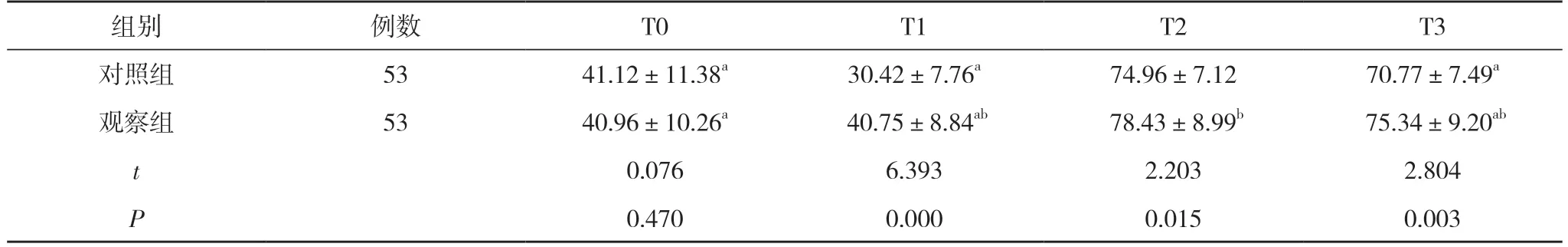
表2 两组患儿不同时间点tcPO2 比较 (,mm Hg)
注:与本组T2 时比较,aP<0.05;与对照组比较,bP<0.05;1 mm Hg=0.133 kPa
2.3 两组患儿康复用时比较 观察组患儿机械通气时间、NICU 住院时间均短于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患儿康复用时比较(,d)
注:与对照组比较,aP<0.05
2.4 两组患儿并发症发生率比较 两组患儿肺炎、视网膜病变、肺出血发生率比较,差异无统计学意义(P>0.05);观察组患儿颅内出血发生率为0,低于对照组的7.55%,差异有统计学意义(P<0.05)。见表4。
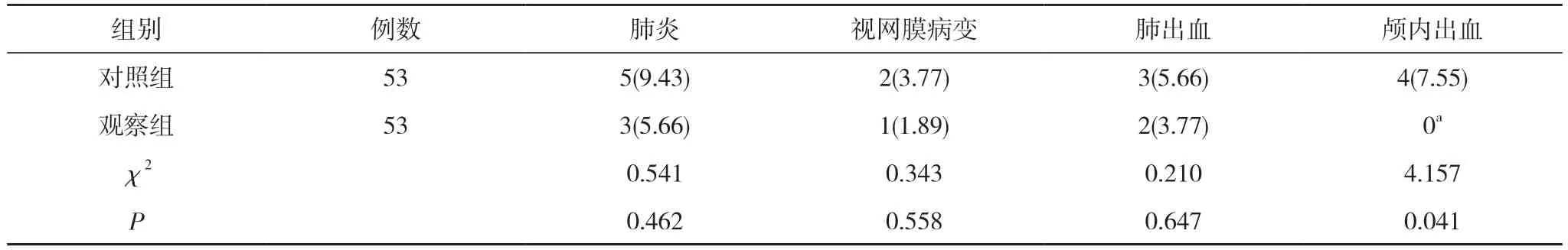
表4 两组患儿并发症发生率比较[n(%)]
3 讨论
PS 为肺泡Ⅱ型上皮细胞分泌的一种脂蛋白,分布在肺泡液体分子层表面,主要作用为维持肺泡容量、降低肺泡表面张力,避免发生呼气末肺塌陷,对维护新生儿正常肺功能具有重要作用。在对呼吸窘迫综合征早产儿PS 给药中需在患儿呼吸道机械通气状态下完成,传统给药方案为暂时断开呼吸机与气管导管的连接,在经导管注入PS 期间,通过手动气囊加压通气,此种给药目的为确保PS 注入质量,保证PS 在患儿肺泡表面均匀分布,以改善患儿自主通气中PS 缺失对其肺功能影响,但其缺点为手动气囊加压受护士操作主观因素影响,给药期间易出现气囊压力控制能力低、通气频率不能满足自主通气频率等情况,影响患儿肺部通气顺应性恢复能力,因此治疗效果有限[6]。
无创正压通气治疗属无创性通气,通过鼻面罩将呼吸机与患者呼吸道相连,使患儿呼吸功能在呼吸机匀速、稳定支持下,维持其稳定气道正压,以预防肺泡塌陷,提升其肺部气体交换能力,改善患儿肺部顺应性。同时持续气道正压通气可减少患儿呼吸做功,促进已经塌陷的肺泡重新扩张,以进一步改善患儿通气能力,为目前早产儿通气治疗中重要的治疗办法[7]。在此基础上应用PS 治疗,可在患儿肺泡稳定呼吸运动基础上通过药物作用提升PS 作用价值,以满足临床治疗需求[7,8]。
本次研究中,对两组患儿分别在手动通气、持续正压通气治疗基础上应用PS 治疗,在对患儿脑氧代谢研究中发现,T2 时,两组患儿ScO2水平高于本组T0、T1、T3 时,差异有统计学意义(P<0.05)。由此考虑原因为,T2 时为PS 用药后5 min,此时为PS 在肺泡表面充分作用高峰期,此时间点患儿肺部通气能力明显提升,血氧水平显著改善,脑氧分压水平相应上升。在本次对tcPO2研究中可见,T2 时,两组患儿tcPO2水平高于本组T0、T1、T3 时,差异有统计学意义(P<0.05)。由此可说明在PS 给药后5 min 时患儿处于肺部呼吸运动最佳时间点,此时其血氧水平、脑氧代谢水平均处于最佳水平,可有效辅助机械通气治疗进一步改善肺泡塌陷、肺部呼吸功能障碍现象[8]。而在两组组间脑氧代谢比较中发现,T1、T2、T3 时,观察组患儿ScO2水平高于对照组,差异有统计学意义(P<0.05)。考虑原因为在PS 给药中,观察组患儿持续接受持续正压通气治疗,此时经导管实施PS 给药治疗对患儿呼吸运动影响较小,使其在理想肺部呼吸功能状态下接受药物治疗,将药物作用效果最优化,避免患儿发生呼吸节律紊乱,保证其通气质量稳定性[9]。
本次研究结果还发现,观察组患儿机械通气时间、NICU 住院时间均短于对照组,差异有统计学意义(P<0.05)。观察组患儿颅内出血发生率低于对照组,差异有统计学意义(P<0.05)。考虑原因为,颅内出血发生原因与患儿动脉压波动明显相关,而患儿肺动脉压稳定性对整体动脉压具有直接影响;若患儿出现自主通气能力下降,其心肺负荷增加,动脉压随之升高,颅内出血风险相对升高,延长患儿住院治疗时间;而在接受持续正压通气联合PS 治疗期间,患儿可在稳定呼吸状态下接受PS 治疗,改善患儿自主肺部通气能力,减轻其心肺负荷,使其肺动脉压保持稳定状态,避免患儿动脉压波动过大而引发颅内出血。在其他并发症发生率比较中,两组患儿肺炎、视网膜病变、肺出血发生率比较,差异无统计学意义(P>0.05),但就具体数值而言,观察组仍具有微弱优势,考虑原因为观察组患儿动脉压稳定后可避免因出血、失血影响患儿视网膜及肺部血管功能,并随观察组患儿自主通气能力增强,其自身免疫能力随之增强,可降低感染性疾病发生风险,对缩短其通气治疗时间、缩短住院治疗时间具积极意 义[10,11]。
综上所述,对呼吸窘迫综合征患儿应用机械通气联合PS 治疗,可有效改善患儿脑氧代谢及氧分压,缩短康复周期,降低颅内出血发生率。

