CONUT评分对老年脓毒症患者短期预后的预测价值分析
王娇 武日茹 提俊响
脓毒症诊治一直是临床医生面临的重大难题,有研究估计全球20%的死亡率由脓毒症导致[1]。老年人是脓毒症的高发人群,据文献报道,老年脓毒症患者的死亡率较高,约为50%~60%[2]。老年患者因全身退行性改变及各脏器功能下降,当出现脓毒症后,大量分解代谢,可能会导致或加剧潜在的营养不良,营养不良可能是反映脓毒症住院患者疾病严重程度的一个标志,能够更好的协助临床医生进行风险分层,做出正确的临床决策。本研究回顾性分析急诊重症监护病房老年脓毒症患者的临床资料,对众多可能影响患者预后的因素进行分析,初步探讨老年脓毒症患者入院CONUT评分与短期预后的关系,以期提高早期预警,从而进行早期干预、个体化诊疗,降低病死率。
1 资料与方法
1.1 一般资料 回顾性分析2018 年9 月~2021 年4 月 北京京煤集团总医院急诊ICU 收治的240 例老年脓毒症患者的临床资料。纳入标准:①符合脓毒症3.0 诊断标准;②年龄>65 岁。排除标准:①急诊ICU 住院时间≤24 h;②合并血液系统疾病、肿瘤终末期、严重肝肾功能不全、近期使用抗凝药物治疗、明显的免疫功能抑制者;③病历资料不全或失去随访。本研究经医院伦理委员会审查符合医学伦理学标准并获得批准,所有治疗和检测符合诊疗规范,并均获得患者或家属的知情同意。
1.2 方法 收集患者的性别、年龄、吸烟史、饮酒史、合并症、感染灶等一般资料,以及血培养阳性情况、APACHE Ⅱ评 分、SOFA 评 分、CONUT 评 分、AKI 发生情况、脓毒症休克情况、气管插管情况、入院第 24 小时LAC 水平、诊断脓毒症至入急诊ICU 时间。根据患者28 d 转归分为存活和死亡。
1.3 诊断标准 AKI 诊断:采用KDIGO 指南定义的肌酐(Scr)诊断标准:①48 h 内Scr 增高≥26.5 μmol/L;②或Scr 增高≥基础值的1.5 倍,且确认或推测上述情况7 d 内发生,由于尿量记录欠完整,故只采用Scr诊断标准。脓毒症是指因感染引起的宿主反应失调导致的危及生命的器官功能障碍。对于感染或疑似感染的患者,当脓毒症相关SOFA 评分较基线上升≥2 分 可诊断为脓毒症;脓毒性休克是指在脓毒症的基础上,出现持续性低血压,在充分容量复苏后仍需血管活性药来维持平均动脉压(MAP)≥65 mm Hg(1 mm Hg=0.133 kPa)以及LAC>2 mmol/L。28 d 生存率认为是脓毒症患者短期结果的最合适和有意义的终点,28 d 存活定义为:诊断脓毒症后生存时间>28 d,包括28 d 内好转出院、随访存活或者仍在住院中患者。
1.4 统计学方法 采用SPSS26.0 统计学软件处理数据。计数资料以率(%)表示,采用χ2检验;符合正态分布的计量资料以均数±标准差()表示,方差齐性采用t 检验,方差不齐采用校正t 检验;不符合正态分布的计量资料以中位数(四分位数)[M(P25,P75)]表示,采用Wilcoxon 秩和检验。对脓毒症预后进行单因素分析;采用条件向前法对筛选出的单因素指标进行多因素Logistic 回归分析。P<0.05 表示差异有统计学意义
2 结果
2.1 患者基本资料统计 240 例患者中男136 例,女104 例;主要感染灶:肺部感染162 例,泌尿系统感染52 例,肝胆系统感染12 例,其他感染14 例;28 d 存活140 例,死亡100 例,28 d 病死率为41.7%。
2.2 单因素分析 存活与死亡患者性别、吸烟史、饮酒史及合并症、主要感染灶、血培养阳性率、诊断脓毒症至入急诊ICU 时间比较,差异均无统计学意义(P>0.05)。死亡患者年龄(75.19±4.27)岁、APACHEⅡ评分(25.26±5.15)分、SOFA 评分[9(7,12)]分、CONUT评分[4(3,6)]分、AKI 发生率58.0%、脓毒症休克发生率55.0%、气管插管率45.0%、入院第24 小时LAC[2.22(1.07,2.92)]mmol/L 均高于存活患者的(72.89± 4.47)岁、(20.42±5.71)分、[8(5,10)]分、[3(2,4)]分、37.1%、33.6%、30.0%、[1.75(0.87,2.65)]mmol/L,差异均有统计学意义(P<0.05)。见表1。2.3 多因素Logistic 回归分析 将单因素分析中P<0.05 的指标引入Logistic 回归模型中,采用Forward:LR 法筛选变量,在排除混杂因素的影响后,多变量分析结果显示,年龄、APACHE Ⅱ评分、SOFA 评分、CONUT 评分、AKI 均为脓毒症患者28 d 死亡的危险因素(P<0.05)。见表2。
表1 影响脓毒症临床预后的单因素分析[n(%),,M(P25,P75)]

表1 影响脓毒症临床预后的单因素分析[n(%),,M(P25,P75)]

表2 多因素Logistic 回归分析
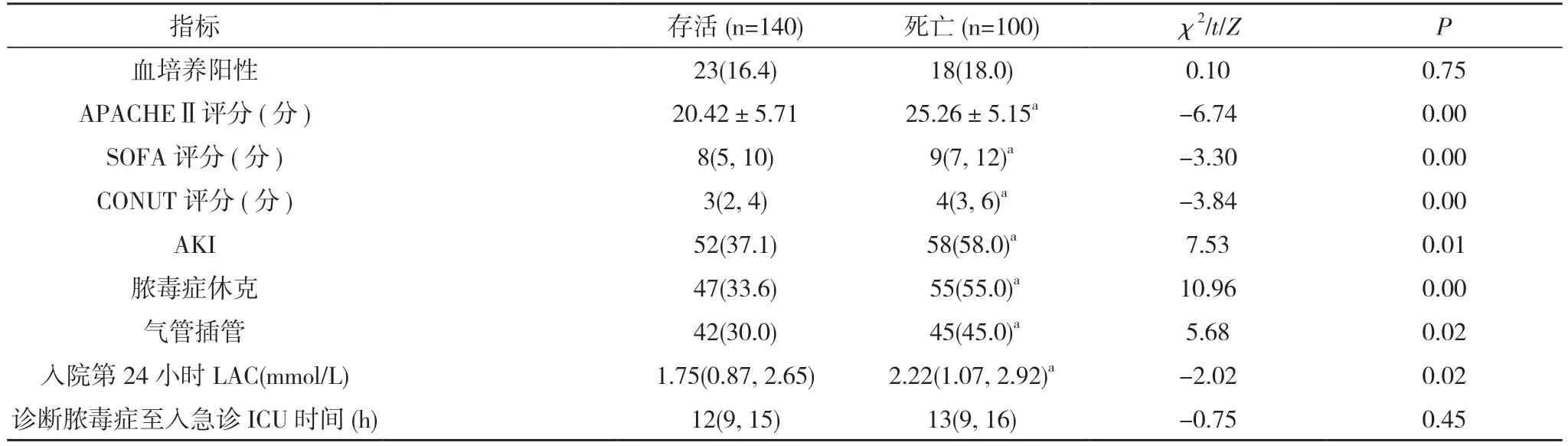
续表1
3 讨论
老年患者脓毒症发生率高、病死率高,医疗负担重,且幸存者的生活质量也低于年轻人,所以早期识别、准确评估病情、积极干预十分必要。本研究发现老年脓毒症患者随着年龄增长,脓毒症的死亡风险也有所提升。老年脓毒症的最常见的来源是呼吸道感染,其次为泌尿系统感染[3,4]。
对于脓毒症患者,常采用SOFA 评分加强对器官功能状态的监测和病情严重程度的评估[5],可以为脓毒症的治疗决策提供依据。本研究中单因素分析结果显示死亡患者SOFA 评分明显高于存活患者,差异有统计学意义(P<0.05);将SOFA 评分纳入多因素Logistic 回归模型分析结果显示,SOFA 评分高是脓毒症患者28 d 死亡的预测因素;APACHEⅡ评分包括急性生理(APS)评分、年龄评分及慢性健康(CPS)评分,数据均为入ICU 最初24 h 内的最差值,是危重患者预后不良的有利预测工具,本研究的单因素及多因素分析结果均显示APACHEⅡ评分高为脓毒症28 d 死亡率高的预测因素。肾脏是脓毒症出现器官功能障碍最常累及的脏器之一,据报道,脓毒症和脓毒症休克的患者中40%~78%可出现AKI,伴有AKI 的脓毒症患者死亡率高达70%[6],本研究AKI 单因素及多因素分析结果,均提示不良预后。
本研究还关注入院CONUT 评分对于脓毒症老年患者短期预后的预测效果,通过单因素分析及多因素分析,均提示差异有统计学意义,入院CONUT 评分高提示短期死亡率增加,分析其可能机制如下:CONUT评分通过总胆固醇、血清白蛋白和总淋巴细胞计数进行营养评价。血清白蛋白是临床常用的营养指标,可能受到非营养因素如肝功能储备和炎症的影响。脓毒症时,血清白蛋白减少可能机制为:①白蛋白分解代谢增快;②单核-巨噬系统、中性粒细胞和内皮细胞过度激活产生肿瘤坏死因子、白介素-1(IL-1)、内毒素、白介素-6(IL-6)等大量炎性介质,作用于肝细胞可抑制ALB-mRNA 表达;③大量炎性介质释放入血可损伤毛细血管内皮,增加血管通透性,致使毛细血管渗漏,白蛋白丢失增加。因此,CONUT 评分高提示脓毒症患者预后差的潜在机制可能在于低于基线水平的血清白蛋白。
细菌感染时通常会导致淋巴细胞计数下降,其可能机制在于:①感染应激刺激机体释放大量儿茶酚胺类物质和皮质醇激素,促进淋巴细胞凋亡[7];②老年群体胸腺退化,当面对全身性细菌感染时,胸腺退化导致CD4 和CD8 淋巴细胞的产生减少,免疫细胞不断从造血干细胞中更新,在老年受试者中,免疫细胞的增殖能力和数量由于端粒的进行性缩短而减少[8];③据报道,老年人群血浆IL-6、IL-1 和肿瘤坏死因子水平升高,这代表了免疫系统的持续刺激状态,是一种持续的亚临床炎症状态,这种炎性细胞微环境也会导致细胞分化和抗原提呈细胞行为的改变,这种持续的炎症可能导致T 淋巴细胞衰竭[9]。
总胆固醇下降对脓毒症预后不良的机制可能为:在脓毒症期间,脂多糖(LPS)和其他病原脂质被隔离在高密度脂蛋白、低密度脂蛋白和极低密度脂蛋白中,通过有效封闭以阻断其激活炎性因子的功能[10],然后通过肝脏的受体如低密度脂蛋白受体和高密度脂蛋白受体SR-BI 从循环中清除。高密度脂蛋白对脂多糖和革兰阳性毒素脂磷壁酸有很高的亲和力,有助于降低它们触发先天免疫反应的能力。胆固醇下降可导致炎性反应失控并加重组织损伤,进一步影响病情而出现恶化。
综上所述,CONUT 评分实际上是一个营养-免疫标志物,营养状态差会改变免疫力,并可能导致感染易感性的增加,增加脓毒症的发生率,产生严重的感染后遗症。有研究显示在营养不良人群中观察到的与氧化还原状态和三磷酸腺苷(ATP)降解产物升高相关代谢物的改变,可能是营养不良危重患者细胞毒性增加的证据[11]。由于线粒体基因组中的DNA 对氧化损伤非常敏感,在营养不良的情况下,细胞毒性的增加可能导致更多的细胞质线粒体DNA 的释放。循环的线粒体DNA 被认为是损伤相关因子,是炎症反应和终末器官功能障碍的重要驱动因素[12]。另据报道,营养不良与肌肉功能受损、骨量减少、免疫功能障碍、贫血、认知功能下降、伤口愈合不良有关[13]。提示脓毒症患者早期营养评估和适当干预的重要性。本研究通过CONUT 评分间接评估机体的营养状况和免疫状态,从而达到预测脓毒症患者预后的目的。
除APACHEⅡ评分、年龄、SOFA 评分、AKI 发生率等是预测入院老年脓毒症患者的预后指标外,CONUT 评分也是预测老年脓毒症预后的一个实用指标,营养不良对老年脓毒症患者预后产生负面影响可能包括免疫改变、炎症通路等多方面因素。本研究的局限性在于,这是一项医院进行的单中心回顾性研究,样本量较少,且未记录诊疗过程中营养干预情况,这些限制可能会影响结果[14],后续需要进一步扩大样本量及采用前瞻性研究继续证实,并研究相关预后评分截断点。

