不同氮磷比对球形棕囊藻释放含硫化合物及DMSP降解途径的影响❋
涂俊杰,高配配,刘春颖,李培峰❋❋,杨桂朋
(1.中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重实验室,山东 青岛 266100;2.青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237)
二甲基硫(Dimethylsulfide,DMS)是从海洋释放到大气中最重要的挥发性生源含硫有机物[1-3]。浮游植物产生的DMS释放到大气中,被氧化成为二氧化硫和甲基磺酸盐,形成硫酸盐气溶胶,增加云凝结核数量,进而影响云层对太阳光的反照率,对气候变化起负反馈作用,在全球气候变化中扮演了重要角色。同时,硫酸盐气溶胶对酸雨、酸雾的形成具有重要贡献[4]。二甲巯基丙酸内盐(Dimethylsulfoniopropionate,DMSP)是DMS的主要前体物质[5],海洋中浮游微藻、大型藻类和盐生植物都是DMSP的重要来源,但DMSP含量具有明显的种间或株间差异性[6-7]。在高盐缺氮条件下DMSP可作为藻类维持自身渗透压平衡的调节剂,在低温下DMSP具有抗冷冻作用,用于维持生物酶活性,与藻类生理胁迫有直接关系[8-10]。丙烯酸(Acrylic acid,AA)是DMSP的降解产物之一,DMSP可以通过裂解酶催化产生等摩尔的DMS和AA,还可以通过去甲基化途径产生甲基硫醇盐(3-methiolpropionate,MMPA),MMPA再转化为甲硫醇和AA[11]。DMS/AA代表DSMP酶裂解途径占两种降解途径的比例,DMS/(DMSP+AA)代表DMS生产百分比,AA/(DMSP+AA)代表总DMSP的降解率。AA可作为细菌的主要碳源[12],但在AA浓度较高时又可抑制细菌生长[13]。Yang等[14]发现夏季南极沿海棕囊藻暴发现场的AA浓度为0.001~0.510 μmol·L-1,与藻细胞密度呈现显著的相关性。Gibson等[15]在南极浮游植物藻华期间测定表层海水AA浓度可以达到1.2 μmol·L-1。AA降解去除主要通过两种途径:微生物降解[16]和光化学氧化[17]。海洋环境中物理和化学因素,如温度、盐度、光照、微量元素和营养盐等,都会对藻类生成DMSP、DMS和AA产生影响[18-21],但目前没有一致的定论。
球形棕囊藻(Phaeocystisglobosa)隶属于定鞭藻门,是一种具有独特形态和生态学特征广泛分布于全球海洋的赤潮藻。该藻种是DMS和DMSP的高产藻种[22-25]。特别是在大规模球形棕囊藻藻华暴发的后期,会释放高浓度的DMS和DMSP到环境中[22]。目前,对海洋中DMS分布与海-气通量的研究较多[26-27],而对球形棕囊藻藻华发生现场的DMS与DMSP通量研究较少。齐雨藻等[23]研究发现渤海海域球形棕囊藻藻华暴发现场DMSP浓度可达到354~471 nmol·L-1,DMS浓度在34~60 nmol·L-1之间,远高于非藻华发生期间的DMS浓度(1.3~3.4 nmol·L-1)[28],藻华发生期间的DMS浓度可达到非藻华期间的10~100倍[29]。Noordkamp等[30]发现球形棕囊藻体内的AA浓度高达1.3~6.5 μmol·L-1,原因在于高浓度的AA吸附在粘液层上从而影响其扩散。到目前为止,有关球形棕囊藻释放生源硫化物的影响因素报道甚少。
在藻类的硫酸盐同化还原释放含硫化合物的过程中,营养盐对藻类的光合作用有重要的影响。目前,对海洋大型藻类的研究较多[31-35],而对浮游微藻研究较少。Li等[31]研究发现高氮高磷促进了浒苔对海水中溶解无机碳(DIC)的吸收同时导致海水pH的升高,对DIC吸收量达0.70 mmol·L-1,pH提升量为1.43。林庆莹等[32]研究发现氮磷加富会促进瓦氏马尾藻光合固碳能力,降低海水中DIC的浓度,提升海水pH。本论文以球形棕囊藻为研究对象,探究营养盐对典型赤潮藻光合作用、生长状况、释放生源硫化物以及DMSP降解途径的影响,从而为完善海洋硫循环的研究提供参考数据。
1 材料与方法
1.1 实验方案
球形棕囊藻藻种取自于中国海洋大学海洋污染与生态化学实验室。培养所用海水采自于中国东海(盐度为32),经0.45 μm醋酸纤维滤膜过滤,装入2 L的锥形瓶中,并在121 ℃下高压灭菌(高压灭菌锅,LDZX-50KBS,上海申安医疗器械厂)20 min,静置冷却至室温后充分摇动以恢复溶解气体含量。按照f/2配方[36]加入相应的营养物质,放置于光照培养箱(GXZ-380B,宁波江南仪器厂)中静置培养。光暗比为12 h∶12 h,温度为20 ℃,光照强度为6 000 Lux。为防止微藻沉淀以及保持藻液中的溶解气体含量,每天充分摇晃培养瓶3~6次。进行预培养后取生长状况良好的处于指数生长期的200 mL藻液以1∶10的比例接入预先配好的培养基中。培养基中氮磷比的设置以Redfield比值为基础,设置硝氮浓度为883 μmol·L-1,调整培养液中的磷酸盐浓度,使得氮磷比分别为4∶1、16∶1、40∶1和80∶1。
取样分析:连续培养20 d,隔天定时(上午9:00)取样,每组实验设三个平行样[37-38]。测定培养液的pH值、DIC浓度、球形棕囊藻细胞密度以及DMS、DMSP和AA的含量。
1.2 测定方法
pH的测定 利用Fisher-AR15 pH计和Ross-8102 pH电极对藻液pH(NBS标度)进行测定,仪器的精度为:±0.002,并根据温度进行校正。
DIC的测定 采用溶解无机碳分析仪(AS-C2型,美国Apollo科技公司)进行测定,再根据美国Scripps海洋研究所生产的CRMs标准海水进行标定,精密度为0.1%。
藻细胞密度的测定 取5 mL藻液摇匀,用Lugol试剂对藻细胞固定、染色,然后用光学显微镜(CX31,日本Olympus公司)进行计数,每个样品做三个平行样,取其平均值换算为相应的藻细胞密度(藻细胞密度=藻细胞数目×104cells·mL-1)[39]。
DMS的测定 用无菌注射器取2 mL藻液于洁净干燥的10 mL血清瓶中加盖密封。用高纯氮气对样品进行吹扫,定时3 min,样品中的DMS被吹出后经Nafion干燥管进行干燥,然后于浸没在液氮冷阱中的捕集管中富集。吹扫结束后,把捕集管取出迅速放入热水浴(温度>80℃)中进行加热解析,使得载气将捕集管中的DMS气体携带进入气相色谱仪(GC-6850,美国安捷伦公司),经FPD检测器进行检测[40]。此方法的检出限为0.4 nmol·L-1,精密度为5%[41]。
DMSP的测定 DMSP在pH>13的强碱条件下按1∶1的比例完全裂解为DMS和AA,所以可通过测定DMS的浓度间接测定藻液中的DMSP的浓度[42]。取2 mL的藻液,经玻璃纤维滤膜(Whatman GF/F,0.7 μm)减压过滤(压力<5 kPa),过滤后的滤膜用于颗粒态DMSP(DMSPp)的测定,滤液用于溶解态DMSP(DMSPd)的测定。将滤膜置于42 mL的棕色瓶中,向瓶内加入2 mL 10 mol·L-1的NaOH溶液,加高纯水至无顶空,并置于冰箱冷藏保存24 h以上;在含有滤液的棕色瓶中加入40 μL 50%的浓硫酸冷藏保存24 h后,向瓶中加入2 mL 10 mol·L-1的NaOH溶液,加高纯水至无顶空,冷藏保存24 h后,此时DMSP完全碱解为DMS,然后根据测定DMS的方法间接测定藻液中的DMSPp和DMSPd。
AA的测定 将藻液经孔径为0.2 μm的聚醚砜滤器过滤,密封冷藏保存。用高效液相色谱仪(L-2000,日本日立公司)测定[43],流动相为0.35%的磷酸溶液和甲醇,采用流速为0.5 mL·min-1的微量进样针,通过柱温为40 ℃的Agilent SB-Aq-C18柱,用检测波长为210 nm的紫外检测器进行检测。此方法的检出限为4 nmol·L-1,精密度为1.3%~1.6%[44]。
1.3 统计分析
采用SPSS 16.0软件中无重复双因素方差分析法对不同氮磷比条件下的藻细胞密度、DMSP、DMS和AA含量进行显著性差异分析。
2 结果与讨论
2.1 不同氮磷比培养液对球形棕囊藻光合作用的影响
通过分析稳定期前(0~8 d)球形棕囊藻培养液的DIC和pH变化,探讨不同氮磷比对球形棕囊藻光合作用的影响。DIC和pH相邻两次取样的差值记为ΔDIC和ΔpH。培养体系初始DIC是2 100 μmol·kg-1,pH是8.10。除80∶1组外,各组ΔDIC均呈现先上升后下降的趋势(见图1)。而各组在2~8 d内ΔpH总体呈现上升的趋势(见图2)。各组单位时间DIC吸收量由大到小依次为:80∶1(147 μmol·kg-1·d-1)>16∶1(60 μmol·kg-1·d-1)>40∶1(57 μmol·kg-1·d-1)>4∶1(54 μmol·kg-1·d-1),而单位时间pH提升量由大到小依次为:4∶1(0.13 d-1)>40∶1/80∶1(0.08 d-1)>16∶1(0.06 d-1)。不同培养组之间,随氮磷比增加单位时间DIC吸收量呈现不同程度的增加(1.11倍;1.06倍;2.72倍);而单位时间pH提升量呈现不同程度的减少(53.8%;38.5%;38.5%)。氮和磷作为重要的营养成分,对藻类的生理生化过程起着重要作用。适当增加营养盐的浓度可以促进藻类对DIC的吸收,提升海水的pH,这与国内外的研究报道是一致的。已有大量研究发现,氮磷浓度增加对石莼[34-35]、龙须菜、孔石莼、海带[45]以及浒苔[46]等的生长和光合固碳能力具有促进作用,而氮加富的促进能力强于磷,会提高藻类的最大光合作用速率,从而增强其对DIC的吸收能力。
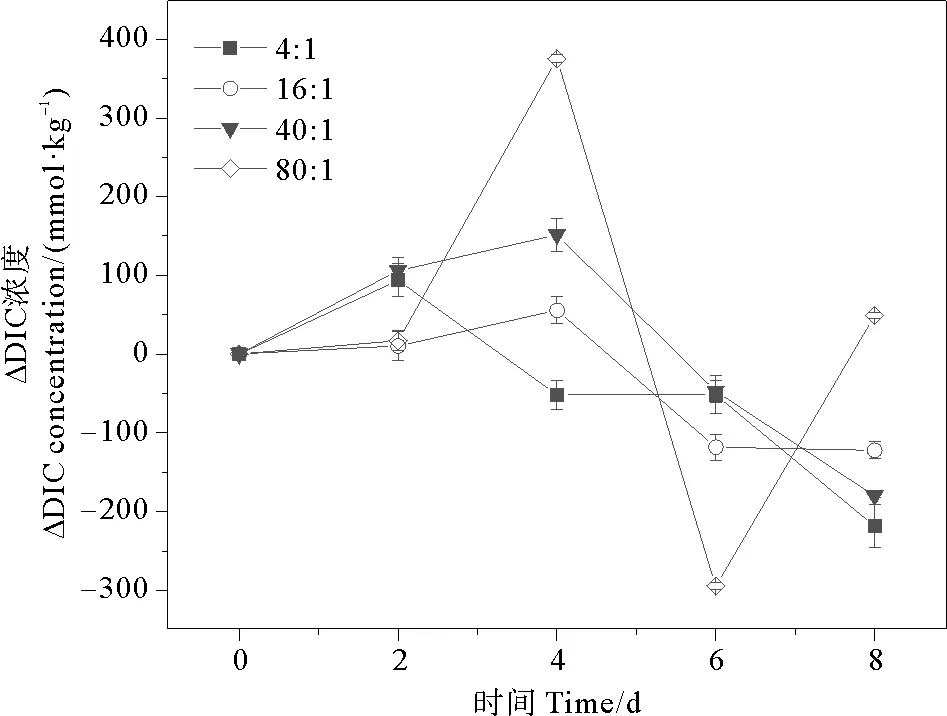
图1 不同氮磷比条件下球形棕囊藻的ΔDIC变化
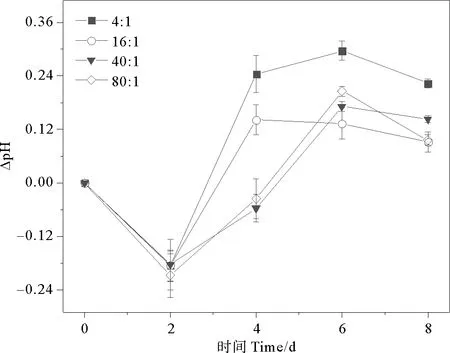
图2 不同氮磷比条件下球形棕囊藻的ΔpH变化
2.2 不同氮磷比对球形棕囊藻生长状况的影响
在氮磷比为4∶1、16∶1、40∶1和80∶1条件下,球形棕囊藻的细胞密度总体变化范围为(60~285)×104cells·mL-1。各组藻细胞密度平均值分别为(138±48、201±74、187±72和156±55)×104cells·mL-1。随培养时间的增加,藻细胞密度呈现出先升高后降低的变化趋势(见图3)。四组氮磷比之间存在有明显差异(P<0.05)。当氮磷比为16∶1和40∶1时,细胞密度达到峰值的时间相对延长,分别为第10和16天,其峰值分别为285×104和264×104cells·mL-1,大于其余两组。当氮磷比为4∶1和80∶1时,藻细胞密度峰值相对较低,这可能是由于氮和磷浓度过低降低藻细胞的光合作用能力,阻碍藻细胞内谷氨酸、半胱氨酸络合形成螯合物的过程[47],从而影响藻类生长。当氮磷比为40∶1时,藻细胞密度在衰亡期降低幅度较大,这与朱蓉等[37]的研究结果一致,在超过最适宜的氮磷比(16∶1)后,过量吸收氮不利于藻细胞的生长[48]。
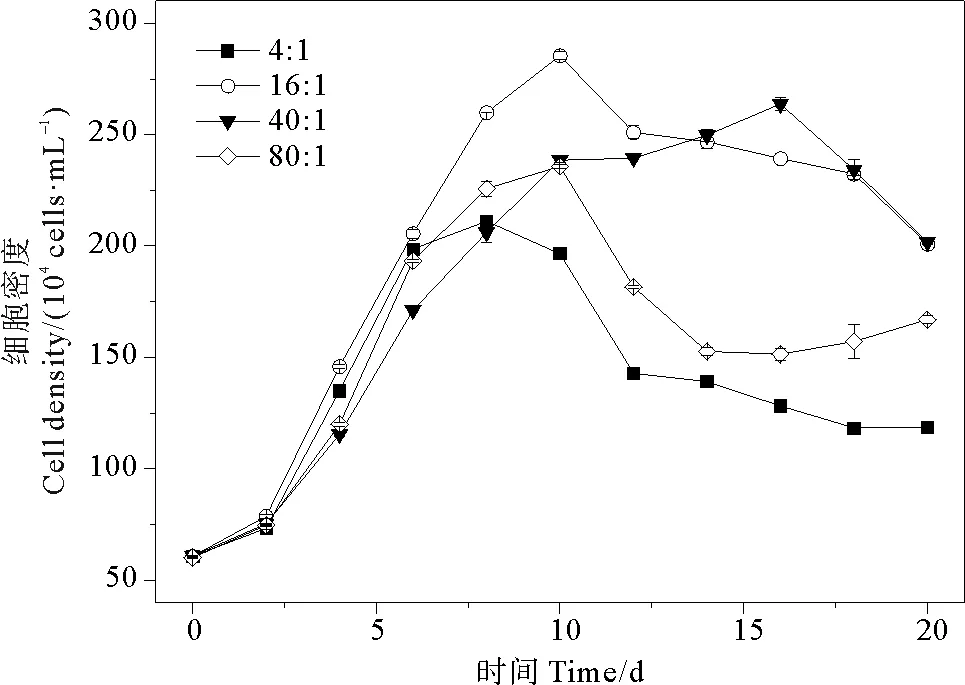
图3 不同氮磷比条件下球形棕囊藻的细胞密度变化
2.3 不同氮磷比对球形棕囊藻释放生源硫化物的影响
2.3.1 DMSPd 培养液中单位细胞DMSPd浓度的变化范围为0.034~0.543 fmol·cell-1。氮磷比为4∶1、16∶1、40∶1和80∶1条件下DMSPd的平均值分别为(0.235±0.133)、(0.165±0.158)、(0.128±0.150)和(0.148±0.101)fmol·cell-1,组间无明显差异(P>0.05)。DMSPd浓度变化的趋势为先稳定在较低值,后迅速增加至峰值,再降低至较低值,生长后期再升高(见图4)。DMSPd浓度的峰值出现在指数生长期或稳定期。DMSPd浓度增加的原因可能是在指数生长期细胞活性强,光合作用产生的DMSPd释放到水体中;在生长后期细胞破裂,释放出储存在胞内的DMSP。不同氮磷比条件下,球形棕囊藻的单位细胞DMSPd浓度达到峰值的时间不同。当氮磷比为4∶1、16∶1、40∶1和80∶1时,分别在第8、8、6和12天达到最大值,最大值分别为0.480、0.421、0.543和0.348 fmol·cell-1。藻细胞培养液中的DMSPd主要由于细胞内的DMSP的自然渗透或细胞衰老分解而得到,所以DMSPd的变化主要取决于细胞内DMSP的生产能力[49]。
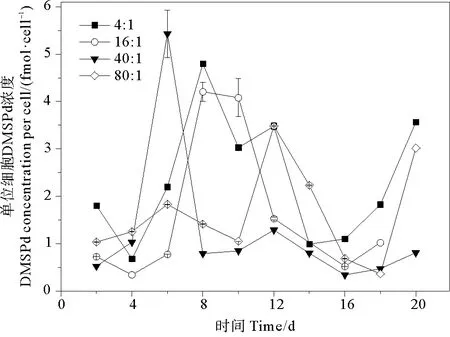
图4 不同氮磷比条件下球形棕囊藻单位细胞DMSPd浓度的变化
2.3.2 DMSPp 培养液中单位细胞DMSPp的变化范围为0.393~2.741 fmol·cell-1。氮磷比为4∶1、16∶1、40∶1和80∶1条件下DMSPd的平均值分别为(1.515±0.559)、(1.515±0.680)、(1.347±0.516)、(1.367±0.596)fmol·cell-1,组间无明显差异(P>0.05)。相比于DMSPd,DMSPp与球形棕囊藻细胞密度变化趋势更相近,都是先升高后降低,生长期后期小幅升高(见图5)。DMSPp浓度的峰值出现在指数生长期后期或稳定期。当氮磷比为16∶1时,DMSPp在第12天出现峰值2.741 fmol·cell-1,明显高于其他氮磷比条件下DMSPp的最大值。这说明磷和氮需要满足一定比例才会促进细胞产生DMSPp,在本研究中当氮磷比为16∶1时会最大程度产生DMSPp。在DMSPp合成过程中,球形棕囊藻细胞生长对磷需求较高,磷直接参与光合作用的各个环节,包括光能吸收与碳同化、卡尔文循环以及对一些酶的活性调节等[50]。
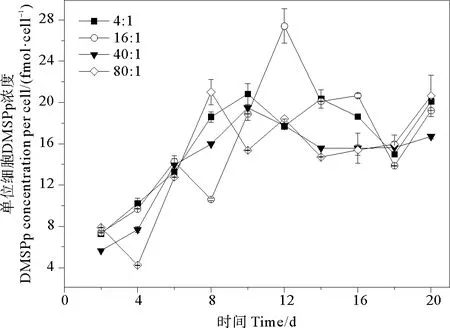
图5 不同氮磷比条件下球形棕囊藻单位细胞DMSPp浓度的变化
2.3.3 DMS 培养液中单位细胞DMS浓度的变化范围为0~0.038 fmol·cell-1。氮磷比为4∶1、16∶1、40∶1和80∶1条件下DMS的平均值分别为(0.016±0.013)、(0.013±0.015)、(0.018±0.017)、(0.013±0.012)fmol·cell-1,组间无明显差异(P>0.05)。在生长早期单位细胞释放的DMS很少,在指数生长期后期迅速增加,稳定期或衰亡期前期达到峰值后又迅速减少(见图6)。不同氮磷比条件下,DMS的最大值均出现在稳定期(第14天),最大值分别为0.034、0.038、0.038和0.033 fmol·cell-1。氮磷比16∶1组和40∶1组的DMS浓度峰值较高,而这两组的藻细胞密度也比另外两组高,说明球形棕囊藻DMS释放与藻类生长状况有关。DMS释放量在不同生长时期内的变化趋势同时会受到DMSP浓度和DMSP裂解酶活性的影响,而DMSP裂解酶活性与藻细胞密度存在高度的相关性[51]。在稳定期和衰亡期前期,藻细胞密度达到峰值,细胞死亡破裂释放DMSP裂解酶裂解DMSP,使其转化为DMS从而导致DMS释放量增加[52]。
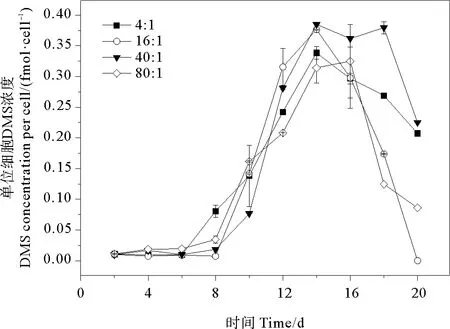
图6 不同氮磷比条件下球形棕囊藻单位细胞DMS变化
2.3.4 AA 培养液中单位细胞AA浓度的变化范围为0.150~2.949 fmol·cell-1。氮磷比为4∶1、16∶1、40∶1和80∶1条件下AA的平均值分别为(1.053±0.567)、(1.840±0.842)、(1.771±0.247)、(1.368±0.842)fmol·cell-1,组间存在有明显差异(P<0.05)。AA呈现出先升高再降低又升高,衰亡期再降低的趋势(见图7)。通常情况下,藻类释放AA的浓度在生长后期达到最大值[19]。Yang等[16]调查发现球形棕囊藻藻华初期水体内含AA,但进入衰亡期后迅速降低至检出限以下。Davidson等[53]研究发现细菌会侵入衰亡期的微藻,仅在指数生长期的水体内检出AA。然而Noordkamp等[12]在无菌环境下培养球形棕囊藻,发现在衰亡期AA产生速率增加,藻细胞内AA浓度高于培养液,表明球形棕囊藻在衰亡期没有检出AA是由于细菌消耗而不是没有产生。球形棕囊藻单位细胞释放的AA对不同氮磷比变化较为敏感。本研究中当氮磷比为4∶1、16∶1时释放的AA含量均在稳定期达到最大值,原因在于藻细胞破裂释放DMSP裂解酶,引起DMSP大量裂解,导致AA浓度增加。另外,细胞内AA会被吸附在藻细胞内部的粘液层,当细胞破裂AA释放到培养液中,AA浓度随之增加。当氮磷比为16∶1时,AA释放量在第12天达到最大值2.949 fmol·cell-1,与Gibson等[17]测定的夏季南极洲球形棕囊藻AA含量(9.76 fmol·cell-1)为同一数量级。当氮磷比为4∶1和16∶1时,AA释放量整体上随着氮磷比的升高而升高。当氮磷比为40∶1时,AA在整个生长周期内波动较小。而当氮磷比为80∶1时,AA浓度比16∶1和40∶1组小。这是由于磷浓度过低,影响了微藻的光合作用[12],从而抑制了AA的产生。由氮磷比和球形棕囊藻单位细胞AA浓度的关系可看出,当氮磷比小于16∶1时,两者成正比关系;当氮磷比大于16∶1时,两者不存在线性关系。
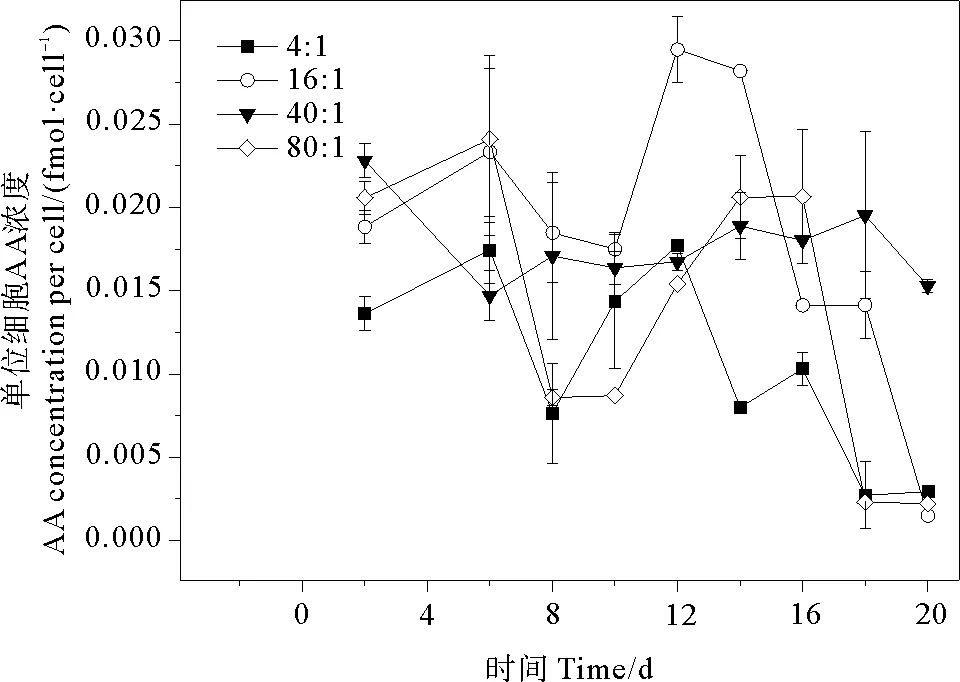
图7 不同氮磷比条件下球形棕囊藻的单位细胞AA变化
2.4 不同氮磷比对球形棕囊藻DMSP降解途径的影响
2.4.1 DMS/AA 由DMSP两种降解途径可知,DMS/AA表示为DMSP酶裂解途径占两种降解途径中的比例。DMS/AA的总体变化范围为0.51%~26.53%。氮磷比为4∶1、16∶1、40∶1和80∶1条件下AA/(DMSP+AA)比值分别为0.82%~26.53%、0.51%~20.46%、1.01%~21.25%、0.80%~21.10%,平均值分别为(9.97±7.94)%、(8.21±7.21)%、(9.66±7.82)%、(10.58±7.77)%。球形棕囊藻的DMS/AA在指数生长期呈现上升趋势,稳定期达到峰值,在衰亡期下降,与藻类生长曲线相似(见图8)。当氮磷比为4∶1和16∶1时,DMS/AA比值的最大值出现在第16天,分别为26.53%和20.46%。当氮磷比为40∶1和80∶1时,DMS/AA比值的最大值较另外两组提前(第14天),且出现两个峰值。在整个生长周期中,DMSP降解途径各不相同,指数生长期前期DMS/AA较小,DMSP的去甲基化途径为主要途径。随着藻细胞密度增加,DMSP酶裂解途径也增加。在稳定期和衰亡期前期,细胞死亡破裂释放裂解酶,DMSP酶裂解途径达到最大但仍不是主要的降解途径,此时DMS/AA达到峰值。Liu等[54]研究发现,海洋原甲藻、大洋桥石藻和亚心形扁藻的DMS/AA比值在整个生长期中均小于25%,表明DMS的酶裂解途径不是DMSP的主要降解途径。
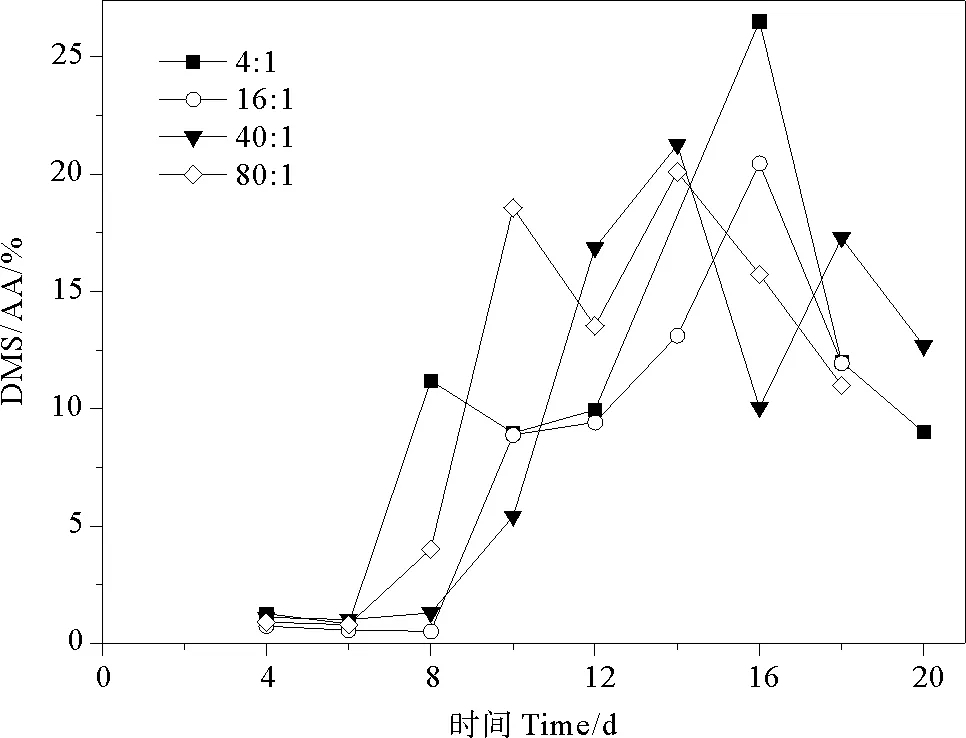
图8 不同氮磷比条件下球形棕囊藻的DMS/AA变化
2.4.2 DMS/(DMSP+AA) DMS代表DMSP通过酶裂解方式的含量,(DMSP+AA)代表DMSP已裂解和未裂解含量的总和,因而DMS/(DMSP+AA)表示为酶裂解途径产生DMS所占百分比。DMS/(DMSP+AA)的总体变化范围为0.25%~11.89%。氮磷比为4∶1、16∶1、40∶1和80∶1条件下AA/(DMSP+AA)比值分别为0.36%~8.13%、0.25%~8.95%、0.34%~11.16%、0.41%~11.89%,平均值分别为(3.43±2.96)%、(4.10±3.57)%、(5.14±4.24)%、(5.05±4.67)%。球形棕囊藻的DMS/(DMSP+AA)在指数生长期前期稳定在低值后期迅速上升,稳定期达到峰值,在衰亡期下降,与DMS变化曲线相似(见图9)。当氮磷比为40∶1和80∶1时,第8~14天DMS/(DMSP+AA)比值迅速增加至峰值(0.60%~11.16%、0.99%~11.89%),其他两组变化相似但幅度较小。由于受到DMSP浓度和DMSP裂解酶活性的影响,DMS产生所占百分比在不同生长时期内的变化与藻细胞密度密切相关[51]。Tan等[55]研究夏季长江口及邻近海域时发现,该地区DMS/(DMSP+AA)的平均比值小于20%,说明DMS产生过程是DMSP降解的次要途径,与本研究结果一致。
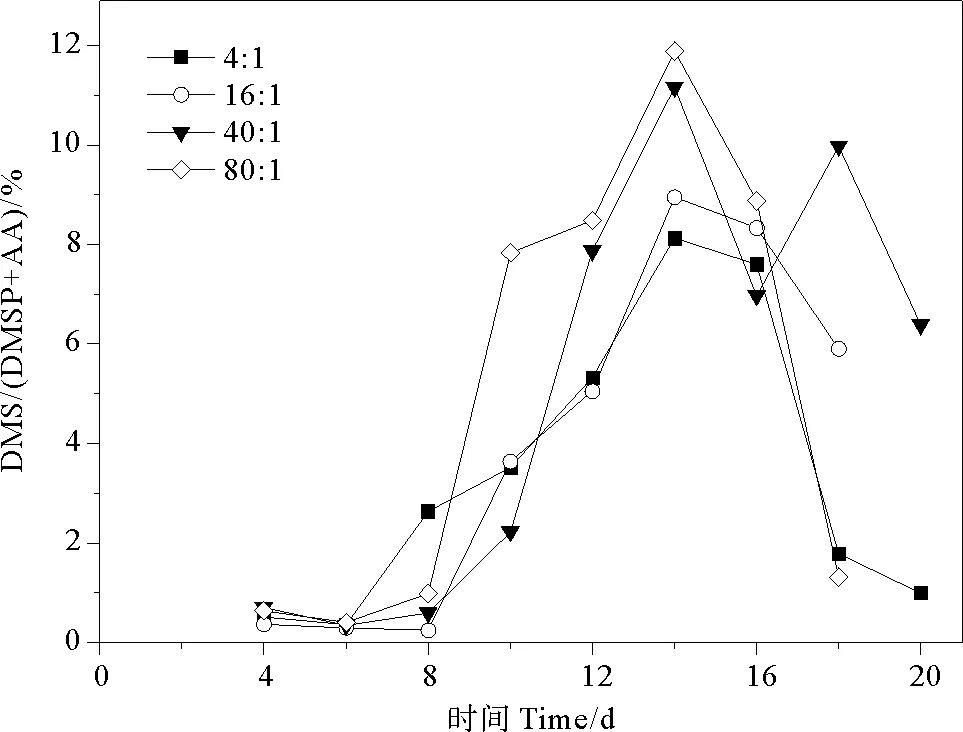
图9 不同氮磷比条件下球形棕囊藻的DMS/(DMSP+AA)变化
2.4.3 AA/(DMSP+AA) AA代表DMSP通过两种降解途径的含量,AA/(DMSP+AA)表示为DMSP表观降解百分比。AA/(DMSP+AA)的总体变化范围为6.02%~70.04%。氮磷比为4∶1、16∶1、40∶1和80∶1条件下AA/(DMSP+AA)比值分别为11.03%~53.50%、6.02%~68.19%、33.87%~69.34%、8.10%~70.04%,平均值分别为(32.22±13.95)%、(45.71±16.91)%、(51.15±11.00)%、(42.86±22.73)%。球形棕囊藻的AA/(DMSP+AA)在指数生长期前期先下降,再升高至稳定期达到峰值,后在衰亡期下降(见图10)。当氮磷比为16∶1和40∶1时,DMSP降解百分数较高。当氮磷比为16∶1和40∶1时,AA/(DMSP+AA)比值的最大值出现在第14和16天,分别为68.19%和69.34%。当氮磷比为4∶1和80∶1时,AA/(DMSP+AA)的最大值较另外两组提前(第12天),且峰值较小(53.50%和62.64%)。不同氮磷比可能对酶的活性和含量以及初始DMSP浓度产生影响,从而导致DMSP表观降解百分比的不同。Liu等[56]研究冬季黄渤海海域时发现,该区域AA/(DMSP-AA)平均比值为53.98%,与氮磷比为40∶1组结果接近。

图10 不同氮磷比条件下球形棕囊藻的AA/(DMSP+AA)变化
3 结语
不同氮磷比对球形棕囊藻光合作用、生长状况、释放生源硫化物以及DMSP降解途径会产生影响。氮磷比为80∶1时,培养液中单位时间DIC吸收量最大(147 μmol·kg-1·d-1);而氮磷比为4∶1时,单位时间pH提升量最大(0.13 d-1)。氮磷比为16∶1和40∶1时,最大藻细胞密度较高(285×104和264×104cells·mL-1),且稳定生长期相对延长。氮磷比为40∶1时,培养液中单位细胞DMSPd和DMS浓度达到峰值(0.543和0.038 fmol·cell-1);氮磷比为16∶1时,DMSPp、DMS和AA浓度达到峰值(2.741、0.038和2.949 fmol·cell-1)。氮磷比为4∶1时,DMS/AA达到峰值26.53%,DMSP酶裂解途径占比最大。氮磷比为80∶1时,DMS/(DMSP+AA)达到峰值11.89%,DMS生产百分比最大。氮磷比为40∶1时,AA/(DMSP+AA)达到峰值69.34%,总DMSP降解率最大。总体而言,16∶1是球形棕囊藻释放含硫化合物的最佳氮磷比值,不同氮磷比条件会影响DMSP降解途径。

