饲粮支链氨基酸比例对28~63日龄攸县麻鸭肠道菌群的影响
孙 悦,戴求仲,蒋桂韬,黄 璇,李 闯,邓 萍,孙 涛
(1. 广西师范大学 生命科学学院,广西 桂林 541006;2.湖南省畜牧兽医研究所,湖南 长沙 410131; 3. 珍稀濒危动植物生态与环境保护教育部重点实验室(广西师范大学),广西 桂林 541006,4. 湖南省家禽安全生产工程技术研究中心, 湖南 长沙 410128)
肠道是动物体内的消化器官和最大免疫器官,在维持正常营养代谢、免疫防御等方面发挥着重要作用[1-2]。动物肠道中共生着一个庞大而复杂的微生物群落,主要是细菌、古细菌、真菌等,这些微生物与宿主协同进化,互相依存,对保障宿主机体稳态和健康方面发挥着重要作用[3-5]。饲粮类型及其粗纤维、碳水化合物、蛋白质等营养素可调节肠道微生物菌群的组成[6],但目前关于饲粮成分对肠道菌群影响的研究主要集中在粗纤维、粗蛋白质水平等方面,饲粮氨基酸成分及水平对肠道菌群影响的研究较少。研究表明,饲粮中氨基酸含量增加对肠道健康具有调节作用,可减少肠黏膜萎缩[7],维持肠道微生物菌群平衡[8]。
支链氨基酸(BCAAs)在动物体内不能合成,主要通过饲料或人工添加来满足动物生长需要[9]。BCAAs具有营养机体、提高机体免疫力、调节蛋白质合成和分解、调节母畜泌乳、调节激素和物质代谢等多种重要的生物学功能[10-13]。研究发现,饲粮中添加BCAAs对于维持猪、小鼠、鸡及鱼类的肠道健康具有重要意义[10,14-17],主要通过促进肠道发育以及提高肠道免疫等实现,但BCAAs在鸭饲料中的应用研究较少,尤其对鸭肠道菌群是否存在影响尚不清楚。本研究以28~63日龄攸县麻鸭作为研究对象,探讨不同比例BCAAs饲粮对其盲肠微生物多样性的影响,以期为鸭的肠道健康研究提供理论依据。
1 材料与方法
1.1 试验材料
攸县麻鸭购于湖南衡东绿然家禽饲养合作社,BCAAs中Leu、Ile、Val均为分析纯。试验饲粮参照地方标准《临武鸭营养需要》(DB43/T 898—2014)配制,饲粮中亮氨酸(Leu)、缬氨酸(Val)、异亮氨酸(Ile)按质量比m(Leu)∶m(Val)∶m(Ile)分为1∶0.4∶0.3(MA组)、1∶0.5∶0.4(MB组)、1∶0.6∶0.5(MC组)、1∶0.7∶0.6(MD组)、1∶0.8∶0.7(ME组)和1∶0.9∶0.8(MF组)共6组,其中BCAAs总营养水平基本保持一致,以Leu为1来设置与调节三者的含量,其他营养水平各组基本一致,配方组成和营养成分见表1。
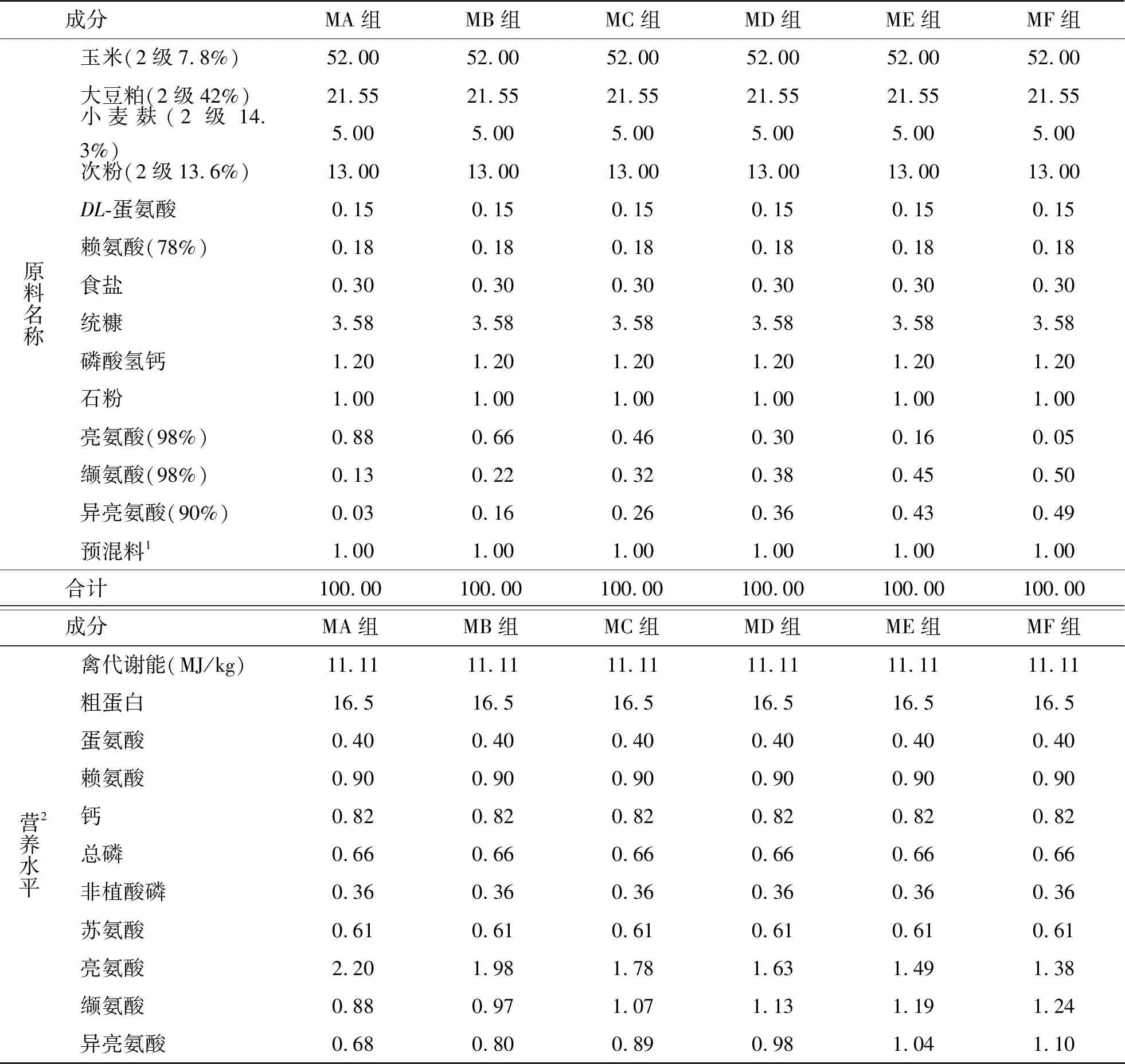
表1 饲料配方及主要成分表(风干基础)
1.2 试验方法
1.2.1 试验设计与饲养管理
选用28日龄健康、体质量相近(587.96±4.44) g(P>0.05)的攸县麻鸭公鸭504羽,随机分成6个处理(每处理饲喂1种试验饲粮),每处理6个重复,每重复14羽试鸭,试验全期35 d。试验在湖南省畜牧兽医研究所试验鸭场进行。试鸭采用网上平养,自由采食与饮水,常规免疫,定期消毒,饲养规程按常规操作进行。
1.2.2 样品采集
试验结束后称量,试鸭末质量(1 222.13±62.39) g(P>0.05)。从每重复中选取1羽接近该处理平均体质量的试鸭进行屠宰,在无菌操作条件下采集盲肠内容物分装于灭菌EP管后,迅速置于液氮中速冻,-80 ℃保存。
1.2.3 高通量测序
1.2.3.1 样品DNA提取
利用DNA提取试剂盒(Qiagen,德国)提取盲肠内容物总DNA,具体操作步骤参照试剂盒说明书进行。采用DS-11型超微量分光光度计和1%琼脂糖凝胶电泳检测 DNA 的浓度和纯度,-80 ℃保存。
1.2.3.2 建库测序
提取样品总DNA后,根据16S rDNA V3~V4 区设计得到引物(338F:5'-ACTCCTACGGGAGGCAGCA-3';806R:5'-GGACTACHVGGGTWTCTAAT-3'),在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化,形成测序文库。建好的文库先进行质检,质检合格的文库用Illumina HiSeq 2500测序平台进行高通量测序。
1.2.4 数据统计与分析
从测序平台得到的原始图像数据文件,经碱基识别分析转化为原始测序序列,将测序得到的双端序列数据拼接成一条序列Tags;同时,对测序序列进行质控过滤,得到有效数据后进行OTU划分和物种注释,并作物种多样性分析以及组间差异分析。用SPSS 19.0统计软件与ANOVA进行分析,以Duncan氏作多重比较,显著水平为P<0.05。
2 结果与分析
2.1 测序序列及OTU分析
通过测序共得到2 244 524条有效序列,将有效序列进行聚类并划分OTU。对OTU进行统计,发现每组样品的OTU覆盖率均在99.9%以上,表明该测序能够真实反映各组样品的微生物组成。样品测定结果见表2和图1。
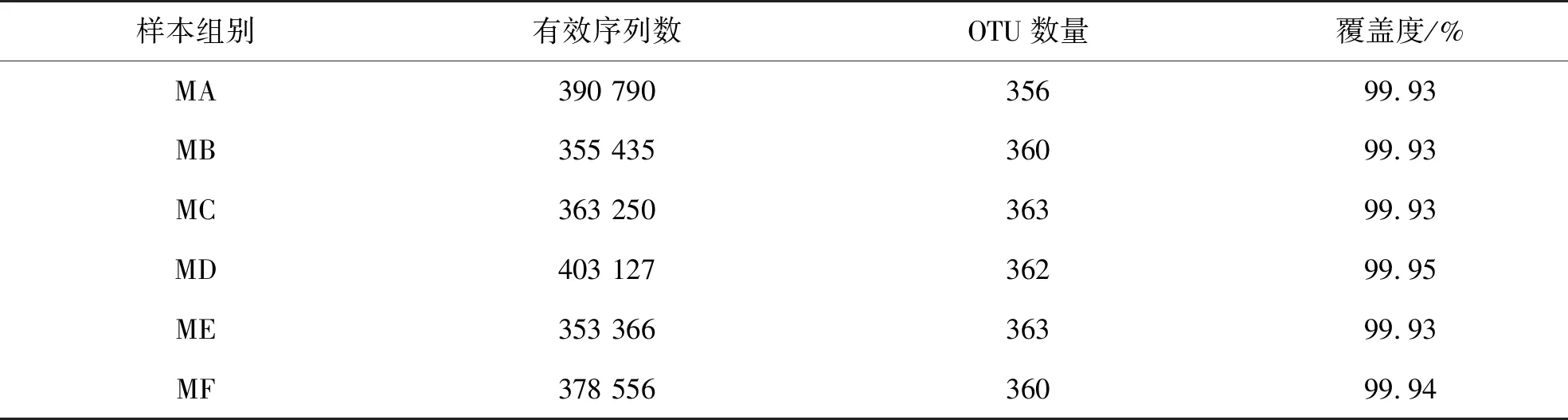
表2 样品OTU
图1展示了6组样品共有和特有的OTU信息,中间数字代表所有样品共有的OTU数目,花瓣上数字代表特有OTU数目,可见6组共有的OTU数目为344,仅MD组存在特有的OTU,数目为1。
2.2 BCAAs比例与攸县麻鸭肠道菌群组成
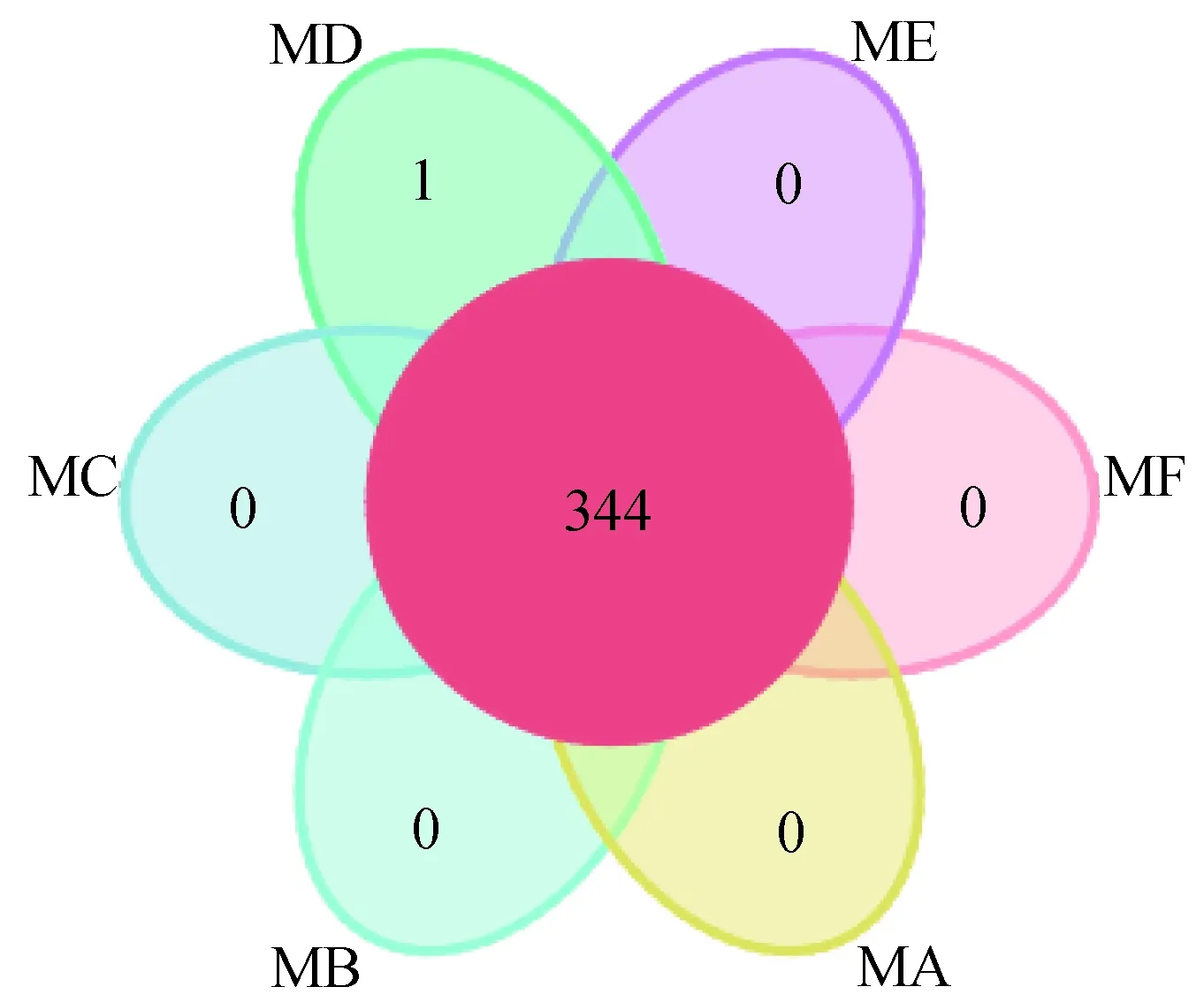
图1 OTU韦恩图Fig. 1 OTU Venn chart
2.2.1 基于门分类水平分析
6组盲肠内容物的所有序列鉴定为14个门。通过与数据库进行比对,对OTU进行物种分类并选取相对丰度排名前10的门类绘制物种相对丰度柱状图(图2)。排名前10的门类依次为拟杆菌门Bacteroidetes、厚壁菌门Firmicutes、变形菌门Proteobacteria、放线菌门Actinobacteria、螺旋体门Spirochaetes、梭杆菌门Fusobacteria、脱铁杆菌门Deferribacteres、无壁菌门Tenericutes、Patescibacteria门和迷踪菌门Elusimicrobia。6组核心菌群均为拟杆菌门、厚壁菌门和变形菌门,其中MD组在3种核心菌群的总丰度最高(92.82%),MA组最低(84.02%)。6组的三大核心菌群总相对丰度差异不显著(P>0.05)。由表3可知,ME组变形菌门丰度(11.10%±6.09%)显著低于MD组(P<0.05);MF组放线菌门丰度(7.29%±5.14%)显著高于MA组(P<0.05)。6组其他菌门相对丰度的差异不显著(P>0.05)。
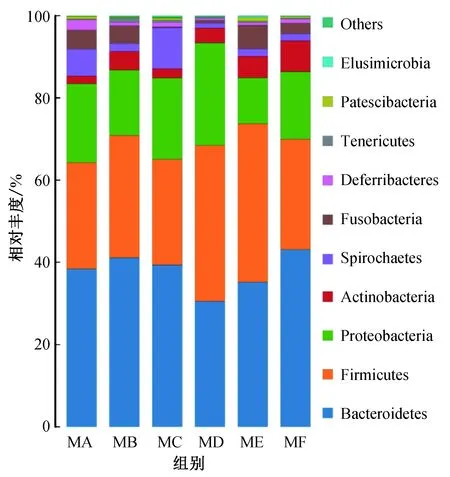
一种颜色代表一个物种,色块长度表示物种所占相对丰度比例图2 门水平上物种的相对丰度Fig. 2 Relative abundance of species at the phylum level

表3 门水平物种相对丰度差异

续表3 %
2.2.2 基于属分类水平分析
对盲肠肠道菌群中丰度最高的10个属进行统计作图,结果如图3所示,排名前10的菌属为拟杆菌属Bacteroides、脱硫弧菌属Desulfovibrio、厌氧螺菌属Anaerobiospirillum、Subdoligranulum属、Alistipes属、Faecalibacterium属、Rikenellaceae_RC9_gut_group属、短螺旋菌属Brachyspira、梭杆菌属Fusobacterium以及赖氨酸芽孢杆菌属Lysinibacillus。由图3可知,属水平上优势菌属在各组间略有不同。其中,MA、MB、MC、ME组的第一优势菌属均为拟杆菌属,MA、MB、MC组的第二优势菌属为脱硫弧菌属;MD组的第一、第二优势菌属为赖氨酸芽孢杆菌属和拟杆菌属,ME组的第二优势菌属为Subdoligranulum属,6个试验组各菌属之间的差异不显著。
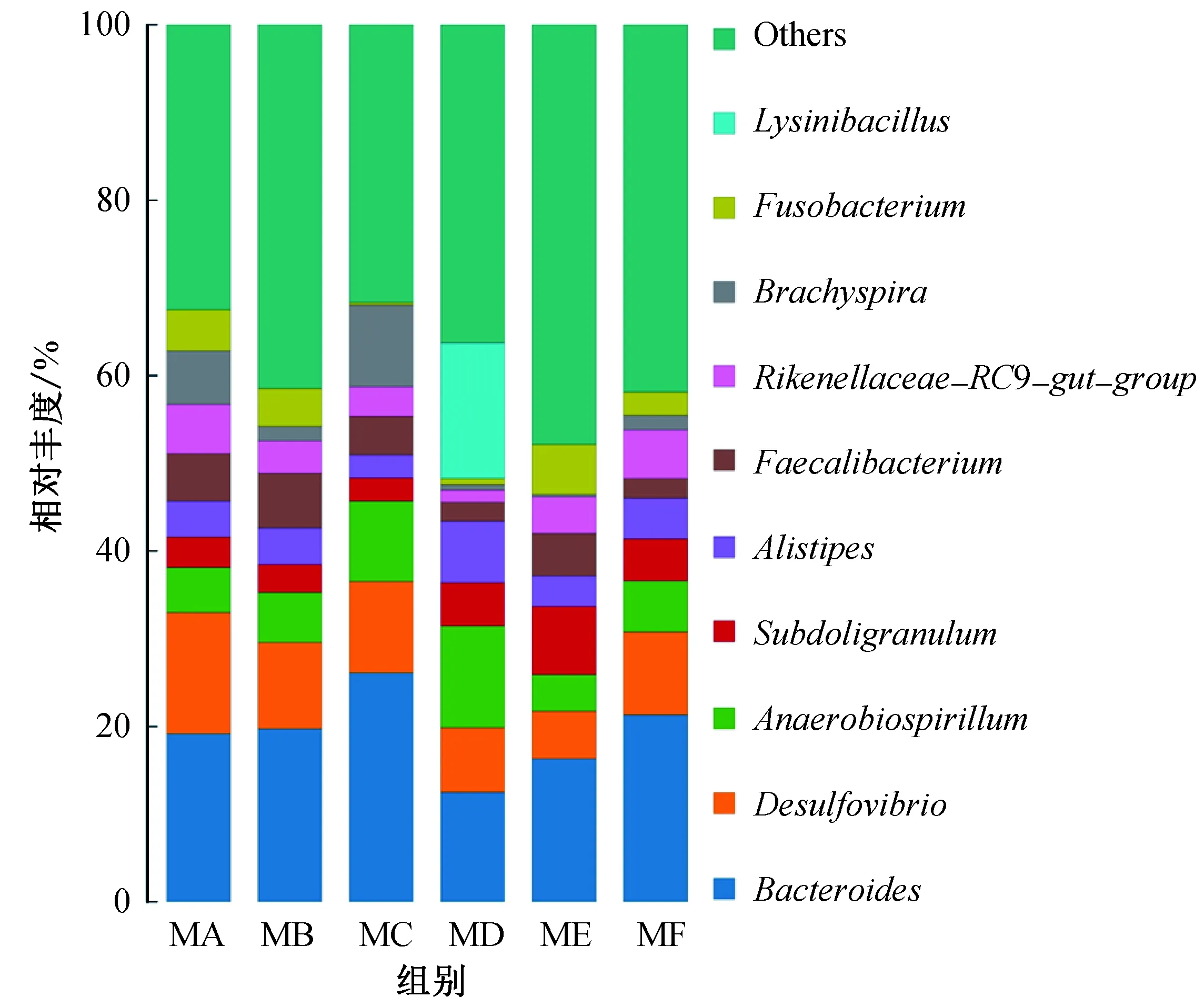
图3 属水平上物种相对丰度Fig. 3 Relative abundance of species at the genus level
2.3 BCAAs比例与攸县麻鸭肠道菌群结构及多样性
2.3.1 肠道菌群Alpha多样性分析
肠道菌群Alpha多样性指数分析结果见表4。Ace和Chao1指数数值越大,物种越丰富。Shannon数值越大,Simpson数值越小,物种多样性越高。6个组的Ace和Chao1指数值的差异不显著;MF组Shannon指数值大于MC组(P<0.05),Simpson指数值小于MC组(P<0.01)和MA组(P<0.05),表明MF组的微生物物种多样性最高,MC组最低。

表4 Alpha多样性指数分析结果
2.3.2 肠道菌群Beta多样性分析
肠道菌群Beta多样性的主坐标分析(PCoA)和无度量多维标定法(NMDS)分析结果见图4。将数据以点的形式反映在二维坐标图上,样本距离越近,表示物种组成结构越相似。6个组样本极大程度聚集在一起,微生物群落结构的差异显著(P>0.05),表明6个组样本的微生物群落结构具有较高的相似性。
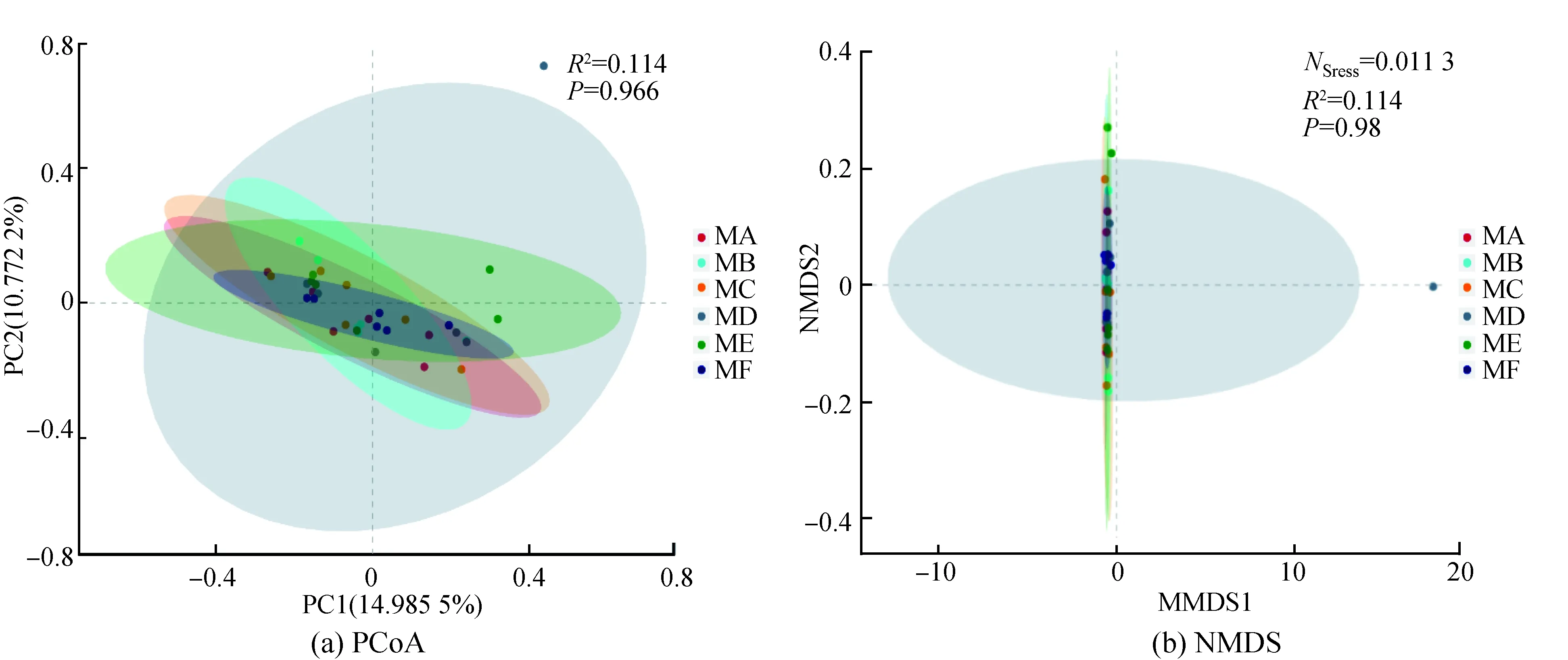
点分别表示各样品;不同颜色代表不同分组;横、纵坐标为导致样品间差异最大的2个特征值,以百分数的形式体现主要影响程度图4 PCoA和 NMDS分析结果Fig. 4 PCoA and NMDS analysis chart
3 讨论
3.1 BCAAs比例对攸县麻鸭肠道菌群组成的影响
肠道微生物主要是指肠道细菌,由有益菌、致病菌及中性菌构成,肠道细菌种群多达500 种,但这些种主要归属于少数的几个门类[18]。研究发现,厚壁菌门和拟杆菌门是单胃大型动物与小型动物肠道的两大优势门类[18]。除去以上两大优势门类,鼠肠道中的主要菌群还有变形菌门与脱铁杆菌门[19],反刍动物和鸡肠道中主要菌群还有变形菌门[20-21]。本研究中,两大优势门类为厚壁菌门和拟杆菌门,这与前人研究结果[18-21]相一致,第三大优势门类为变形菌门,与反刍动物和鸡肠道主要菌群更为一致。以上结果表明,动物肠道的优势门类不会被轻易改变,但饲粮中添加BCAAs会对其中部分主要菌门有一定的影响。另有研究指出,15月龄小鼠肠道中BCAAs补充组的拟杆菌门丰度较对照组下降3.9%,厚壁菌门丰度上升3.62%,变形菌门作为其第三优势门类在补充组中的丰度远远低于对照组[17],而变形菌门中通常包含较多的致病菌,因此,补充BCAAs可能有助于降低肠道菌群中的致病菌。结合本研究,ME组变形菌门丰度最低且显著低于MD组,可以推测BCAAs中Leu比例在三者中为37%~40%时,更有益于攸县麻鸭的肠道健康。本研究还发现MF组放线菌门丰度显著高于MA组,放线菌门中通常包含较多的共生菌与益生菌,所以MF组可能更有益于攸县麻鸭肠道菌群。
属水平上,BCAAs比例对丰度前10的菌属均无显著影响,然而各组间仍有一定差异。拟杆菌是肠道中的共生菌,为身体提供必需的营养,在MC与MF组中丰度最高;脱硫弧菌是常见的致病菌,在MA组的丰度最高。BCAAs可以被肠腔内的细菌利用[22-24],提示它们可能参与调节肠道菌群的组成。在对小鼠的研究中,发现BCAAs能够影响其肠道菌群的结构,并增加潜在益生菌双歧杆菌的丰度和降低致病菌肠杆菌的比例[17]。本研究中MF组出现较多的双歧杆菌。此外,猪的低蛋白饮食降低了肠道乳酸菌水平,但BCAAs平衡显著改善了乳酸菌的增殖[25];Ile促进了鲤鱼肠中乳酸杆菌和芽孢杆菌的生长,抑制了气单胞菌和大肠杆菌的生长[26]。然而对仔猪的研究中却发现BCAAs补充组与正常蛋白组的结肠微生物菌群没有差异[22]。以上表明,BCAAs对肠道菌群一定是有影响的,得到不一致的结果可能与动物品种、饲料组成和BCAAs添加水平以及比例等问题有关。因此,需要进一步深入研究来揭示BCAAs对机体肠道菌群的影响。
3.2 BCAAs比例对攸县麻鸭肠道菌群结构与多样性的影响
Yang等[17]研究指出,补充BCAAs使小鼠肠道微生物多样性更丰富;文献[22-24]认为,BCAAs通过被肠道中细菌利用进而可能参与肠道微生物种类和多样性的调节。但目前没有发现BCAAs比例对肠道菌群影响的研究。在本研究中,Alpha多样性分析结果表明,6组Ace和Chao1指数无显著差异(即6组具有相同的物种丰度),而MF组Shannon指数显著大于MC组,Simpson指数极显著小于MC组和MA组。在相同物种丰度条件下,Shannon指数越大,Simpson指数越小,说明物种多样性越高,由此可见,在本研究条件下,MF组具有最高的微生物多样性,MC组肠道微生物多样性最低。在Beta多样性分析中,PCoA与NMDS分析都是采取降维的思想对多样本数据进行定位、分析和归类,而NMDS分析克服了以前排序方法(包括PCoA在内)的缺点,更具有可靠性。结合OTU聚类分析发现,虽然MD组具有一特有的OTU,但6组微生物菌落结构仍具有较高的相似性,表明不同BCAAs比例在该研究条件下没有对攸县麻鸭的肠道菌群结构造成影响。
4 结论
63日龄攸县麻鸭盲肠的核心菌群是拟杆菌门、厚壁菌门、变形菌门,BCAAs比例显著影响变形菌门及放线菌门,当亮氨酸、缬氨酸、异亮氨酸的质量比m(Leu)∶m(Val)∶m(Ile)=1∶0.9∶0.8时,攸县麻鸭盲肠微生物物种多样性最高。

