微藻生物强化对藻-菌颗粒污泥的形成影响及污染物去除研究
肖亚兵,张雪纯,季 斌,樊 杰,郭绍东
武汉科技大学城市建设学院,湖北 武汉 430065
目前,在工程实践中需要实现生态和环境的可持续发展目标. 藻-菌颗粒污泥(microalgal-bacterial granular sludge, MBGS)由于具有较低的能耗需求、较少的碳排放和潜在的资源回收价值而受到污水处理领域越来越多的关注[1-3]. 由于微藻光合作用产生的氧气可被细菌用于有机物的氧化,而细菌产生的二氧化碳可被微藻利用而产生氧气[4-5],而易沉降的藻-菌生物质可被进一步用作能源/资源的原材料[1,6].因此,MBGS有望同步实现水-资源-能源的回收,符合环境可持续的理念.
MBGS的培养是MBGS工艺应用的重要前提.研究[7]表明,MBGS可通过好氧颗粒污泥(aerobic granular sludge, AGS)培养形成,其藻种来源于颗粒污泥本身,具有不确定性,因此也很难确定MBGS中的优势微生物尤其是关键藻种. 如Zhang等[8-9]通过AGS培养得到MBGS的关键藻种属于蓝藻,而Zhang等[10]培养得到的MBGS关键藻种为绿藻.
生物强化可作为MBGS的培养方式之一. 已有研究通过培养小球藻接种活性污泥的方式得到MBGS[11-12],也有研究通过接种小球藻和栅藻强化AGS的方式获得MBGS[13]. 然而,关于不同微藻的生物强化过程及关键藻种的作用还有待进一步研究. 因此,本研究通过微藻生物强化AGS的方式培养MBGS,分别向序批式光生物反应器中投加小球藻(R1反应器)、小球藻和斜生栅藻(R2反应器)以及小球藻、斜生栅藻和鲍氏细鞘丝藻(R3反应器),并对形成的MBGS理化特性、污染物去除以及微生物群落结构进行系统研究,以期进一步理解通过AGS培养MBGS的过程及关键藻种的作用机理.
1 材料与方法
1.1 试验装置和操作
试验装置采用圆筒状序批式反应器,内径约为10 cm,高径比为8,有效容积约为6.0 L. 该研究使用的AGS通过He等[14]的方法进行培养. 序批式反应器(sequencing batch reactor, SBR)在厌氧/有氧/缺氧(A/O/A)模式下运行,周期为8 h,其中进水时间3 min,厌氧阶段120 min,好氧阶段210 min,缺氧阶段142 min,沉淀2 min,排水3 min,体积交换率为50%(每个循环3.0 L). 研究开始时,R1、R2和R3反应器的混合液悬浮固体(MLSS)浓度约为5 g/L,5 min污泥体积指数(SVI5)约为40 mL/g. 光源为圆筒中部的LED灯(4 000 lx),反应器在(25±3) ℃条件下运行.该试验开始前15 d为常规AGS稳定运行阶段,之后向反应器中分别加入小球藻(Chlorella pyrenoidosa),小球藻和斜生栅藻(Scenedesmus obliquus),小球藻、斜生栅藻和鲍氏细鞘丝藻(Leptolyngbya boryana),微藻接种质量比均为1.0% (以干质量计).
1.2 合成市政废水成分
该研究使用以下组成的合成废水:COD (化学需氧量,CH3COONa)浓度约为320 mg/L,NH4+-N (氨氮,NH4Cl)浓度约为35 mg/L,PO43--P (磷酸盐,KH2PO4)浓度约为9 mg/L,10 mg/L CaCl2和1 mL/L微量元素溶液(10 mg/L EDTA,0.15 mg/L H3BO3,0.10 mg/L MnSO4·H2O,0.03 mg/L CuSO4·5H2O,0.12 mg/L ZnSO4·7H2O,0.06 mg/L Na2MoO4·2H2O,0.18 mg/L KI和0.15 mg/L CoCl2·6H2O). 使 用0.1 mmol/L HCl和NaOH将合成废水的pH调至6.5±0.1.
1.3 分析方法
COD、TN、NH4+-N和TP浓度按照标准方法测定[15];酸碱度(pH)和溶解氧(DO)浓度分别采用pH计〔ST3100,奥豪斯仪器(常州)有限公司〕和溶解氧仪(JPB-607A,上海仪电科学仪器公司)测定;从试验开始,以10 d为一周期,通过标准方法测定SVI以及叶绿素a、叶绿素b、MLSS和MLVSS的浓度;采用激光粒度仪〔Hydro 2000SM,微平科技(广州)有限公司〕测定MBGS粒径分布;胞外聚合物(extracellular polymeric substances, EPS)采用改进的热提取方法[16]提取,且其组成成分采用荧光分光光度计(F-7100型,日本日立公司)测定;蛋白质(PN)和多糖(PS)分别通过改良的Lowry法[17]和硫酸-蒽酮比色法[18]测定.
1.4 微生物群落分析
通过Illumina Miseq测序和显微镜检查研究了微生物群落. 为进行真核、原核生物群落分析,在第20、40、60天分别收集R1、R2和R3反应器的污泥样 本. 使 用OMEGA试 剂 盒(OMEGA Biotek Inc.,Norcross, GA, USA)提取DNA,并采用Nanodrop和1.2%琼脂糖凝胶电泳检测DNA提取质量. 原核、真核生物16S rRNA的扩增引物组分别为338F-806R和528F-706R[19]. 16S rRNA基因序列可在NCBI(http://www.NCBI.nlm.nih.gov/sra)上获得,登录号为PRJNA631461.
1.5 统计分析
使用SPSS 25.0软件进行单因素方差分析(one way ANOVN),分析污染物去除率与理化特性的统计差异,如果P<0.05,则表明存在统计学显著性差异,反之P>0.05,则表示无显著性差异.
2 结果与讨论
2.1 颗粒特性
2.1.1颗粒沉降性能及粒径分布
R1、R2和R3反应器初始MLSS浓度分别为(4.9±0.1)(4.9±0.1)和(5.2±0.1) g/L. 在该研究过程中3个反应器MLVSS浓度维持在(3.5±0.4) g/L. 接种微藻后,3个反应器SVI值都有所增加,这可能是由于微藻生长和细菌之间营养竞争,导致EPS分泌量在一定程度上有所增加引起的[8]. 经过30 d的培养,R1、R2和R3反应器中的MBGS均表现出了良好的沉降性能〔见图1(a)〕,其稳定时的SVI5/SVI2分别为0.985、0.994、0.994,表明MBGS沉降性能较好. 另外,稳定期R2和R3反应器形成的MBGS粒径较R1反应器略大〔见图1(b)〕,表明斜生栅藻的接种有可能利于MBGS粒径增长.
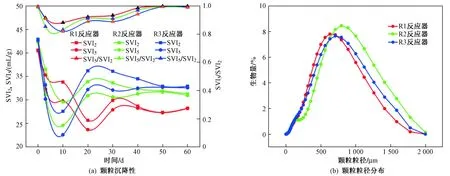
图 1 3个反应器中藻-菌颗粒污泥的沉降性与粒径分布Fig.1 Sludge settling property and granular size distribution of microalgal-bacterial granular sludge in 3 reactors
2.1.2胞外聚合物
EPS在维持MBGS稳定性和藻菌共生结构中有着至关重要的作用[4,20-27]. 3D-EEM光谱图显示了EPS成分(见图2). 如Chen等[28]的报道,峰B1、B2、B3与酪氨酸等简单芳香蛋白有关,峰A1、A2、A3与可溶性微生物副产物;峰C1、C2与腐殖酸有机物有关,而峰B2、B3也与类富里酸物质有关. 由图2可明显观察到,R1反应器与R2、R3反应器 EPS成分(酪氨酸等简单芳香蛋白、可溶性微生物副产物、腐殖酸、类富里酸)[28]存在显著性差异,而R2反应器与R3反应器在EPS组成上相似.

图 2 3个反应器中藻-菌颗粒污泥EPS的3D-EEM光谱Fig.2 3D-EEM spectra of the EPS of microalgal-bacterial granular sludge of 3 reactors
2.2 污染物去除
R1、R2和R3反应器对COD去除率如图3(a)所示. AGS系统第一阶段COD平均去除率分别为92.3%、93.1%、93.2%. 经过第二阶段适应期,3个反应器在第三阶段稳定期COD平均去除率分别达到98.3%,98.0%,99.3%〔见图3(a)〕. 该结果表明,相比AGS系统,稳定后的MBGS系统具有更高的有机物去除率. 而由于3个反应器表现出相似的COD去除率(P>0.05). 因此,在R1反应器中接种小球藻的基础上再接种一至两种微藻(斜生栅藻、鲍氏细鞘丝藻)不会显著影响COD的去除率,这与Fan等[11,29-30]的研究结果类似.

图 3 COD、NH4+-N、TN、TP进出水浓度及去除率Fig.3 Variations of concentrations of COD, NH4+-N, TN, TP of influent and effluent and the removal efficiency
第一阶段,R1、R2和R3反应器NH4+-N平均去除率分别为97.8%、98.7%、98.7%〔见图3(b)〕. 接种微藻后的适应期,NH4+-N去除率快速下降. 稳定后的MBGS系统,NH4+-N平均去除率分别为98.9%、99.5%、99.5%〔见图3(b)〕. 由此可得,MBGS系统去除NH4+-N的效能优于AGS系统. 另外,稳定后的MBGS系统和第一阶段AGS系统对TN去除率均高于70%〔见图3(c)〕,但无显著差异(P>0.05).
如图3(d)所示,R1、R2和R3反应器在第三阶段TP平均去除率达到93.2%、96.5%、98.2%,相较第一阶段TP的去除率,说明小球藻的接种可显著提高磷的去除率[31]. R2、R3反应器与R1反应器相比,磷去除率分别增加3.3%、5.0%(P<0.05),另外R2与R3反应器在磷的去除方面也具有显著性差异(P<0.05).以上结果表明,微藻强化对反应器生物除磷有显著提高作用.
2.3 微生物群落
2.3.1原核生物群落
Illumina Miseq测序分析了3个反应器第20、40、60天的9个样品,每个样品有效序列量在90 000~130 000之间,OTU数量在2 100以上,香农威纳指数和辛普森指数分别在6.7、0.94以上. 如图4所示, 变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi)和浮霉菌门(Planctomycetes)这4个菌群的丰度总和占90%左右(见图4). 这些细菌多为异养菌,可为有机物的高效去除提供保障. 另外,硝化螺旋菌门(Nitrospirae)可实现亚硝酸盐的氧化[32-33].β-变形菌的红环菌科(Rhodocyclaceae)为除磷的主要贡献者[34],其在R1、R2和R3反应器的相对丰度分别为18.6%、26.8%和39.6%. 微纤毛虫科(Microscillaceae)具有分泌多糖的功能[35],有利于MBGS颗粒的结构维持. 伯克氏菌科(Burkholderiaceae)具有降解有机物的潜能[36],对COD的去除可能有重要贡献.

图 4 3个反应器原核生物在门分类水平上的组成Fig.4 The compositions of prokaryotes in 3 reactors at the phylum level
2.3.2真核生物群落
由图5可以看出,R1、R2、R3反应器真核微生物主要包括轮虫门(Rotifera)、绿藻门(Chlorophyta)、子囊菌门(Ascomycota)、隐霉菌门(Cryptomycota). 轮虫的出现反映了MBGS良好的沉降性. 接种微藻后,R3反应器未检测出蓝藻,表明鲍氏细鞘丝藻在藻类竞争中被淘汰,而绿藻门有明显增加,最终R3反应器形成了与R2反应器功能微生物类似的MBGS系统.
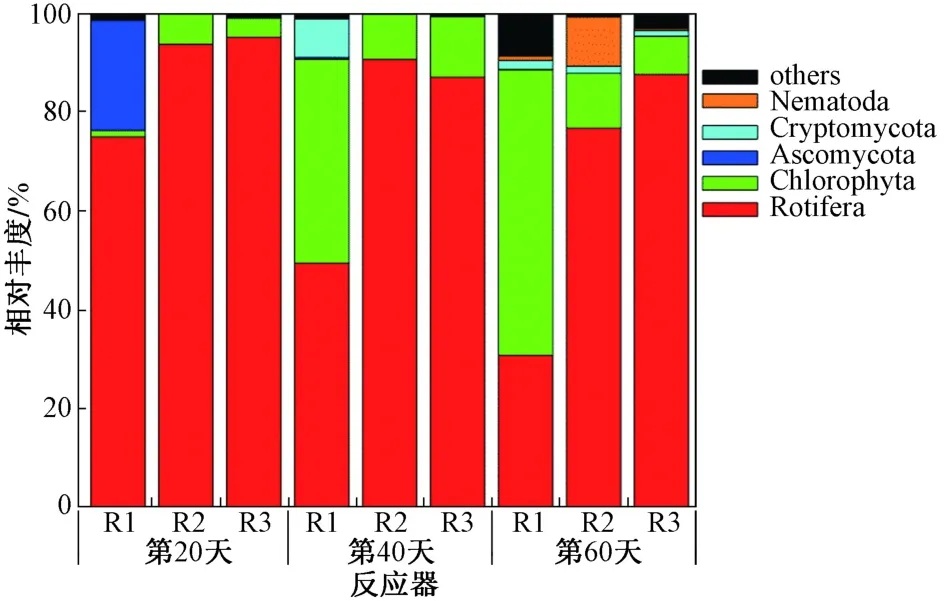
图 5 3个反应器真核生物在门分类水平上的组成Fig.5 The compositions of eukaryotes in 3 reactors at the phylum level
3 结论
a) 相比AGS系统,MBGS系统具有更优的沉降性和更高的污染物去除率.
b) 相比加入小球藻的R1反应器,投加小球藻与斜生栅藻的R2、R3反应器具有更高的污染物去除率,说明斜生栅藻的投加有利于MBGS的污染物去除.
c) 斜生栅藻的投加有利于促进微生物EPS的分泌,从而维持MBGS的结构和功能.

