基于Notch1通路研究白藜芦醇对脂多糖诱导HT-29细胞紧密连接蛋白损伤的作用及机制*
罗毅华,张君红,刘 莹,井 洁,黄 雪
(广西医科大学附属第一医院老年病学消化内科,南宁 530021)
肠屏障功能的异常在溃疡性结肠炎(ulcerative colitis,UC)的发病过程中扮演着重要角色,其中肠上皮紧密连接蛋白是肠屏障功能维持的最重要因素[1]。研究表明,肠上皮紧密连接蛋白的异常表达可促进UC 疾病的发展[2-3],Notch1 通路因能影响肠上皮紧密连接蛋白表达从而成为了人们的研究热点[4-6]。白藜芦醇(resveratrol,RSV)作为一种天然多酚化合物,广泛存在花生、葡萄、桑葚等植物中,其已被证实具有抗氧化、抗炎、抗癌、抗动脉粥样硬化等作用[7-9]。在UC 的临床前期研究中,RSV 作为一种补充剂,可有效缓解UC 患者的临床症状[10-11];在UC 相关实验研究中,RSV 可通过抑制Notch1 通路活性调节人结肠上皮细胞的增殖和分化,从而对UC的细胞模型具有保护作用[12]。另外有研究证实,RSV可上调肠上皮紧密连接蛋白的表达,从而缓解UC动物模型的肠道炎症[13-14],然而RSV调控肠上皮紧密连接蛋白表达的机制尚存在争议,且RSV是否通过Notch1 通路调节肠上皮紧密连接蛋白的表达目前尚不清楚。因此本研究拟通过脂多糖(lipopolysaccharide,LPS)诱导HT-29 细胞构建肠上皮紧密连接蛋白损伤模型(HT-29 细胞损伤模型),探讨RSV 对肠上皮紧密连接蛋白的影响及是否通过Notch1 通路参与调控,为寻找治疗UC 的新药物提供理论依据。
1 材料与方法
1.1 细胞培养
HT-29细胞购买于中国科学院上海生物化学和细胞生物学研究所细胞资源中心,细胞在含10%胎牛血清、1%青霉素链霉素溶液的RPMI-1640培养基中培养,置于含5%CO2、温度为37 ℃的湿润培养箱中培养。当细胞长至80%~90%融合度时,将其按照1∶3比例进行传代培养,用于后续实验。
1.2 药物试剂
LPS,购于美国sigma公司;1%青霉素链霉素溶液,购于苏州新赛美生物科技有限公司;胎牛血清、RMPI-1640 培养基购于Biological Industries 公司,RSV、γ-分泌酶抑制剂(DAPT),购于美国APE 公司;CCK-8 试剂盒,购于中国大连美伦生物公司;claudin-1、Notch1、Hes1 抗体购于美国Abcam 公司,occludin、ZO-1、抗兔IgG 抗体购于美国cell Signaling Technology公司。
1.3 细胞分组及处理
当细胞长至80%~90%融合度时,将细胞传至6孔板继续培养,待6孔板内细胞长至70%左右融合度时,更换无血清培养基培养过夜使细胞同步化,随后将细胞分为对照组,LPS 组(100 μg/mL 的LPS干预24 h),RSV 低剂量组(50 μmol/L 的RSV 预处理HT-29 细胞4 h,随后加入100 μg/mL 的LPS 继续干预24 h),RSV 高剂量组(100 μmol/L 的RSV 预处理HT-29 细胞4 h,随后加入100 μg/mL 的LPS 继续干预24 h),Notch1 通路抑制剂组(以下简称DAPT组,20 μmol/L 的DAPT 预处理HT-29 细胞4 h,随后加入100 μg/mL的LPS继续干预24 h)。
1.4 CCK-8法检测细胞活力
使用CCK-8法检测药物对细胞活力的影响,将HT-29 细胞以5 000 个/孔的密度接种于96 孔板,每组5 个复孔。待细胞长至70%左右的融合度时,不同浓度LPS(0.1 μg/mL、1 μg/mL、10 μg/mL、50 μg/mL、100 μg/mL)、RSV(25 μmol/L、50 μmol/L、75 μmol/L、100 μmol/L)、DAPT(5 μmol/L、10 μmol/L、15 μmol/L、20 μmol/L、25 μmol/L)分别作用细胞24 h,随后,用完全培养基将其洗涤2 次,加入含10% CCK-8 的完全培养基,在37 ℃条件下避光孵育,2 h 后将其置于450 nm 波长的酶标仪下测定其吸光度值。
1.5 Western blotting检测蛋白表达
收集各组细胞后,使用含蛋白酶抑制剂的细胞裂解液在冰上裂解HT-29 细胞30 min,随后在4 ℃的条件下,12 000 r/min,离心15 min。将其上清液转移至另一无菌EP 管,用BCA 法测定各组蛋白浓度。每组样本中等量的蛋白用12% SDS-PAGE 胶分离各蛋白,并将其蛋白转移至聚偏二氟乙烯(PVDF)膜上。随后,用含5%的脱脂牛奶于室温下封闭PVDF 膜1 h。用TBST 缓冲液清洗PVDF 膜后,将膜放至用抗体稀释液按比例稀释过后的一抗occludin(1∶1 000)、ZO-1(1∶1 000)、claudin-1(1∶2 000)、Notch1(1∶2 000)、Hes1(1∶1 000)中,在4 ℃条件下孵育过夜。将PVDF膜从一抗中取出,TBST缓冲液清洗干净,随后放置抗兔IgG(1∶20 000)的二抗中室温避光孵育1 h。二抗孵育结束后,用TBST缓冲液避光清洗,随后将膜放置Odyssey 双色红外荧光成像系统中进行显影,用Image J软件对其数据进行分析。
1.6 统计学方法
用SPSS 22.0 软件对实验数据进行统计学分析,用GraphPad Prism 9.0 绘制统计图。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,进一步两两比较时,若方差齐,则采用LSDt检验;若方差不齐,则采用塔姆黑尼检验。以P<0.05为差异有统计学意义。
2 结果
2.1 检测对HT-29细胞活力无影响的药物浓度
与对照组相比,LPS、RSV和DAPT浓度分别为100 μg/mL、100 μmol/L和20 μmol/L时,对HT-29细胞活力均无影响,见图1。为使后续的实验结果并非由药物诱导细胞死亡所引起,故LPS 浓度选用100 μg/mL,RSV 选择在100 μmol/L 的浓度范围内,DAPT浓度选用20 μmol/L。

图1 药物对HT-29细胞活力的影响
2.2 RSV 上调LPS 诱导的HT-29 细胞损伤模型紧密连接蛋白occludin、ZO-1、claudin-1的表达
与对照组相比,LPS 诱导的HT-29 细胞损伤模型紧密连接蛋白occludin、ZO-1、claudin-1的表达水平降低(P<0.05)。与LPS 组比较,RSV 低剂量组、RSV 高剂量组紧密连接蛋白occludin、ZO-1、claudin-1的表达水平升高(P<0.05)。当RSV干预浓度为100 μmol/L 时,其上调LPS 诱导的HT-29 细胞损伤模型紧密连接蛋白occludin、ZO-1、claudin-1表达的效果最为明显,见图2,故后续采用100 μmol/L的RSV进行机制研究。
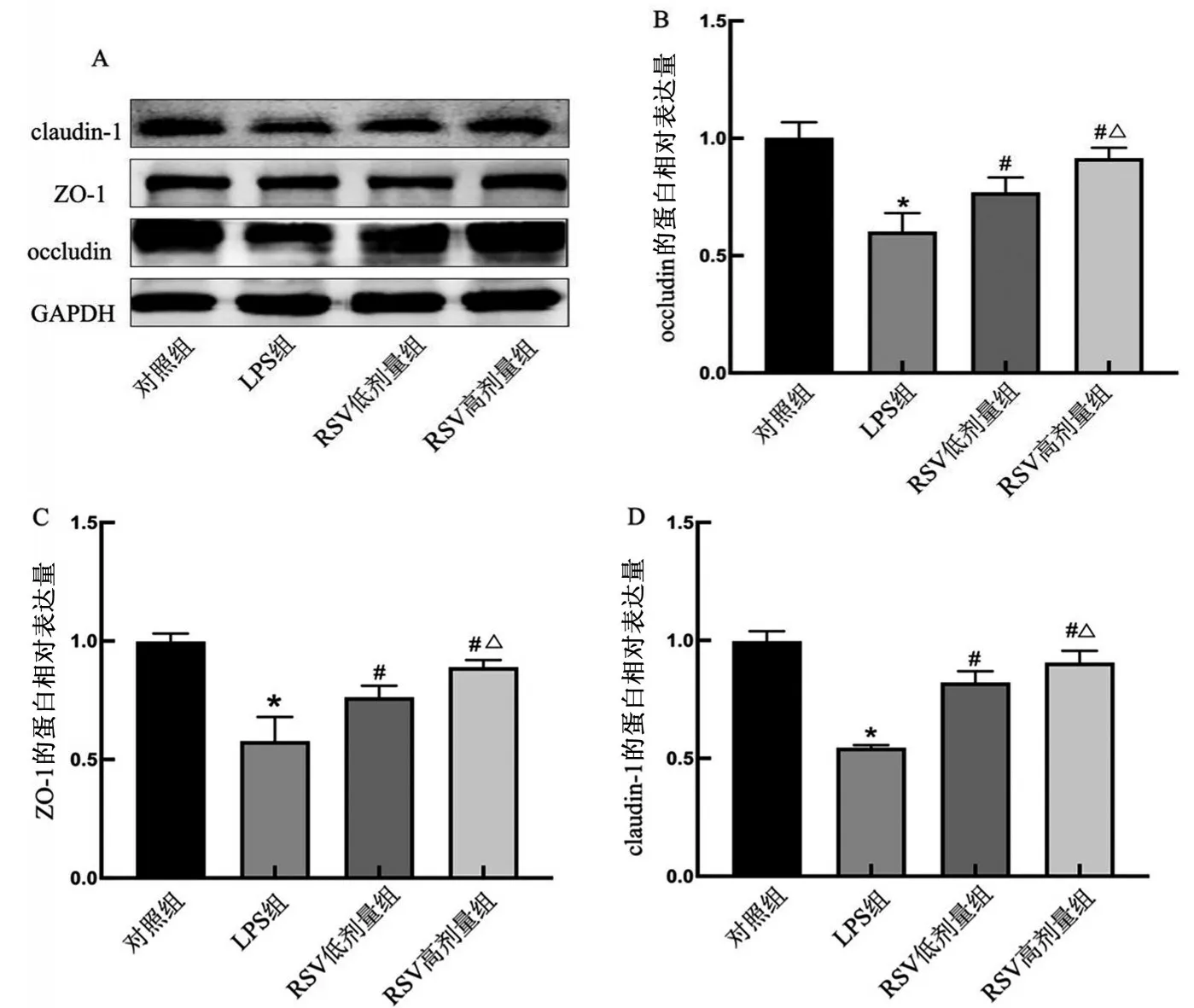
图2 RSV对LPS诱导的HT-29细胞损伤模型紧密连接蛋白occludin、ZO-1、claudin-1的影响
2.3 RSV 抑制LPS 诱导的HT-29 细胞损伤模型Notch1通路的活性
与对照组相比,LPS 组的Notch1、Hes1 蛋白表达水平升高(P<0.05);与LPS 组相比,RSV 低剂量组、RSV 高剂量组Notch1、Hes1 蛋白的表达水平降低(P<0.05),并且RSV高剂量组更为明显,见图3。

图3 RSV对LPS诱导的HT-29细胞损伤模型中Notch1通路的影响
2.4 RSV 通过抑制Notch1 通路活性上调LPS 诱导的HT-29细胞损伤模型紧密连接蛋白occludin、ZO-1、claudin-1的表达
与对照组相比,LPS 组Notch1、Hes1 蛋白表达水平升高(均P<0.05);与LPS 组相比,RSV 组和DAPT 组的Notch1、Hes1 蛋白的表达水平降低,紧密连接蛋白occludin、ZO-1、claudin-1的表达水平升高(均P<0.05),见图4~图5。

图4 DAPT对LPS诱导的HT-29细胞损伤模型中Notch1通路的影响

图5 DAPT对LPS诱导的HT-29细胞损伤模型紧密连接蛋白occludin、ZO-1、claudin-1的影响
3 讨论
本研究结果显示,在LPS 构建紧密连接蛋白损伤模型中,RSV 上调了肠上皮紧密连接蛋白occludin、ZO-1、claudin-1 的表达,抑制了Notch1 通路活性,且具有一定的剂量依赖性,当RSV 的浓度为100 μmol/L 时,其上调肠上皮紧密连接蛋白occludin、ZO-1、claudin-1 等表达效果及抑制Notch1 通路活性的效果与Notch1 通路特异性抑制剂DAPT 的效果均无统计学差异,表明RSV可通过抑制Notch1通路活性来上调肠上皮紧密连接蛋白occludin、ZO-1、claudin-1的表达。
Notch1 通路是一种细胞间高度保守的信号通路,通过调控其下游的Hes-1 等基因的表达参与细胞分化、存活及凋亡的信号转导,在肠上皮紧密连接蛋白的稳定维持中扮演着重要角色。在本研究中,与LPS 组 相 比,Notch1 通 路 分 别 在RSV 和DAPT的作用下,其活性受到一定程度的抑制,肠上皮紧密连接蛋白occludin、ZO-1、claudin-1的表达上调,即Notch1通路活性在一定程度上抑制可上调紧密连接蛋白的表达,这与2014 年的研究观点“敲除小鼠体内Notch1基因后,因肠上皮紧密连接蛋白表达紊乱而在葡聚糖硫酸钠喂养后小鼠表现出更为严重的肠道炎症”不符[5],其中存在的可能性是:Notch1通路在肠上皮细胞的增殖、重建上扮演着关键角色[15],Notch1 基因的完全敲除使得Hes1 等蛋白表达受阻,从而导致肠上皮细胞的增殖、更新和重建功能受阻,肠上皮紧密连接蛋白的表达下降,在葡聚糖硫酸钠等因素刺激后小鼠肠道炎症进一步加重;而在本研究中,通过CCK-8 法明确了当RSV 浓度为100 μmol/L、Notch1 通路特异性抑制剂DAPT浓度为20 μmol/L时,二者对HT-29细胞活力均无影响,说明RSV作用浓度为100 μmol/L、DAPT作用浓度为20 μmol/L 时,既抑制了Notch1 通路活性,又不影响HT-29 细胞的增殖、更新和重构,因此不影响HT-29细胞在遭受LPS的诱导损伤后,HT-29细胞自身的增殖修复过程,从而在Notch1通路活性受到抑制后,对肠上皮紧密连接蛋白occludin、ZO-1、claudin-1 起到一定的上调作用;另一方面相关研究证实,Notch1通路活性得到抑制后,TNF-α等促炎因子的分泌减少[16],而TNF-α 等促炎因子可下调肠上皮紧密连接蛋白的表达[17],Notch1 通路活性受到抑制后可能通过减少了促炎因子的分泌,从而减轻了其对肠上皮紧密连接蛋白的损害作用。
综上所述,在LPS 诱导的HT-29 细胞紧密连接蛋白损伤模型中,RSV 上调肠上皮紧密连接蛋白occludin、ZO-1、claudin-1 表达,其机制可能与抑制Notch1 通路活性有关,为RSV 用于临床治疗UC 提供了实验理论依据。

