一株猫传染性腹膜炎病毒的分离鉴定和遗传特征分析
赵 辉,李双星,朱明哲,赵 洋,杜吉革,刘业兵,张传美,印春生*
(1. 中国兽医药品监察所,北京 100081;2. 青岛农业大学动物医学院,山东青岛 266109)
猫传染性腹膜炎是由猫传染性腹膜炎病毒(Feline infectious peritonitis virus, FIPV)引起的猫的一种全身性、致死性疾病[1],临床上以纤维性和肉芽肿性浆膜炎,富含蛋白质的浆液性积液或脓性肉芽肿性病变为主要特征,根据临床表现形式不同可分为湿性、干性以及混合性三种类型[2]。FIPV的感染和发病率很低,很少超过5%,幼猫(6月龄~2岁)易感染FIPV[3-4];阿比西尼亚、比尔曼、喜马拉雅、拉格多尔和雷克斯等品种的猫更容易感染FIPV[5]。唐小娟等[6]对武汉市2017-2018年的猫传染性腹膜炎阳性病例进行统计分析,共收集了临床病例1036例,其中猫传染性腹膜炎阳性病例数61例,发现阳性检出率为5.9%。Guan等[7]对黑龙江省哈尔滨市家庭宠物猫和流浪猫进行了两年的FIPV感染流行病学评估,利用2017年7月至2019年7月采集的1523份猫血样本进行实时RT-PCR检测,共检出189份FIPV阳性血样,FIPV感染率约为12%。
FIPV属于尼多病毒目(Nidovirales),冠状病毒科(Coronaviridae),α冠状病毒属(Alphacoronavirus)。FIPV与猫肠道冠状病毒(Feline enteric coronavirus,FECV)是猫冠状病毒(Feline coronavirus,FCoV)的两种生物型。FIPV 基因组全长约30 kb,包括11个开放阅读框,编码4种主要结构蛋白,即刺突蛋白S、膜蛋白E、包膜蛋白M和核衣壳蛋白N;编码7种非结构蛋白,即复制酶蛋白(1a和1b)以及辅助蛋白(3a、3b、3c、7a和7b)[8]。在FCoV的发病机理中,S蛋白被认为是最重要的影响因素,该蛋白还影响FCoV的嗜性和毒力,以及从肠道疾病到猫传染性腹膜炎的转变[9]。S蛋白是FIPV识别、进入宿主细胞过程中的重要因素,它的S1区域识别并结合宿主细胞上的受体,S2区域参与病毒和宿主细胞膜融合[10-11]。根据S蛋白氨基酸序列和抗体中和的差异,将FCoV分两种血清型,FCoV-I型和FCoV-Ⅱ型[12-13],因此分析S基因是至关重要的。N基因编码病毒核衣壳蛋白,N蛋白由NTD和CTD两个结构域组成,这两个结构域是N蛋白结合病毒RNA所必需的[14]。N基因相对保守,常被用于研究病毒的遗传进化分析[15]。本研究从北京地区临床疑似患猫传染性腹膜炎的样品中成功分离获得一株FIPV,克隆测序分析该毒株的S基因和N基因,以期掌握该地区目前FIPV的变异、流行特点,为FIPV的疫苗研制和诊断方法的建立等进一步研究奠定基础。
1 材料与方法
1.1 细胞及主要试剂 MDCK细胞由中国兽医药品监察所保存;胎牛血清购自浙江天杭生物科技股份有限公司;DMEM细胞培养液购自Gibco公司;FIPV单克隆抗体(FIPV3-70)购自赛默飞世尔科技(中国)有限公司;免疫染色通透液(TritonX-100)、细胞核染料DAPI溶液均购自 Solarbio公司;FITC标记的羊抗鼠IgG二抗购自GenStar公司; 病毒基因组DNA/RNA提取试剂盒购自天根生化科技(北京)有限公司。反转录酶、高保真酶购自宝日医生物技术(北京)有限公司。
1.2 病毒的分离培养与鉴定 采集疑似患猫传染性腹膜炎的猫新鲜粪便或腹水,用预冷的MEM培养基稀释后充分震荡,12000 r/min离心3 min取上清,经0.22 μm滤膜过滤后接种于单层的MDCK细胞,另设正常细胞做阴性对照,每隔12 h观察细胞状态并记录。当80%的细胞发生病变时置于-80 ℃冰箱冻融三次后,6000 r/min 4 ℃离心10 min,收获病毒液上清。取上清液提取病毒核酸,进行RT-PCR鉴定。
1.3 间接免疫荧光试验 取病毒液接种于48孔板中单层的MDCK细胞,感作2 h,并设置正常细胞对照,待细胞出现病变还未脱落时,吸弃培养液,PBS洗涤3次;每孔加入100 μL预冷的80%丙酮溶液,室温固定15 min,PBS洗涤3次;用100 μL 0.5%的TritonX-100通透10 min,PBS洗涤3次;每孔加入100 μL 5%脱脂乳于37 ℃温箱内封闭2 h,吸弃封闭液,PBST洗涤3次;加入100 μL 1∶200稀释的FIPV单克隆抗体(FIPV3-70),37 ℃孵育2 h,PBST洗涤3次;加入100 μL 1∶500稀释的FITC标记的羊抗鼠IgG二抗,避光孵育1 h,PBST洗3遍;加入100 μL DAPI染核3 min,PBST洗3遍,于倒置荧光显微镜下观察结果。
1.4 病毒滴度测定 MDCK细胞消化重悬后,对细胞进行计数,调整细胞浓度为1×105/mL的悬液后加入到96孔细胞培养板中,100 μL/孔,置于37 ℃、5% CO2培养箱中培养,待细胞铺满单层后,将病毒按照10倍倍比稀释至10-10,每个稀释度设置8孔重复,以未感染的MDCK细胞作为对照组,连续观察5 d,记录每个稀释度的病变孔数,利用Reed-Muench氏法计算病毒滴度。
1.5 RT-PCR鉴定 根据RNA提取试剂盒说明书提取病毒RNA,并进行S、N基因序列的扩增。根据GenBank上发表的FIPV的基因序列设计N基因的特异性引物,根据参考文献[6]合成部分S基因引物,由生工生物工程(上海)股份有限公司合成;PCR产物由生工生物工程(上海)股份有限公司测序。S、N基因引物序列信息见表1。

表1 引物序列信息
1.6 S、N基因遗传进化分析 参考国内外FCoV毒株的基因组序列,采用邻接法 (Neighbor-Joining method) 使用MEGA7.0软件构建基于部分S基因序列和完整的N基因序列的遗传进化树,并通过S基因的遗传进化树进行生物型和血清型分型鉴定。利用Megalign软件S 、N基因序列进行核苷酸同源性分析。
2 结果与分析
2.1 病毒分离 将病料离心后接种于MDCK细胞,并设置正常细胞做对照。3 d后接毒细胞出现皱缩、脱落,对照细胞无明显变化(图1)。收取病毒上清液后提取总RNA,反转录为cDNA,利用1.5中的引物进行PCR检测,显示该细胞上清液FIPV阳性。

A: FIPV感染的MDCK细胞; B: MDCK细胞对照
2.2 病毒间接免疫荧光鉴定 利用FIPV单克隆抗体(FIPV3-70)对分离的毒株进行间接免疫荧光试验鉴定,在倒置荧光显微镜下可见接种病毒的MDCK细胞有特异性绿色荧光,对照细胞无荧光(图2)。间接免疫荧光试验结果进一步证明该病毒为FIPV。传至第5代时,测定病毒滴度为105.5TCID50/0.1mL。
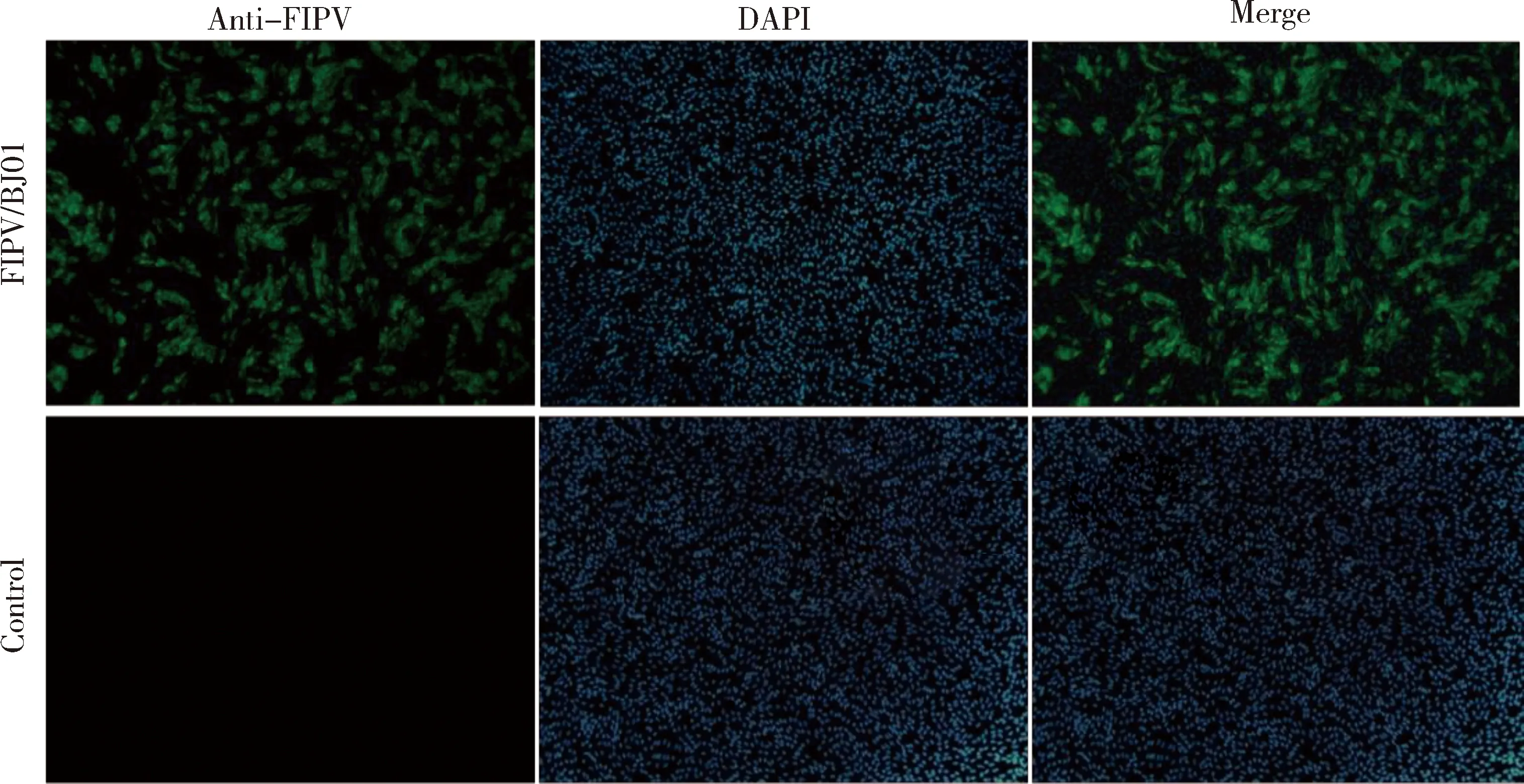
Anti-FIPV:FIPV单克隆抗体(FIPV3-70);DAPI:细胞核染色
2.3 病毒RT-PCR检测 利用1.5中的引物对分离的FIPV进行S、N基因的PCR 扩增,通过1%琼脂糖凝胶电泳。结果显示,分离病毒RT-PCR产物大小分别为705 bp、1073 bp,与预期相符(图3、图4)。将PCR产物送至生工生物工程(上海)股份有限公司测序,测序结果经BLAST比对确定,该毒株为FIPV,将该分离株命名为FIPV/BJ01。
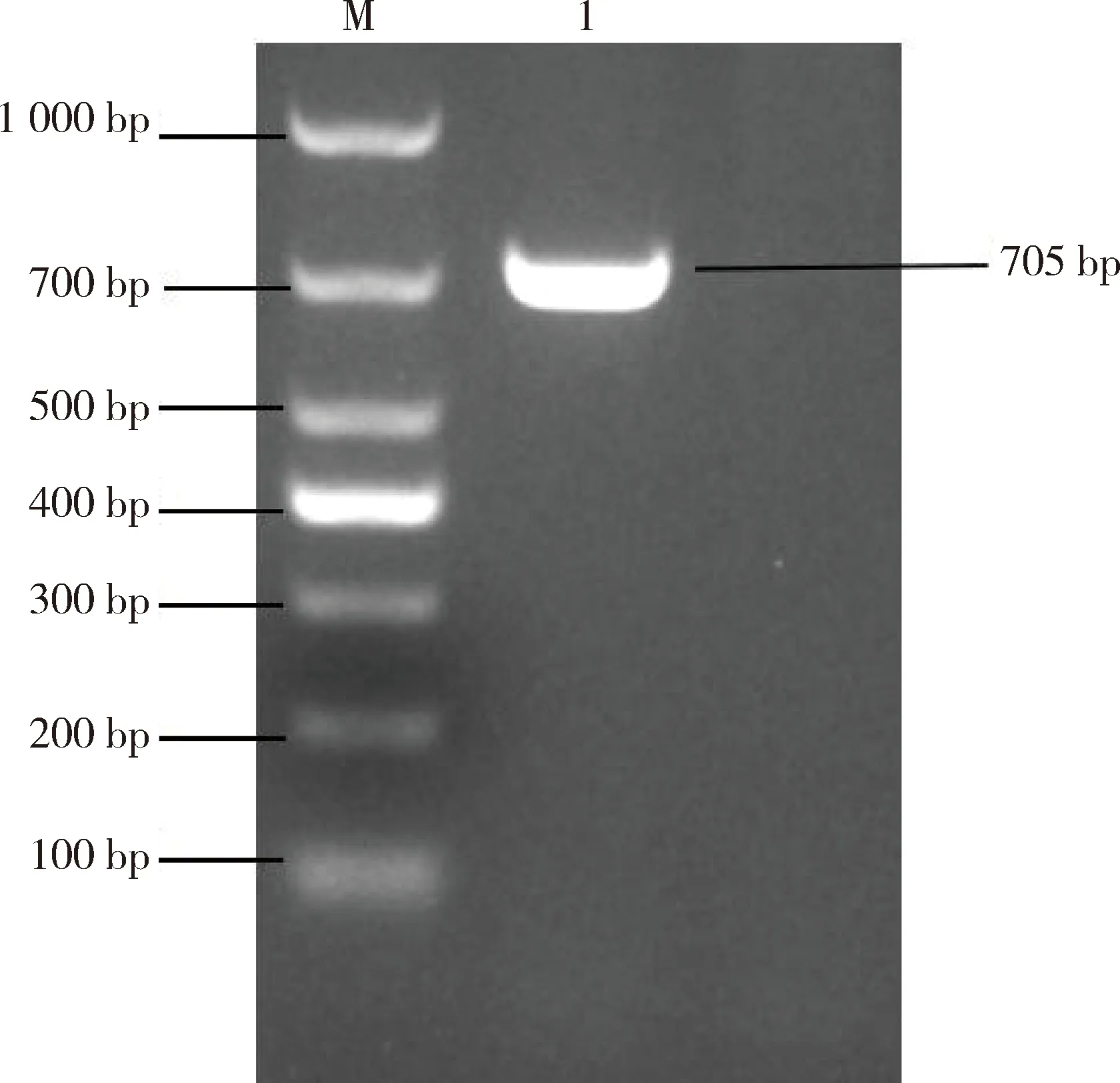
M: DNA分子质量标准; 1: FIPV/BJ01 S基因; -: 阴性对照
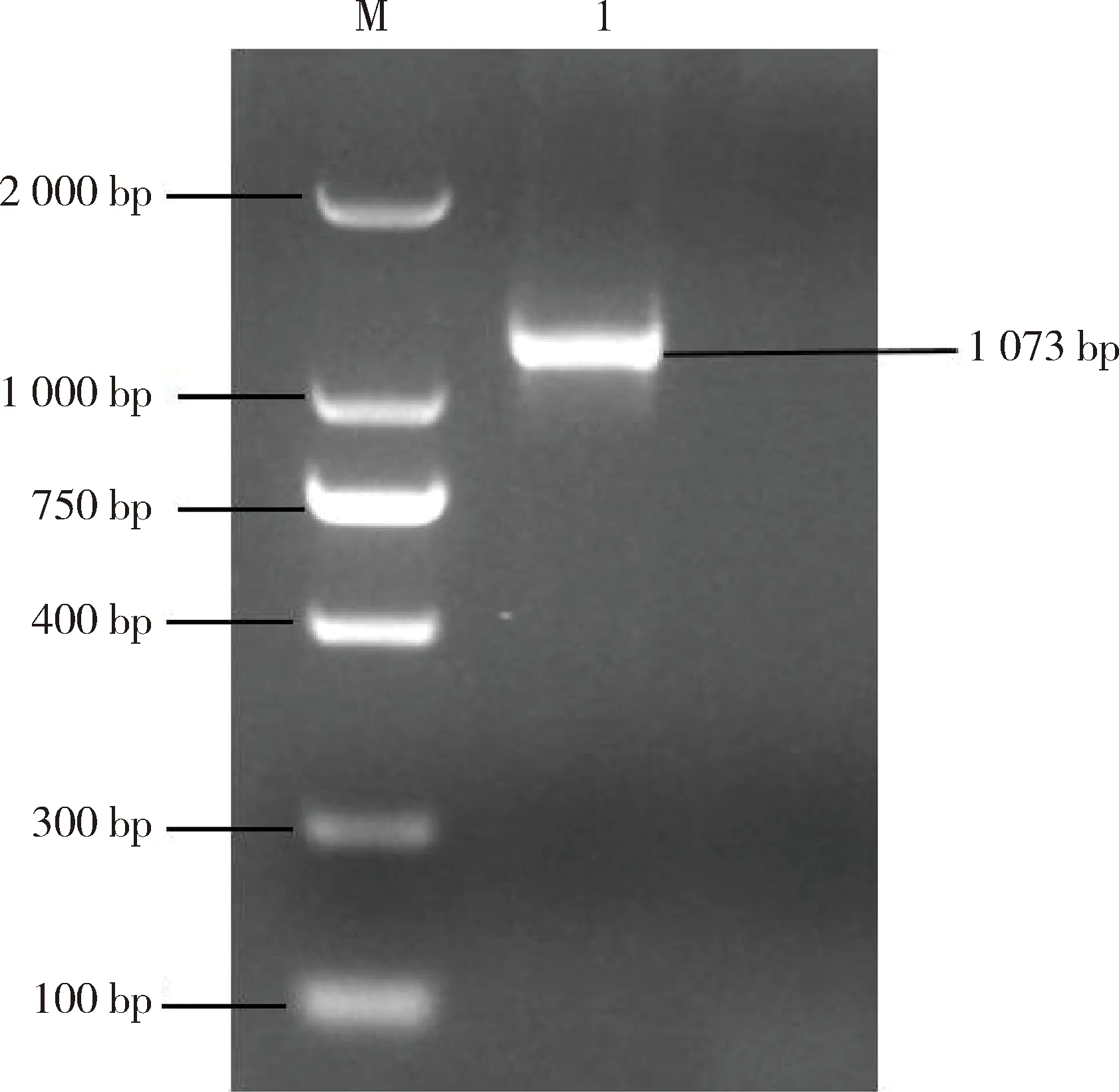
M:DNA分子质量标准; 1:FIPV/BJ01 N基因; -:阴性对照
2.4 S、N基因遗传进化分析
2.4.1 S基因遗传进化分析 根据FCoV S基因生物型遗传进化树分析结果显示,分离株FIPV/BJ01属于FIPV生物型(图5)。核苷酸同源性分析结果表明,FIPV/BJ01分离株与各参考毒株核苷酸同源性为63.3%~99.4%。
FCoV S基因血清型遗传进化树结果表明,分离株FIPV/BJ01属于FCoV-Ⅱ簇(图6),与其他参考毒株的核苷酸同源性为63.3%~99.4%。
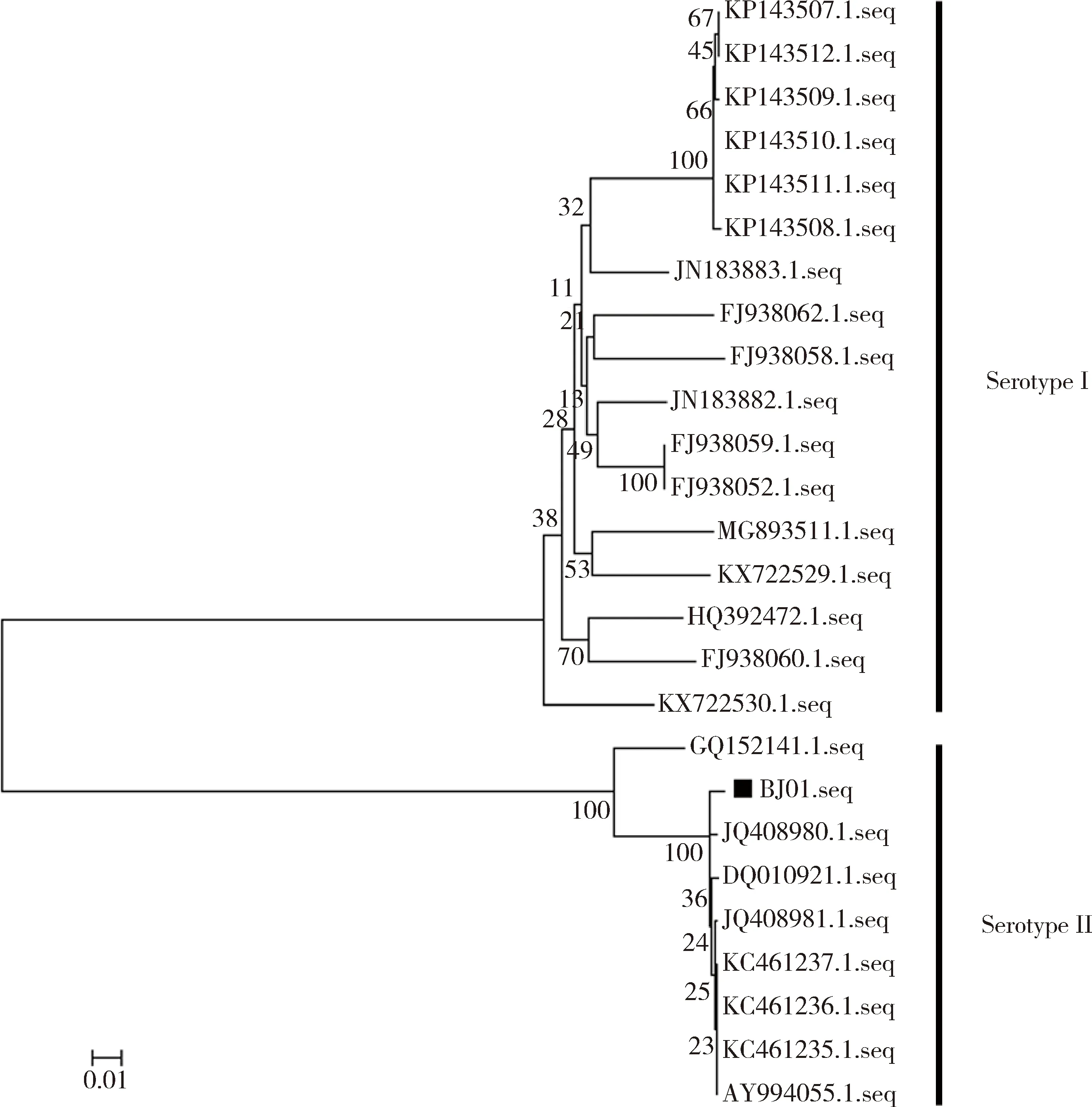
■代表本试验分离毒株
2.4.2 N基因遗传进化分析 基于N基因的遗传进化树结果显示,FIPV/BJ01分离株与美国分离株(KC461237.1、KC461236.1、KC461235.1、AY994055.1)亲缘关系较近,而与中国分离株(MK840958、KYS66208.1、KY566207.1、KY566210.1、KY587337.1、DQ160294.1、KY566206.1)亲缘关系较远(图7)。FIPV/BJ01株与其他分离株核苷酸同源性为45.5%~99.2%。
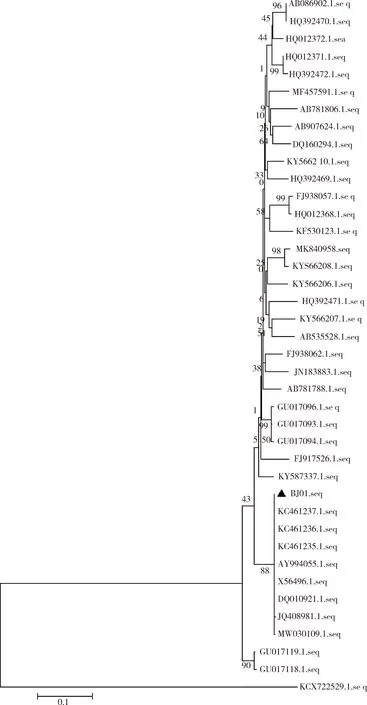
▲代表本试验分离毒株
3 讨 论
猫传染性腹膜炎发病率较低,但是导致猫高死亡率,且世界范围流行,严重危害猫的健康,对宠物行业也造成较大的影响。猫传染性腹膜炎目前尚无有效的预防、治疗措施。FIPV是导致猫传染性腹膜炎发生的病原,与猫泛白细胞减少症病毒、猫疱疹病毒和猫杯状病毒是导致猫死亡的四大主要病因[16]。FCoV在猫群中感染较为普遍,但基本不会引起猫患病或仅引起肠道感染,极少数才会发展成为猫传染性腹膜炎。有研究发现猫传染性腹膜炎感染的猫体内病毒突变产生了毒力增强的FCoV,但是致病机制尚不清楚。有学者认为FIPV是由FECV内部突变而来,但这一理论也遭到其他学者的质疑[17-18]。
目前国内对FIPV的报道较少,本研究成功分离得到一株FIPV/BJ01分离株,属于FCoV-Ⅱ血清型,测定病毒滴度为105.5TCID50/0.1mL。本研究针对分离的FIPV的部分S基因和完整的N基因序列进行遗传进化分析和核苷酸同源性分析,结果表明FIPV/BJ01分离株与美国分离株亲缘关系较近,而与中国分离株亲缘关系较远,说明该病例可能是由于国外毒株输入引起的。研究证明,猫感染FCoV-I是最为普遍,在欧美国家流行率可达80%~95%,而FCoV-Ⅱ的感染却很少见,但在亚洲各国FCoV-Ⅱ感染率达到25%[19-20]。有研究报道FCoV-Ⅱ是由FCoV-I和犬冠状病毒重组产生,相对容易在细胞中增殖并导致细胞病变[21]。本研究中分离到的毒株为后续开展相关研究奠定了基础。

