南京市某地区大气多环芳烃污染及空气微生物多样性相关分析
朱宇琪,吴 昊,热那古力·吾斯曼江,沈梦凡,谈依婷,李 玥,王 丽,吴 倩
南京医科大学公共卫生学院卫生检验与检疫学系,江苏 南京 211166
多环芳烃(polycyclic aromatic hydrocarbon,PAH)是含有两个或两个以上苯环的碳氢化合物,主要来源于化石燃料、木材等有机物的不完全燃烧,广泛存在于大气、水、土壤等环境中[1]。可通过呼吸、饮食、皮肤接触等多种途径进入人体,也可经胎盘传给婴儿[2],具有高生物蓄积性、半挥发性和持久性的特点。随着经济的快速发展,特别是城市人口和机动车的迅猛增长,家庭燃煤取暖和汽车尾气排放等因素使得PAH 成为我国城市空气中不容忽视的重点污染物之一[3-5]。长期慢性暴露PAH 会诱发DNA加合物的形成[6]、染色体畸变,可引起成人和儿童肺功能下降,增加慢性阻塞性肺病的发病率和死亡率[7-9]。不同于SO2、NO2、CO、O3、PM2.5和PM10等空气污染物的强制性监测,大气中PAH的含量目前在我国暂无权威官方数据发布。最近有报道称,PAH污染可改变与健康结局相关的共生和环境细菌的种类和丰度,导致微生物种群的失衡,进而危及人体健康[10]。因此,本研究通过分析大气PAH含量与空气微生物种群的相关关系,为评估大气PAH健康风险提供科学依据。
1 材料和方法
1.1 材料
利用KC-120H 型智能中流量TSP 采样器(青岛崂山电子仪器总厂有限公司),玻璃纤维滤膜采集大气中的颗粒态PAH。利用国产JWL-6 撞击式空气生物粒子采样器(常州康华仪器)进行空气微生物取样测定。
1.2 方法
1.2.1 采样点设置
本研究的观测采样点位于南京市江宁区南京医科大学至诚楼外,采样高度为1 m。该区域远离工厂排放源,距离采样点500 m有双向6车道马路。
1.2.2 采样时间
大气PAH采样时间段为2019年4月16日—6月11日、9月20日—11月15日;2020年5月4日—6月7日、9月27日—11月18日每次采样时间为2 h。同时进行空气微生物采集,采集时间为20 min。
1.2.3 大气颗粒型PAH样品采集
采样方法依据《环境空气质量手工监测技术规范》HJ 194-2017。为保证实验精度,滤膜经干燥箱充分干燥处理。采样流量设为100 L/min。采样结束后,玻璃纤维滤膜用锡纸包裹置于干燥箱避光至少24 h,放入-20 ℃冰箱保存待测。每次采样均设置空白。
1.2.4 大气微生物样品采集
采样依据《公共场所卫生检验方法》GB/T 18204.3-2013 第3 部分:空气微生物。采样皿为普通营养琼脂培养基(蛋白胨10.0 g,牛肉浸出粉3.0 g,氯化钠5.0 g,琼脂15.0 g/L)。采样流量设为28 L/min。采样结束后,平皿于37 ℃培养48 h,之后用生理盐水冲洗,收集冲洗液,8 000 r/min室温离心5 min,去上清,沉淀于-80 ℃保存待测。
1.2.5 样品检测
大气PAH浓度测定:使用镊子和不锈钢剪刀将滤膜对半剪开,待测样品置于干净的锥形瓶中,加入50 mL 二氯甲烷、40 μL 1 μg/mL 的内标(菲Phed10,屈Chr-d12,Supelco公司,美国),密封超声萃取40 min(80%超声强度),10 mL 上清液移入试管,40 ℃氮气浓缩近干,用200 μL二氯甲烷定容。实验前,所有玻璃仪器须用色谱纯甲醇浸泡,后用色谱纯二氯甲烷润洗。标准曲线的配制:用二氯甲烷稀释20 μg/mL 标准品到100、50、10、5、1 ng/mL(分别加50 μL 1 μg/mL 的内标),上机测定以同位素为内标进行校准。GC-MS 气相色谱-质谱联用仪(TRACE 1310,赛默飞世尔科技公司,美国),色谱柱(DB-5MS,30 m,液膜厚0.25 μm,内径0.25 mm)。升温程序:初始柱温80 ℃,保持2 min,8 ℃/min升至300 ℃,保持此温度10 min。载气:高纯氦气;流速:1.0 mL/min;进样量:2 μL;进样口温度:260 ℃;进样方式:不分流进样。离子源:EI;离子源温度:280 ℃传输线温度280 ℃;扫描方式:SRM扫描。对EPA 16种优控PAH的混合标准溶液(20 μg/mL,Supelco 公司,美国)进行浓度测定:萘Nap、苊烯Any、苊Ana、芴Flu、菲Phe、蒽Ant、荧蒽Fla、芘Pyr、苯并[a]蒽BaA、屈Chr、苯并[b]荧蒽BbF、苯并[k]荧蒽BkF、苯并[a]芘BaP、茚并[1,2,3-cd]芘InP、二苯并[a,h]蒽DBA、苯并[g,h,i]苝BgP。Phe-d10 和Chr-d12 回收率分别为66.8%和123.7%。每次采样时均采用野外空白,将空白滤膜放置于采样器旁,与其他样品处理方法相同,最后扣除空白浓度。13种PAH的仪器检出限在0.02~0.20 ng/mL(其中萘、苊烯和苊回收率不佳,未纳入计算)。
空气微生物多样性分析:根据E.Z.N.A.®soil 试剂盒(Omega Bio-tek 公司,美国)说明书进行总DNA抽提。采用引物(338F:5′-ACTCCTACGGGAGGCAGCAG-3′;806R:5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA 基因的V3-V4 可变区进行PCR扩增(ABI GeneAmp®9700型)。扩增体系为20 μL:4 μL 5×Fast Pfu 缓冲液,2 μL 2.5 mmol/L dNTPs,0.8 μL 引物(5 μmol/L),0.4 μL Fast Pfu 聚合酶,10 ng DNA模板。PCR条件如下:95 ℃变性3 min,27次循环(95°C 30s变性,55 ℃30 s退火,72 ℃45 s延伸),最后72 ℃10 min。PCR 产物经回收后纯化。利用Miseq PE300(Illumina 公司,美国)平台进行测序(上海美吉生物医药科技有限公司)。原始测序序列使用Trimmomatic 软件质控,使用FLASH软件进行拼接。使用UPARSE 软件(version 7.1,http://drive5.com/uparse/),根据97%的相似度对序列进行OTU 聚类;使用UCHIME 软件剔除嵌合体。利用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对Silva 数据库(SSU123),设置比对阈值为70%。数据分析在上海美吉生物医药科技有限公司旗下的免费在线I-Sanger云平台(www.i-sanger.com)上进行。
1.3 统计学方法
采用SPSS 21.0 软件对大气PAH 浓度与空气微生物种群进行Pearson 相关性分析,P<0.05 为差异有统计学意义。
2 结果
2.1 大气PAH浓度分析
分析了2019—2020 年南京某地区大气中13 种PAH的浓度,13种PAH根据芳烃环数不同分为3环(芴Flu、菲Phe、蒽Ant),4 环(荧蒽Fla、芘Pyr、苯并[a]蒽BaA、屈Chr),5环(苯并[b]荧蒽BbF、苯并[k]荧蒽BkF、苯并[a]芘BaP),6 环(二苯并[a,h]蒽DBA、茚并[1,2,3-cd]芘InP、苯并[g,h,i]苝BgP)。采用的收集方法,主要是针对颗粒态PAH,其中萘、苊烯和苊回收率不佳,未纳入计算。大气PAH中菲Phe、荧蒽Fla和芘Pyr占主要成分。2019年秋季大气PAH浓度明显高于春季。2020年春秋两季大气PAH浓度无明显差异(图1A、1B,表1)。
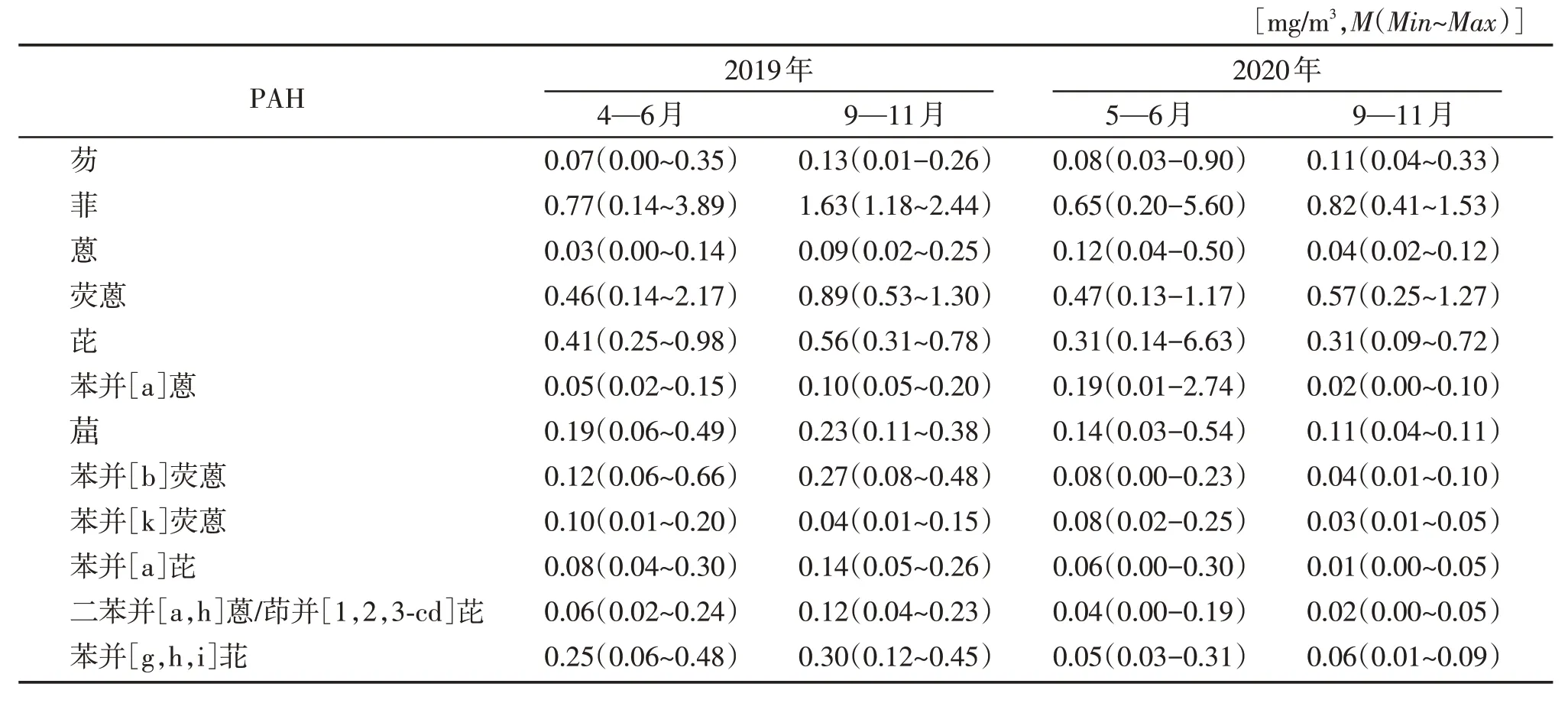
表1 2019年和2020年大气中13种PAH的浓度范围Table 1 The concentration range of 13 PAHs in the atmosphere in 2019 and 2020
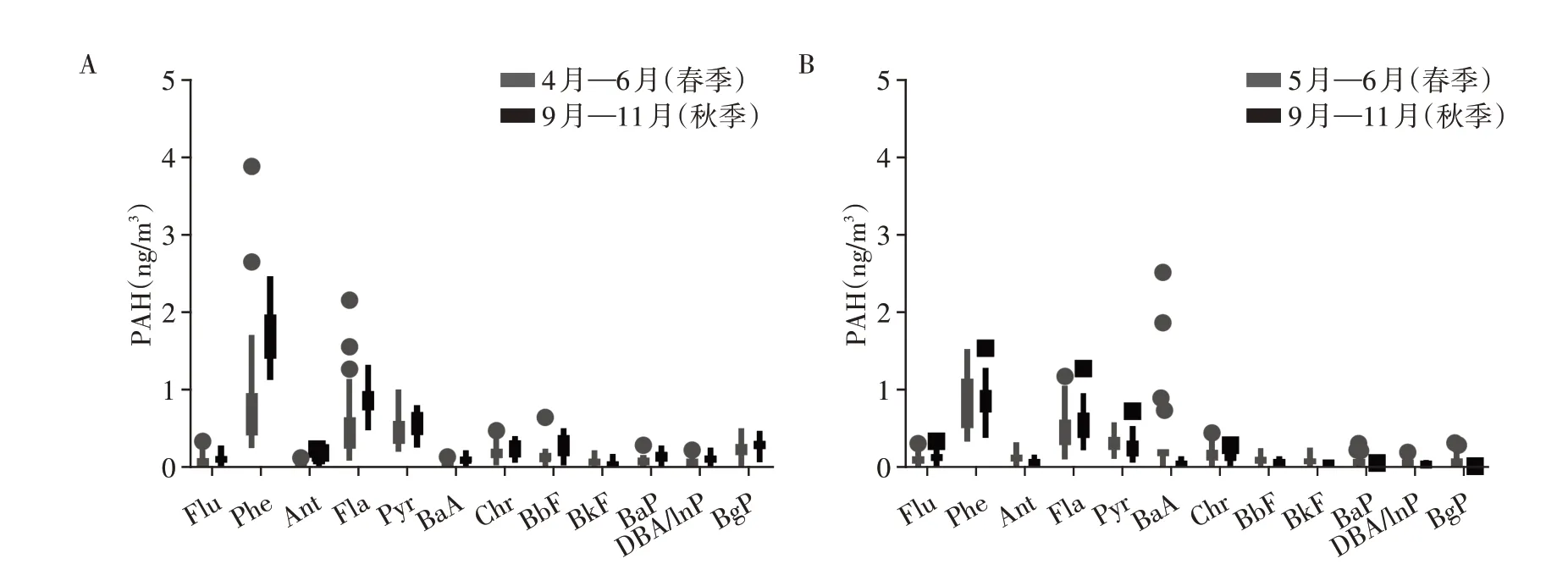
图1 2019年和2020年春季与秋季大气PAH浓度Figure 1 Atmospheric PAH concentrations in spring and autumn of 2019 and 2020
2.2 空气中微生物群落组成
2019年与2020年微生物多样性分析可知,在微生物门水平上,2019年和2020年优势菌门均为厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)和变形菌门(Proteobacteria)(图2A、B)。
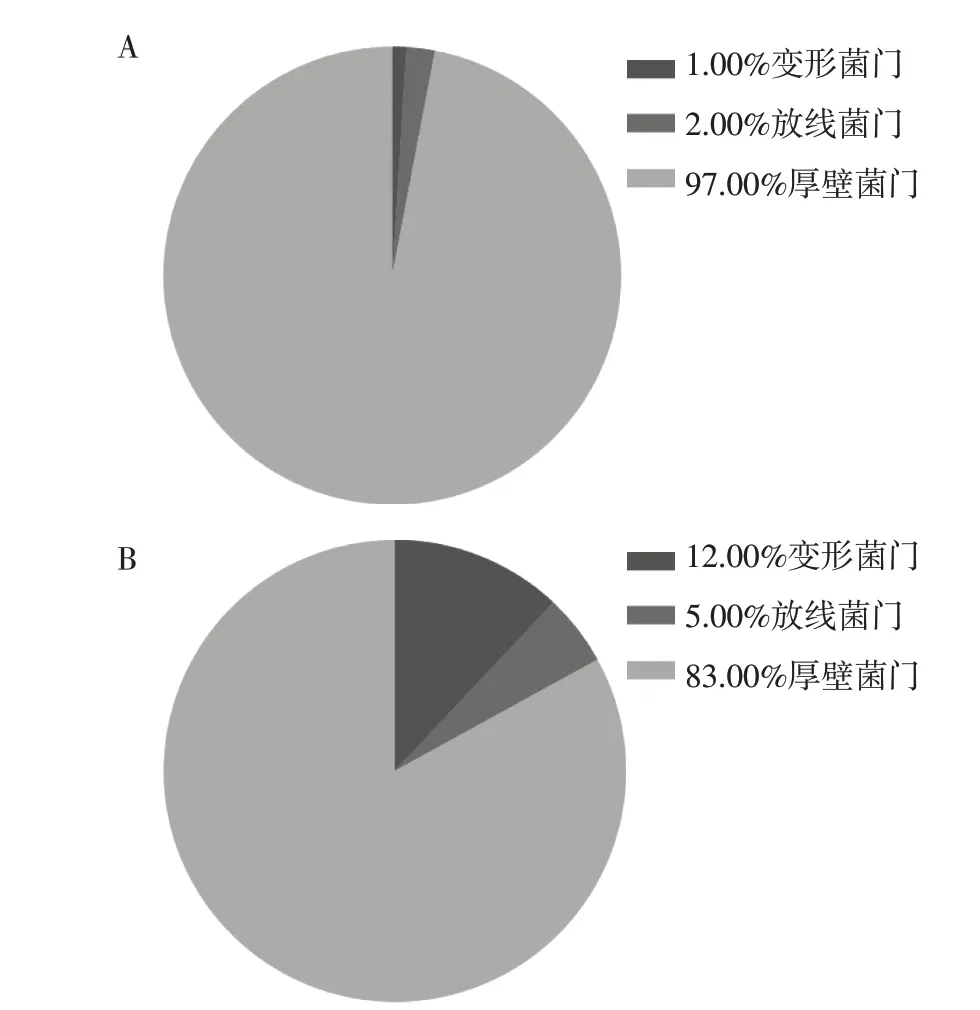
图2 2019年和2020年大气中微生物门水平上的相对丰度Figure 2 Relative abundance of microbiota in the atmosphere at the phylum level in 2019 and 2020
2019、2020年微生物属水平分析可知,2019年优势菌属为芽胞杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)和微球菌属(Micrococcus)。2020 年则为芽胞杆菌属(Bacillus)和虚构芽胞杆菌属(Fictibacillus)。其中,芽胞杆菌属为2019和2020年共同优势菌属(图3A、3B)。

图3 2019年和2020年空气中微生物属水平上的相对丰度Figure 3 Relative abundance of microbiota in the atmosphere at the genus level in 2019 and 2020
2.3 大气PAH与微生物群落相关性分析
将2019年和2020年的大气PAH浓度分别与微生物属水平进行Pearson 相关分析可知,2019 年在属水平上,芽胞杆菌属(Bacillus)与Fla 和总PAH 呈正相关;微球菌属(Micrococcus)与BbF、BaP、DBA/InP和BgP水平呈正相关(P<0.05);土壤芽胞杆菌属(Solibacillus)与Chr和BkF水平呈正相关(P<0.05)。2020年属水平上,假芽胞杆菌属(Fictibacillus)与BkF水平呈正相关(P<0.05);不动杆菌属(Acinetobacter)与Flu的水平呈正相关;鞘氨醇单胞菌属(Sphingomonas)与Pyr、BaA和DBA/InP的水平呈正相关(P<0.05);考克氏菌属(Kocuria)的丰度与Chr、BbF、BkF 和Pyr 呈正相关(P<0.05);节杆菌属(Arthrobacter)的丰度与BaA、Chr和Ant的水平呈正相关。
对2019—2020 年属水平大气微生物与PAH 综合进行相关性分析,类芽胞杆菌属(Paenibacillus)丰度与BkF呈正相关(P<0.05);短杆菌属(Curtobacterium)丰度与BaA、Chr 和BaP 呈正相关(P<0.05);赖氨酸芽胞杆菌属与Fla、Chr、BbF、BaP、INP/DBA和BgP均呈正相关(P<0.01);考克氏菌属(Kocuria)丰度与BbF 呈正相关(P<0.05);不动杆菌属(Acinetobacter)与BkF呈正相关;微球菌属(Micrococcus)与土壤芽胞杆菌属(Terribacillus)均与BbF、INP/DBA和BgP呈正相关(P<0.01)。
3 讨论
大气PAH中2~3环PAH为气态,多存在于气相中,而4 环PAH 为过渡态,在颗粒物和气相中均存在,5~7 环的PAH 多存在固相颗粒物中。本研究主要对大气中颗粒态PAH 进行检测分析。据报道,2001—2002 年南京大气中PAH 的平均水平是62.6 ng/m3[11],2014 年为18.9 ng/m3[12]。2013 年8 月我国环保部发布实施6 项空气质量检测标准,国家加快推进大气污染防治。本研究中南京大气2019—2020 年春秋两季检测的13 种PAH 总浓度高达21.74 ng/m3。南京大气PAH均以3、4碳环菲、荧蒽及芘为主。2019年大气PAH平均浓度约7.63 ng/m3,而2020年约3.04 ng/m3。这很可能是受疫情时期停工停产的影响,也有可能与本市的亚热带季风气候有关,其中各季风的来源、太阳辐射强度、降水量等都是影响大气PAH浓度的重要因素[13]。本市颗粒物中的PAH来源与北方燃煤污染城市区别较大,而机动车尾气排放导致的PAH 的增加不容忽视[14]。本研究中,在组分上2019 年大气颗粒态PAH 主要是菲Phe、荧蒽Fla、芘Pyr、苯并[g,h,i]苝BgP、屈Chr 和苯并[b]荧蒽BbF。2020 年苯并[g,h,i]苝BgP、屈Chr和苯并[b]荧蒽BbF水平明显降低,而菲Phe、荧蒽Fla、芘Pyr和苯并[a]蒽BaA的水平显著升高。为了更好地响应十九届四中全会精神,南京市该区对产业结构进行较大调整,对高污染企业(化工、燃煤、铸造、瓦砖等)进行较大力度的整治,持续化解经济高速发展与生态环境之间的矛盾,并在空气质量改善方面取得了一定成绩[15]。
本研究在PAH与微生物种群相关分析中发现,厚壁菌门中的芽胞杆菌属和放线菌门中的微球菌属丰度与大气PAH相关。据报道,PAH能够通过干扰共生微生物的内分泌信号通路,对环境和共生菌群产生一定影响[16]。微球菌属是最常见的PAH 降解细菌分离物之一[17-18]。而芽胞杆菌属与大气中多种PAH浓度呈正相关,芽胞菌属具有降解环境中的萘、菲、屈、芘、苯并[a]芘和苯并[a]蒽的作用[19]。研究者从污泥(长期被焦化废水污染)中分离得到1株芽胞杆菌,在单基质及混合基质条件下,蒽、菲、芘均得到了良好的降解[20]。除此之外,相关研究表明大气中的PAH 水平与环境和机体共生菌群之间存在相关性。1 项在芬兰进行的研究也报道了大气PAH 浓度与托儿所空气中的放线菌门及儿童皮肤菌属之间的联系,并进一步分析发现,其中的差异微生物对内分泌代谢具有干扰作用[21]。Sowada 等[22]在上呼吸道咳嗽综合征、慢性阻塞性肺病、哮喘等患者肺部中发现的优势菌群包括厚壁菌门和放线菌门,提示PAH 污染可通过影响微生物多样性与呼吸道免疫性疾病相关。因此,关注PAH 污染引起的健康相关菌群的变化及健康风险,能够为PAH 的健康风险评价提供基础资料,对实施合理的环境干预手段和健康风险评价具有重要指导意义。

