阻塞性睡眠呼吸暂停低通气综合征患者认知功能与情绪及睡眠结构的关系研究
刘奕姝,谭慧文,曾尹,肖莉,*
本研究价值及局限性:
(1)本研究通过多种量表评估阻塞性睡眠呼吸暂停低通气综合征(OSAHS)患者认知功能,使用多种情绪自评量表反映患者情绪状况,将OSAHS与认知功能、情绪三者相结合,同时对OSAHS患者的多导睡眠检测(PSG)数据进行全面分析,发现其与认知和情绪的关联。(2)着重于PSG中睡眠结构相关数据,除年龄、呼吸暂停低通气指数(AHI)等因素的影响外,还发现睡眠分期中快眼动睡眠(REM)期与认知功能的相关性。为进一步研究REM期对人类大脑的生理影响提供了一定参考依据。本研究局限性在于对情绪的评估和认知功能的测定均来自量表,其结果具有主观性,易出现误差。未来可进一步通过一些认知功能测定程序等客观数据,并结合脑成像技术分析OSAHS对人类大脑结构及功能的影响。
睡眠障碍是现代人普遍存在的现象,这与科技发展后生活习惯改变息息相关。阻塞性睡眠呼吸暂停低通气综合征(OSAHS)是一种常见睡眠障碍疾病,其发病机制是睡眠中上呼吸道反复塌陷、阻塞而发生呼吸暂停和低通气,并出现间歇性低氧血症、高碳酸血症以及睡眠结构紊乱[1]。一直以来OSAHS与认知障碍均是研究的热点问题,OSAHS患者的认知功能损害大多表现在记忆力、注意力、执行力和视空间方面[2]。记忆巩固能力与睡眠过程中大脑活动密切相关,OSAHS导致的睡眠片段化影响了睡眠依赖的记忆巩固[3],通过对脑电活动的研究,人们发现快眼动睡眠(REM)有助于程序性记忆巩固[4],而由于REM期上呼吸道生理变化,控制咽部肌肉舒张的肾上腺素能和5-羟色胺能神经活动下降,使上呼吸道塌陷倾向增加[5],REM期更容易出现呼吸暂停,因此OSAHS对REM期神经生理活动的影响不能忽视,OSAHS患者的认知记忆改变与睡眠结构的相关性是研究的重点。
此外,抑郁,焦虑等情绪问题也常在OSAHS患者中发生。OSAHS患者在经过整夜睡眠后仍会出现日间睡,严重影响日间活动,长期如此则会导致患者的心理状态发生改变。在一篇分析了1995—2006年55篇相关文献的综述中显示,OSAHS患者抑郁的患病率为7%~63%,焦虑的患病率11%~70%[6]。躯体疾病和情绪问题并存对于患者的认知功能是双重考验,相较于未合并抑郁症状的OSAHS患者,合并抑郁症状增加了神经损伤[7]。本研究目的是探索OSAHS患者认知功能与情绪及睡眠监测指标的相关性,从各类他评量表、自评量表和睡眠监测数据中分析OSAHS患者认知功能与情绪及睡眠结构的关系,通过临床经验和临床数据为OSAHS患者认知功能损害的内在机制研究提供依据。
1 对象与方法
1.1 研究对象 选择2019年9月至2020年12月在中国医科大学附属盛京医院睡眠医学中心经多导睡眠监测(PSG)诊断为OSAHS的116例患者为研究对象,平均年龄(44.9±13.3)岁,其中男90例、女26例。纳入标准:(1)符合《国际睡眠障碍分类第3版》中OSAHS的诊断标准[8],即患者主诉有夜间打鼾、日间嗜睡症状,或有目击者报告患者睡眠存在习惯性打鼾、并且经PSG发生阻塞性为主的呼吸事件≥5次/h,这些呼吸事件可能包括阻塞性呼吸暂停、低通气和/或呼吸努力相关的觉醒;(2)能配合完成PSG和量表评估。排除标准:(1)有OSAHS治疗史;(2)有甲状腺功能减退及其他严重慢性疾病史;(3)有除OSAHS以外的睡眠障碍疾病(如中枢性呼吸暂停,发作性睡病等);(4)有痴呆、大面积脑梗死等神经系统疾病;(5)有严重精神疾病及精神发育迟滞病史;(6)长期服用镇静、安眠类药物,有药物依赖史。本研究获得中国医科大学附属盛京医院伦理委员会批准(2019PS516K),患者均已签署知情同意书。
1.2 研究方法 通过电子病历系统获得OSAHS患者的临床资料,包括整夜PSG数据、睡眠监测前填写的患者一般人口学调查表〔包括姓名、性别、年龄、身高、体质量、体质指数(BMI)〕,情绪自评量表〔焦虑症筛查量表(GAD-7)、抑郁症筛查量表(PHQ-9)〕及由专业人员评估的患者认知(记忆)水平资料〔蒙特利尔认知评估量表(MoCA)、记忆与执行筛查量表(MES)〕。应用失眠严重指数量表(ISI)了解患者是否有失眠症状,应用Epworth嗜睡量表(ESS)评估患者日间嗜睡情况。
1.2.1 情绪自评量表、ISI、ESS评估 通过GAD-7评估焦虑状态,该量表有7个测量焦虑症状严重程度的问题,信度为0.887,效度为0.897,总分0~21分,分数越高提示焦虑症状越严重[9]。通过PHQ-9评估抑郁状态,该量表有9个测量抑郁症状严重程度的问题,信度为0.754,效度为0.833,总分0~27分,分数越高提示抑郁症状越严重[9]。GAD-7总分≥5分或PHQ-9总分≥5分认为患者存在情绪问题,GAD-7总分<5分且PHQ-9总分<5分认为患者不存在情绪问题。ISI采用7个项目评估患者失眠情况,总分0~28分,分数越高提示失眠越严重[10]。ESS采用8个问题评估患者日间嗜睡情况,总分0~24分,分数越高提示日间嗜睡越严重。
1.2.2 认知记忆水平评估及分组 使用MoCA评估认知功能,MoCA包括视空间及执行功能(包括交叉连线、复制立方体、画钟表)、命名、注意(包括数字广度、数字辨别、计算)、语言(包括句子重复、词语流畅性)、抽象、记忆(包括即刻记忆、延迟回忆,即刻记忆不计分)和定向7个项目,总分30分,受教育年限≤12年则加1分以校正偏差,灵敏度为67%~100%,特异度为50%~95%[11]。MoCA总分<26分提示有认知障碍;将MoCA总分≥26分的患者纳入认知正常组,MoCA总分<26分的患者纳入认知异常组。
应用MES评估记忆水平,主要包括记忆功能和执行功能两大部分,共7个项目(包括即刻回忆、流畅性、扣指1、短延迟回忆、手指执行能力、扣指2和长延迟回忆),总分100分,灵敏度为79%~88%,特异度为83%~91%[11],评分越低提示记忆力越差。
1.2.3 PSG OSAHS患者均采用Philips Alice 6型PSG进行监测。按照美国睡眠医学会推荐的记录项目,推荐记录的项目主要包括脑电图导联、眼动电图导联、颏肌电图、心电图、口鼻气流、胸腹部运动、指端血氧饱和度、鼾声、腿动等。所有患者夜间至少进行7 h睡眠监测,检查当天嘱患者不饮酒和含咖啡因的饮料,不使用睡眠药物,不进行小睡。结果经计算机处理后再按照美国睡眠医学会睡眠及相关事件判读手册2.3版进行人工判图以确定睡眠分期〔非快眼动睡眠1期(N1期)、非快眼动睡眠2期(N2期)、非快眼动睡眠3期(N3期)和REM期〕,觉醒〔微觉醒、REM期微觉醒、非快眼动睡眠(NREM)期微觉醒〕及呼吸事件(呼吸暂停、低通气)[12];对PSG报告中记录的数据进行统计分析,包括呼吸暂停低通气指数(AHI)〔AHI=(呼吸暂停次数+低通气次数)×60/TST〕、阻塞性呼吸暂停(OA)最长时间、最低血氧饱和度、总睡眠时间(TST)、TS90%(TS90%=血氧饱和度低于90%的时间/TST)、微觉醒指数(微觉醒指数=微觉醒次数×60/TST)、微觉醒总次数、NREM期微觉醒总次数、REM期微觉醒总次数、入睡后清醒时间(WASO)即总记录时间-睡眠潜伏期-TST、睡眠效率(睡眠效率=TST/总记录时间)、睡眠潜伏期(从关灯至第1帧任何睡眠期的时间)、N1/TST%、N2/TST%、N3/TST%、REM/TST%等。
1.3 统计学方法 采用SPSS 23.0统计学软件进行数据分析,符合正态分布的计量资料以(±s)表示,两组间比较采用两独立样本t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用非参数检验;计数资料以相对数表示,组间比较采用χ2检验。采用Person相关分析/Spearman秩相关分析进行变量间的相关性分析。采用逐步回归法建立最终多元线性回归模型。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料比较 116例OSAHS患者平均BMI为(28.4±4.20)kg/m2,平均AHI为(39.3±23.4)次/h;MoCA总分13~30分,平均(26.5±3.6)分;MES总分20~100分,平均(89.6±11.6)分。情绪方面,GAD-7得分0~21分,总分≥5分者占38.8%;PHQ-9得分0~20分,总分≥5分者占47.4%。根据MoCA总分分为两组,其中认知正常组(MoCA总分≥26分)患者79例,认知异常组(MoCA总分<26分)患者37例。两组GAD-7评分、PHQ-9评分、ESS评分、ISI评分、BMI、AHI、OA最长时间、最低血氧饱和度、TS90%、微觉醒指数、睡眠潜伏期、N1/TST%、N2/TST%比较,差异无统计学意义(P>0.05);两组年龄、性别、MES评分、微觉醒总次数、NREM期微觉醒总次数、REM期微觉醒总次数、TST、WASO、睡眠效率、N3/TST%和REM/TST%比较,差异有统计学意义(P<0.05),见表1。
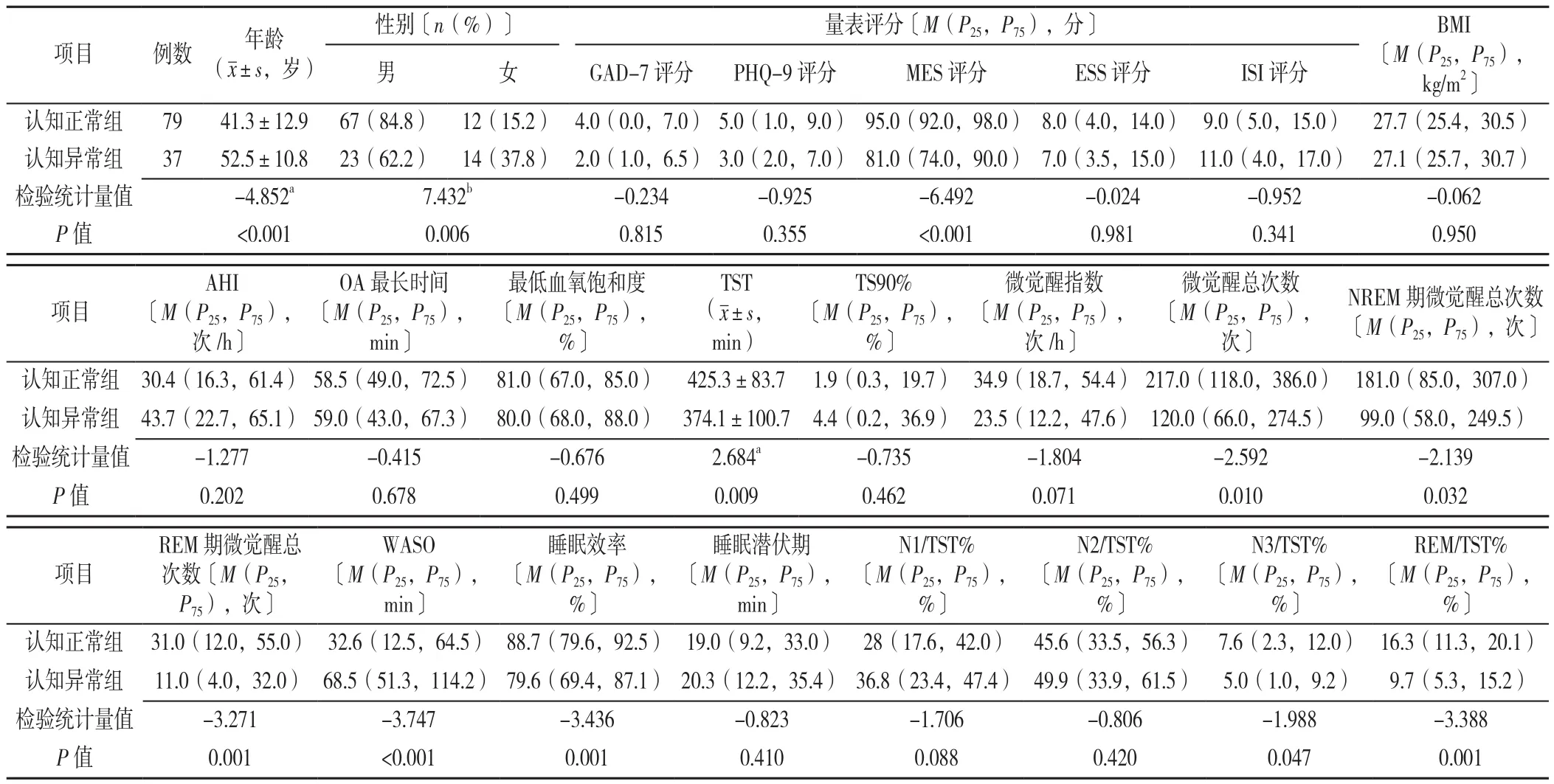
表1 认知正常组与认知异常组OSAHS患者的临床资料的比较Table 1 Comparison of clinic data between normal and abnormal cognition groups
2.2 相关性分析 Pearson相关分析/Spearman秩相关分析结果显示,MoCA总分与年龄、AHI、WASO呈负相关(P<0.05),与TST、睡眠效率、REM/TST%、微觉醒总次数和REM期微觉醒总次数呈正相关(P<0.05);MoCA中延迟回忆得分与年龄、WASO呈负相关(P<0.05),与睡眠效率、REM/TST%、微觉醒总次数和REM期微觉醒总次数呈正相关(P<0.05);MES总分与年龄呈负相关(P<0.05),与REM/TST%、微觉醒总次数、NREM期和REM期微觉醒总次数呈正相关(P<0.05),见表2。
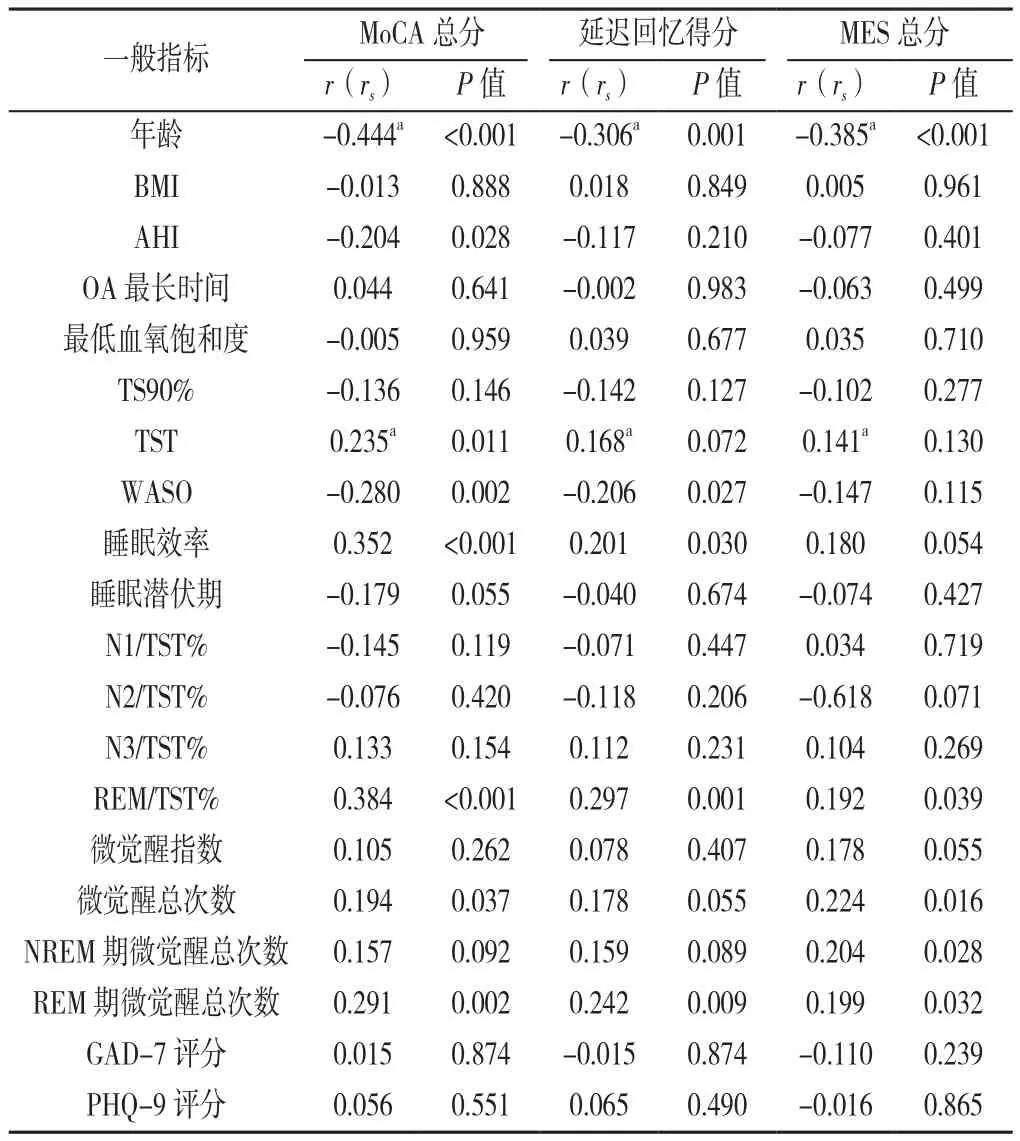
表2 OSAHS患者认知功能与一般指标的相关性分析Table 2 Correlation analysis of the relationship of cognitive function with general indicators in OSAHS patients
2.3 多元线性回归分析 分别以MoCA总分,延迟回忆得分及MES总分为因变量(赋值均为实测值),以年龄、AHI、TST、WASO、睡眠效率、REM/TST%、微觉醒总次数及REM期微觉醒总次数为自变量(赋值均为实测值)进行多元线性回归分析,结果显示,年龄、AHI和REM/TST%为MoCA总分的影响因素(P<0.05),年龄为延迟回忆得分及MES总分的影响因素(P<0.05),见表3。再通过逐步回归法得出最终的回归模型,发现MoCA总分与年龄和REM/TST%相关性更强,MoCA总分与年龄呈负相关(P<0.05),而MoCA总分与REM/TST呈正相关(P<0.05),见表4。
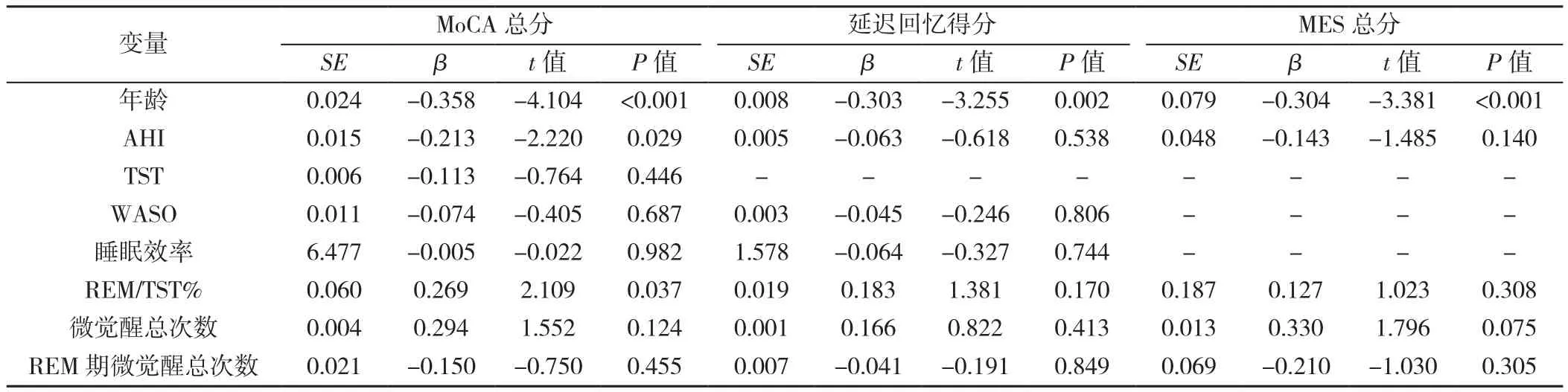
表3 OSAHS患者认知功能影响因素的多元线性回归分析Table 3 Multiple regression analysis of the relationship of MoCA score and delayed recall score in MoCA with MES score and PSG indicators in OSAHS patients
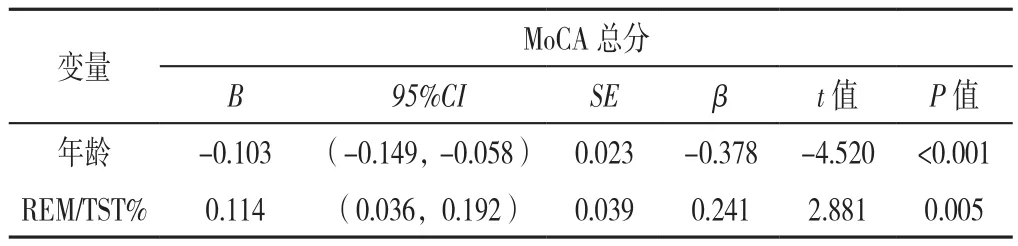
表4 用逐步回归法建立的最终回归模型Table 4 Final regression model obtained with stepwise regression
3 讨论
大脑调节人类的高级神经活动,如意识、精神、情绪、语言、学习、记忆等。OSAHS患者易出现多系统损害,包括神经系统损害。有研究认为大脑在睡眠期间脑脊液的流动较日间更活跃,由于脑脊液的流动是脑内有毒蛋白代谢物的神经“泵”,并以此来清除日间脑细胞的代谢产物,使精力重新恢复[13],因此OSAHS影响患者睡眠时大脑的神经生理活动,大脑对认知的影响、对情绪的调节发生改变,OSAHS、睡眠、认知、情绪四者之间的关系如同大脑的神经网络通过多种神经递质相互关联。本研究的目的是探讨OSAHS患者认知功能与情绪、睡眠结构的关系,探讨OSAHS患者认知功能的可能影响因素。
OSAHS影响认知功能,包括记忆力、注意力和执行功能,这种影响可从患者的自我报告中发现,如难以集中注意力、健忘、工作中无法做出决定等;OSAHS造成的夜间低氧影响大脑组织细胞氧供,从而出现认知功能减退,一般认为夜间缺氧程度越严重,认知功能减退越明显[14]。同时患者也经常报告情绪变化,包括易怒、疲劳、抑郁和焦虑[15]。流行病学研究表明抑郁症是痴呆的独立危险因素,抑郁症会导致痴呆症患者认知功能加速衰退[16],故推测抑郁等情绪问题可能会加速OSAHS患者的认知功能减退。既往研究对OSAHS与情绪之间的关系结论不一致,有研究发现随着OSAHS严重程度增加,焦虑抑郁个体反而减少[17],在对2 271例睡眠呼吸紊乱患者的研究中发现OSAHS的存在与抑郁和焦虑情绪无关[18];但另有研究认为OSAHS与抑郁相关,OSAHS患者的抑郁情绪可以解释为睡眠片段化的直接后果[19]。因此OSAHS患者认知功能与情绪的关系可能并非单一线性正相关。LEE等[20]研究了伴抑郁症状OSAHS患者自传式记忆的改变,认为伴抑郁症状OSAHS患者与无症状患者在自传式记忆障碍上无差异,无论抑郁症状的轻重,均难以回忆特定的自传式记忆;OSAHS患者的自传式记忆损害可能不是情绪影响的,而是疾病本身的长期损害造成的。本研究结果也发现相较于认知功能正常的OSAHS患者,伴有认知功能异常的OSAHS患者情绪评分未发现明显差异。OSAHS患者认知功能与情绪的关系仍不明确,分析可能与多种因素有关,如患者认知功能的基线水平、情绪问题的判断标准、情绪问题的持续时间、情绪问题与认知障碍的因果关系、样本量等,这需要开展长期的详细的随访研究。
OSAHS患者睡眠过程中病理生理改变包括:(1)间歇性低氧血症,有研究发现OSAHS患者脑脊液中β-淀粉样蛋白1-42水平降低,乳酸水平升高;β-淀粉样蛋白1-42被认为是与阿尔兹海默病(AD)有关的蛋白,其沉淀蓄积后具有神经毒性作用,乳酸用来评估神经元能量代谢,二者可能与OSAHS患者认知功能改变相关[21]。然而在动物实验中发现间歇性低氧血症明显减少了AD小鼠模型海马中β-淀粉样蛋白斑块的数量,提高了AD小鼠的认知功能[22]。在动物模型中,缺氧可能通过氧化和炎性反应增加细胞凋亡和海马萎缩[23],本研究中未发现认知功能与最低血氧饱和度、TS90%等之间的相关性,但发现MoCA总分与AHI之间呈负相关,建立逐步多元线性回归模型后发现,MoCA总分与AHI无相关性。在两项针对年龄>65岁和79~97岁的老年男性进行的横断面研究中,没有发现AHI与认知功能之间的关联[24-25]。以上研究说明间歇性低氧血症对认知功能的影响仍不明确。(2)睡眠片段化,慢性睡眠剥夺会对脑脊液清除有毒物质的活动造成破坏,可能产生β-淀粉样蛋白等有毒物质蓄积,影响认知功能。此外,OSAHS患者睡眠结构改变如慢波睡眠(SWS)与REM期的减少被认为与认知功能减退相关[26]。随着年龄的增长,睡眠结构发生相应的改变,SWS和REM期减少[27],这一变化与老年人认知功能的减退是否有直接联系仍待研究。本研究发现,OSAHS患者认知功能与REM/TST%相关,REM期与MoCA总分呈正相关,REM期减少则认知功能下降。REM期是睡眠分期中较为特殊的一期,其在脑电图上的表现与N1期相似,伴随快速眼球运动,但REM期生理变化与NREM期不同,表现为全身骨骼肌活动受抑制、自主神经兴奋、呼吸心跳加快、体温调控消失。在20世纪60年代,人们开始对REM期进行研究,认为REM期剥夺会导致焦虑和认知障碍,大量研究也表明REM期是记忆巩固的重要时期,REM期剥夺损害陈述性记忆和程序性记忆[28]。但有研究对曾因颅脑损伤出现REM期缺失患者进行研究,并通过脑成像分析确定该患者为桥脑损伤所致REM期缺失,然而长期REM期缺失并未引起明显认知障碍[29]。故REM期剥夺对认知功能的影响因其成因不同而不同。OSAHS患者睡眠期间的神经生理活动破坏所产生的影响是患者所关心的问题,也是研究的热点。有研究通过对OSAHS患者的脑成像进行分析发现,涉及多个认知领域的区域存在组织损伤,且这些损伤与年龄、性别、吸烟和心血管疾病无关,因此推测OSAHS可能增加特定脑结构对病理损伤的敏感性而加速脑老化进程,造成认知功能减退[30]。
综上所述,本研究并未发现OSAHS合并认知障碍的患者情绪有明显异常。OSAHS患者认知功能下降与年龄、REM期相关。未来应通过脑成像技术分析大脑的结构,进一步明确认知功能与睡眠结构之间关联的内在原因,为治疗认知功能减退、延缓病情进展提供更多思路。
作者贡献:刘奕姝进行研究设计与实施、撰写论文并对文章整体负责;谭慧文和曾尹进行资料收集与整理;肖莉进行研究评估,负责文章质量控制及审校。
本文无利益冲突。

