老年睡眠呼吸暂停综合征诊断评估专家共识
中国老年医学学会睡眠医学分会
睡眠呼吸暂停综合征(sleep apnea syndrome,SAS)是以睡眠中发生异常呼吸事件为特征的一组疾病,伴或不伴清醒期呼吸功能异常。SAS是睡眠障碍中仅次于失眠的第二大类疾病[1]。文献资料显示,普通人群SAS发病率为5%,中年以上人群达20%~40%,据估计我国SAS患者超过4 000万,其主要危害是造成脑、心、肾、肺等重要脏器损害,影响患者的劳动能力和生活质量,严重时可影响寿命[2]。2020年全国第七次人口普查显示,我国总人数超过14.1亿,60岁及以上老龄人口占比达18.7%。老年人群数量庞大,SAS发病率明显增高,并随年龄增长呈上升趋势,衰弱老年人SAS发病率高达60%,合并症多,由此诱发的多种脏器疾病达84种。老年SAS患者中枢型呼吸暂停及低通气发生率增加[3],但因老年SAS临床症状不典型、准确采集病史难度高,并发症易与老龄相关的功能退化相混淆,临床上常易被忽略,造成漏诊。因此,对于老年人这一特殊人群的睡眠呼吸暂停,医师、患者、全社会均应予以重视。
目前国外针对老年人群睡眠障碍的指南/共识包括2017年国际老年睡眠医学工作组专家共识——《老年人以及体弱老年人睡眠障碍性呼吸的治疗》[4]、2018年印度精神病学学会临床实践指南——《老年睡眠呼吸障碍的管理》[5]。但上述指南/共识纳入研究人群大多数为欧美人群,重点在于呼吸障碍的治疗,指导我国临床实践时存在一定局限性。国内暂无针对老年SAS的诊治指南及专家共识。为规范中国老年SAS的诊断评估标准,由中国老年医学学会睡眠医学分会组织专家组,基于国内外老年SAS诊治进展,结合国内临床诊疗现状,广泛征求专家组专家意见,经反复讨论后制订本共识。
1 老年SAS分类
老年SAS根据多导睡眠监测(PSG)结果可分为阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)与中枢性睡眠呼吸暂停(central sleep apnea,CSA)。OSA是指睡眠过程中发生的完全性上气道阻塞(呼吸暂停)或部分性上气道阻塞(低通气),伴有打鼾、睡眠结构紊乱、动脉血氧饱和度(SaO2)下降、白天嗜睡等表现的临床综合征[6]。CSA指睡眠中呼吸暂停时口和鼻气流以及胸、腹呼吸运动同时停止,引起低氧血症、高碳酸血症、睡眠片段化,从而使机体发生一系列病理生理改变的综合征。CSA根据临床特征不同分为以下6种类型[7]。
1.1 伴陈施呼吸CSA 主要见于慢性心力衰竭患者,少部分继发于卒中或某些神经系统疾病或肾衰竭。心力衰竭患者发生陈施呼吸的危险因素包括男性、年龄60岁以上、心房颤动病史、白天低碳酸血症〔二氧化碳分压(PaCO2)≤38 mm Hg(1 mm Hg=0.133 kPa)〕等。PSG表现:可见陈施呼吸,周期常 >40 s。
1.2 疾病所致不伴陈施呼吸CSA 常继发于血管性、肿瘤性、退化性、脱髓鞘性病变或创伤性损伤所造成的不同程度的脑干功能障碍,可导致呼吸调控机制受损。PSG表现:可见明显呼吸异常表现,如共济失调呼吸模式,表现为呼吸节律及呼吸幅度/潮气量均不规则,一般呼吸的持续时间≤5个呼吸周期,且不符合陈施呼吸标准。
1.3 高原性周期性呼吸致CSA 诊断主要依据近期登高原史及PSG表现,应排除其他类型CSA。PSG表现:CSA主要出现在非快速眼球运动睡眠,持续时间较短,周期性呼吸周期常<40 s。
1.4 药物或物质致CSA 诊断需有阿片类或其他呼吸抑制剂使用史。PSG表现:主要表现为共济失调呼吸——呼吸频率和潮气量变异,睡眠期呼吸频率减慢,间断中枢型呼吸暂停(包括N3期)或周期性呼吸伴中枢型呼吸暂停,觉醒少见,N3期可能增加,部分患者非快速眼球运动睡眠呼吸暂停低通气指数(apnea hypopnea index,AHI)明显大于快速眼球运动睡眠。
1.5 原发性CSA 较少见,病因未明,应明确排除其他潜在因素导致的CSA。PSG表现:周期性CSA后紧接着均匀的深大呼吸,周期较短。
1.6 治疗相关CSA OSA患者接受不设后备频率持续气道正压通气(continous positive airway pressure,CPAP)治疗过程中,阻塞型呼吸事件消失后出现中枢型呼吸事件。PSG表现:阻塞型呼吸事件消失后,突然或持续出现中枢型呼吸暂停或低通气,符合以下条件:中枢型呼吸暂停/低通气事件≥5次/h;中枢型呼吸暂停和低通气事件占总呼吸暂停低通气事件的50%以上。
2 老年SAS主要危险因素
尽管老年人睡眠呼吸紊乱的易患因素与中年人并无不同,但功能性因素在发病中起着更重要的作用。
2.1 老年OSA的主要危险因素[8-10](1)年龄:老龄化可使OSA发生风险增高,年龄增加OSA发生风险的高危因素包括:咽部肌肉张力减弱、咽腔顺应性增加、咽腔局部反射活动减弱、咽腔缩小、短暂觉醒的次数增加、睡眠稳定性减弱、呼吸调节功能不稳定。(2)性别:绝经后老年女性呼吸紊乱发生率与男性并无明显差别。(3)家族史。(4)长期吸烟。(5)肥胖:体质量超过标准体质量的20%或以上,即体质指数(body mass index,BMI)≥28 kg/m2。肥胖仍然是老年SAS的易患因素,但BMI的影响强度明显减弱。(6)上气道解剖异常:包括鼻腔阻塞(鼻中隔偏曲、鼻甲肥大、鼻息肉及鼻部肿瘤等)、Ⅱ度以上扁桃体肥大、软腭松弛、悬雍垂过长或过粗、咽腔狭窄、咽部肿瘤、咽腔黏膜肥厚、舌体肥大、舌根后坠、下颌后缩及小颌畸形等。(7)颞下颌关节紊乱症(temporomandibular disorders,TMD)及无牙颌:合并TMD的患者呼吸努力相关性微觉醒次数明显增加,睡眠障碍比例较高[11]。无牙颌是否为OSA的诱发因素尚无定论[12]。(8)老年衰弱:老年衰弱主要根据Fried衰弱评估方法(表1),从体质量下降、步速减慢、肌力减弱、低体能、疲乏5个方面进行评估,同时满足3项及以上即为衰弱。老年睡眠呼吸障碍与衰弱呈正相关[13]。(9)长期大量饮酒和/或服用镇静催眠类或肌肉松弛类药物。(10)部分降低肺顺应性的肺部疾病,或任何减少膈肌运动的疾病。(11)其他相关疾病。

表1 Fried衰弱评估方法Table 1 Fried's frailty phenotype
2.2 老年CSA的主要危险因素[14](1)长期阿片类或其他呼吸抑制药物使用史:阿片类药物可以剂量依赖性的方式诱导睡眠时以低氧血症为主的CSA。(2)近期登高原史:进入高海拔低氧环境时,引发的呼吸频率和深度快速交替,并且伴随呼吸暂停,甚至低通气等呼吸模式的转变,这种呼吸模式称为高原性周期性呼吸,其严重程度随海拔高度的增加而增加。(3)心血管疾病:导致心力衰竭的严重心血管疾病,例如高血压、冠状动脉疾病和心房颤动,可能会使CSA恶化。(4)脑血管意外:CSA被认为是广泛性脑血管意外的特征性后遗症,可在卒中后即刻被发现,恢复后3~6个月明显下降。(5)帕金森病:帕金森病患者CSA患病率为20.9%~66.6%。(6)其他内科疾病或神经系统疾病:肢端肥大症患者CSA患病率与疾病活动有关;终末期肾病患者CSA的患病率取决于夜间的透析程序和体液移位。
3 老年SAS诊断及评估方法
老年SAS综合评估包括:(1)完整的睡眠历史记录;(2)从家人或床伴处获得相关信息;(3)明确有无精神疾病、服用处方药、饮酒及认知功能障碍的详细信息;(4)详细的体格检查;(5)整夜PSG或家庭睡眠呼吸暂停监测(home sleep apnea test,HSAT);(6)CSA多见,需重视呼吸运动监测;(7)老年患者合并其他疾病概率增高,应仔细评估并发症及合并症。目前常用诊断评估方法包括以下几种。
3.1 临床症状评估 老年SAS临床症状的特殊性包括:(1)临床症状不典型,随年龄增长可表现为鼾声降低甚至无打鼾;(2)夜间憋醒发生率明显降低;(3)主诉失眠或睡眠不宁的比例增加;(4)夜尿次数增多是老年SAS常见的症状之一;(5)记忆力减退、认知功能改变易与老龄相关的功能退化相混淆,从而忽略了SAS的诊断。
3.1.1 OSA的症状 OSA的症状包括睡眠时打鼾、他人目击的呼吸暂停和日间嗜睡、并发症及全身靶器官损害表现[15]。睡眠时打鼾、他人目击的呼吸暂停和日间嗜睡表现:(1)夜间表现:打鼾、呼吸暂停、憋醒、夜尿增多、睡眠行为异常等。(2)日间表现:嗜睡、疲倦乏力、认知功能障碍、头痛头晕、个性变化等。(3)并发症及全身靶器官损害的表现:高血压、冠心病、心律失常、肺动脉高压、缺血性或出血性脑卒中、代谢综合征、心理异常和情绪障碍等。
3.1.2 CSA的症状 CSA的症状包括高碳酸CSA及非高碳酸CSA的症状[16],见表2。高碳酸CSA表现为呼吸暂停和呼吸减弱,包括:(1)潜在的通气不足特征:晨起头痛、肺源性心脏病、周围性水肿、红细胞增多症、肺功能异常;(2)睡眠呼吸暂停或呼吸减弱症状:夜间睡眠质量差、打鼾、日间嗜睡。非高碳酸CSA主要症状各不相同:可以表现为打鼾和日间嗜睡,还可以表现为失眠及夜间睡眠质量差。

表2 高碳酸CSA与非高碳酸CSA临床特点比较Table 2 Comparison of clinical features between hypercapnic and nonhypercapnic central sleep apnea
3.1.3 老年OSA与CSA临床症状 老年OSA患者通常伴有肥胖,睡眠时很少觉醒,鼾声很大,多有日间嗜睡,可引起晨起头痛、夜间遗尿、智力损害。老年CSA患者通常体型正常,睡眠时经常觉醒,轻度、间歇性打鼾,嗜睡少见,主要以失眠为主,可引起抑郁等情况。
3.2 体格检查 包括身高、体质量、颈围、气道评估、鼻咽部特征、扁桃体、舌体大小、是否无牙颌状态等。
3.3 实验室检查方法
3.3.1 PSG 睡眠中心由专业技师行PSG,对所有怀疑SAS的老年患者应根据临床情况进行整夜PSG。对存在明显OSA临床表现而急需治疗的患者,或前半夜PSG显示阻塞型呼吸事件持续时间过长、引发严重低氧、可能发生意外的OSA患者,或只能在睡眠实验室接受1夜诊治的患者,行分段诊断滴定:即前半夜诊断,后半夜压力滴定[17]。PSG是诊断OSA、评估其严重程度和鉴别伴随OSA的其他睡眠疾病的标准诊断,包括脑电图(多采用F3-M2、F4-M1、C4-M1、C3-M2、O1-M2和O2-M1导联),两导眼动图,下颌肌电图,心电图,口、鼻呼吸气流和胸腹呼吸运动,血氧饱和度,体位,鼾声,胫前肌肌电图等。临床上常用的温度传感器能准确判断呼吸暂停,但对低通气事件的判断不够敏感。鼻压力传感器比温度传感器更能准确监测和判断低通气事件。PSG同步记录呼吸努力是鉴别呼吸暂停低通气事件是中枢型还是阻塞型的主要方法,临床上常用胸腹带记录呼吸运动来反映呼吸中枢驱动[18]。
老年人可能存在入睡困难或睡眠维持困难,导致睡眠中心进行PSG的失败率更高、假阴性率更高。其PSG常提示:(1)随年龄增长,睡眠时间减少,睡眠潜伏期延长,入睡后清醒时间和次数以及觉醒次数增加。(2)老年人睡眠结构紊乱更严重,睡眠效率更低。(3)老年人中枢型与混合型呼吸事件增加。
3.3.2 HSAT HSAT是诊断老年SAS的另一种方法,在老年人群中应用可能成本更低、效率更高。使用HSAT诊断SAS前,需要专业医师对老年人病史、体格检查、危险因素等进行详细评估。HSAT设备至少要记录呼吸气流、呼吸运动、SaO2和脉率,且技术指标要与PSG相一致。HSAT设备诊断OSA需要在习惯睡眠时间内记录不少于4 h的数据。根据导联数目不同,HSAT可分为Ⅱ、Ⅲ、Ⅳ型[19]。各型睡眠诊断设备特点比较见表3(Ⅰ型为PSG,Ⅱ~Ⅳ型为HSAT)。
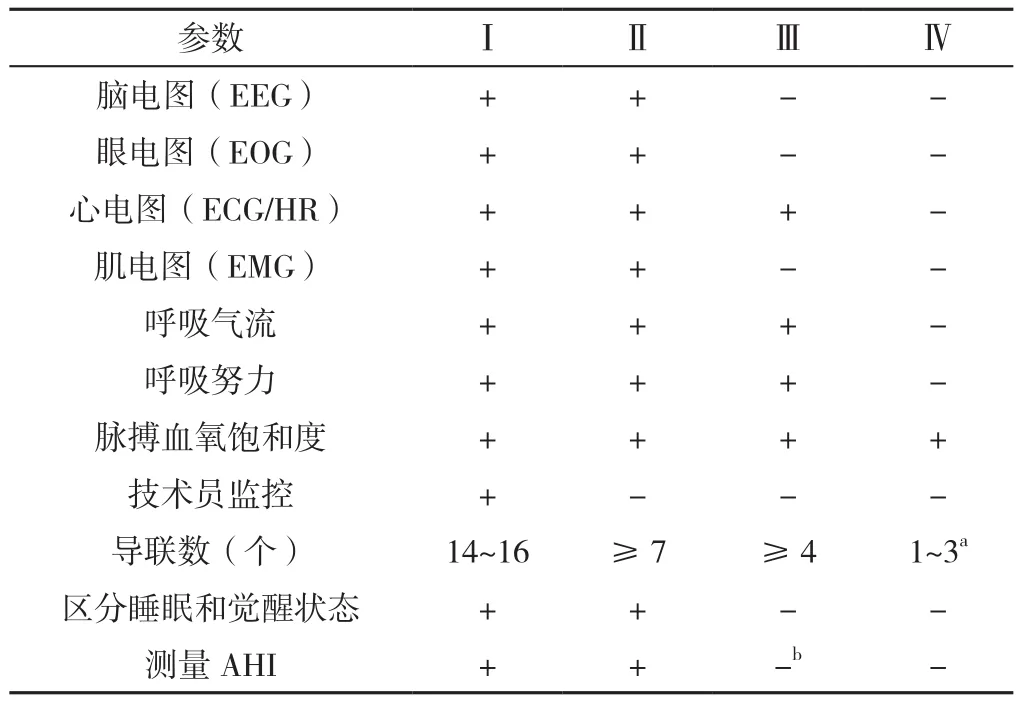
表3 各型睡眠诊断设备特点比较Table 3 Comparison of the features between four sleep diagnostic devices
HSAT适用条件:(1)怀疑中、重度OSA的患者,在排除合并症及其他睡眠障碍的前提下,可以使用HSAT进行诊断[20]。中、重度OSA:满足日间嗜睡及下列症状中的两个:习惯性响亮鼾声,观察到的窒息、呼吸暂停、喘息,已经被确诊为高血压;合并症:心肺疾病、神经肌肉疾病、高碳酸血症、睡眠相关的肺泡低通气、脑卒中病史、服用阿片类药物、严重失眠;其他睡眠障碍:CSA、周期性肢体运动障碍、异态睡眠、昼夜节律障碍、发作性睡病等。(2)对于无法前往睡眠实验室行PSG的病重、移动不便等患者可行HSAT。(3)HSAT可应用于评估口腔矫治器、上气道手术、减重等非呼吸机疗法治疗OSA的效果。
HSAT应用注意事项:(1)对于65岁以上的老年人,由于自身合并症较多,慎重应用HSAT诊断OSA[21]。(2)不适用于无症状人群的筛查。
3.4 量表 量表主要用于基层医院和社区卫生服务机构初筛,若量表初筛评估为睡眠障碍高风险,建议行PSG或HSAT。评估OSA量表主要包括爱泼沃斯嗜睡(ESS)量表[22]、睡眠呼吸暂停初筛量表(STOP-BANG量表)[23]、柏林问卷[24],见表4~6。ESS可用于评估健康老年人群、轻度认知功能损害患者日间嗜睡程度[25]。对于中、重度痴呆患者及生活无法自理的老年患者,主要基于详细的病史和照顾者报告的临床症状。STOP-BANG量表可作为老年OSA初筛工具。柏林问卷可用于评估认知功能损害及卒中患者OSA风险程度[26]。

表4 ESS量表Table 4 Epworth Sleepiness Scale

表5 STOP-BANG量表Table 5 STOP-BANG questionnaire

表6 柏林问卷Table 6 Berlin questionnaire
3.5 气道影像检查 气道影像检查包括鼻咽镜、X线二维影像及测量分析、三维影像及测量分析、药物诱导睡眠下的影像学检查。
3.6 其他方法 其他方法包括食管压、膈肌肌电、脉搏传导时间监测,主要用于评估呼吸中枢驱动。(1)食管压监测,其是反映呼吸中枢驱动、区分呼吸暂停类型的最佳方法。但食管压受呼吸气流和肺容量变化的影响,所以用食管压反映以气流变化为特征的OSA患者的呼吸中枢驱动有一定局限性。到目前为止食管压监测并不被作为临床常规诊断方法[27]。(2)膈肌肌电监测,其可作为评价睡眠呼吸暂停患者呼吸中枢驱动的一种辅助方法[28]。膈肌肌电监测按部位放置可分为体表、经皮肌内及多导食管电极。体表电极监测结果易受到周围肌肉信号、皮下脂肪等干扰,结果多不准确;经皮肌内电极信号虽然监测范围局限,但影响因素少,能准确反映单位神经元与肌肉纤维的生理特点,气胸是经皮肌内电极最主要的并发症,现常结合超声引导来避免;多导食管电极是监测膈肌电生理活动的经典手段,但仍需经鼻置放,有一定的侵入性,需被检者配合,因此多导食管电极监测膈肌肌电多用于科学研究。(3)脉搏传导时间,其波动的幅度与食管内压有很好的相关性。临床主要应用于判断呼吸努力度、检出呼吸事件、鉴别呼吸事件性质、检出皮质下觉醒。但这种方法测定脉搏波和心电波易受多种因素的干扰,准确率低,临床应用价值有待进一步研究证实[29]。
3.7 各监测方法的比较
3.7.1 HSAT与PSG比较[30]PSG和HSAT均可用于诊断OSA,HSAT可能会低估OSA的严重程度,当HSAT结果为阴性时推荐改为PSG而不是复查HSAT。
3.7.2 量表与PSG比较 量表诊断OSA准确率低。在缺乏PSG或HSAT客观诊断下,仅应用临床工具、量表及预测算法无法明确诊断OSA[31]。各诊断评估方法的诊断灵敏度、特异度见表7。

表7 各诊断评估方法的灵敏度、特异度比较Table 7 Comparison of diagnostic sensitivity and specificity of assessment tools for sleep apnea syndrome in older adults
4 老年SAS诊断标准及病情分度
4.1 老年OSA诊断标准 满足下述(1)+(2)或(3)可诊断为OSA[32]。(1)出现以下至少1项:①患者主诉为困倦、非恢复性睡眠、乏力或失眠;②因憋气或喘息从睡眠中醒来;③同寝室或其他目击者报告患者在睡眠期间存在习惯性打鼾、呼吸中断或二者皆有;④已确诊高血压、心境障碍、认知功能障碍、冠心病、脑血管疾病、充血性心力衰竭、心房颤动或2型糖尿病。(2)PSG或者HSAT证实:PSG显示每小时睡眠期间,或HSAT每小时监测期间,发生阻塞型为主的呼吸事件(包括阻塞型呼吸暂停、混合型呼吸暂停、阻塞型低通气和呼吸努力相关性觉醒)≥5次/h。(3)PSG或者HSAT证实:PSG显示每小时睡眠期间,或HSAT每小时监测期间,发生阻塞型为主的呼吸事件(包括阻塞型呼吸暂停、混合型呼吸暂停、阻塞型低通气和呼吸努力相关性觉醒)≥15次 /h。
4.2 老年CSA诊断标准 老年CSA诊断标准包括各类型CSA的诊断[32]。
4.2.1 伴陈施呼吸CSA 满足(1)或(2)+(3)+(4)。(1)临床症状(1个或多个):困倦;睡眠起始或维持困难,频繁从睡眠中醒来或非恢复性睡眠;因气促而憋醒;打鼾;他人目击的呼吸暂停。(2)充血性心力衰竭、心房颤动/心房扑动或神经性疾病。(3)PSG:中枢型呼吸暂停/低通气事件≥5次/h;中枢型呼吸暂停和低通气事件占总呼吸暂停低通气事件的50%以上;通气模式符合陈施呼吸诊断标准。(4)疾病不能用其他现有睡眠疾病、药物或药物性疾病解释。
4.2.2 疾病所致不伴陈施呼吸CSA 满足(1)+(2)+(3)。(1)临床症状(1个或多个):困倦;睡眠起始或维持困难,频繁从睡眠中醒来或非恢复性睡眠;因气促而憋醒;打鼾;他人目击的呼吸暂停。(2)PSG:中枢型呼吸暂停/低通气事件≥5次/h;中枢型呼吸暂停和低通气事件占总呼吸暂停低通气事件的50%以上;无陈施呼吸。(3)疾病属于全身或神经系统疾病的合并症,与药物或药物性疾病无关。
4.2.3 高原性周期性呼吸致CSA 满足(1)+(2)+(3)+(4)。(1)近期进入高海拔地区。(2)临床症状(1个或多个):困倦;睡眠起始或维持困难,频繁从睡眠中醒来或非恢复性睡眠;因气促而憋醒;打鼾;他人目击的呼吸暂停。(3)症状上属于高原性周期性呼吸,或PSG显示非快速眼球运动睡眠期反复发生中枢型呼吸暂停/低通气事件≥5次/h。(4)疾病不能以现有的睡眠疾病、全身疾病、神经系统疾病、药物或药物性疾病解释。
4.2.4 药物或物质致CSA 满足(1)+(2)+(3)+(4)+(5)。(1)患者正在服用阿片类药物或其他呼吸抑制剂。(2)临床症状(1个或多个):困倦;睡眠起始或维持困难,频繁从睡眠中醒来或非恢复性睡眠;因气促而憋醒;打鼾;他人目击的呼吸暂停。(3)PSG:中枢型呼吸暂停/低通气事件≥5次/h;中枢型呼吸暂停和低通气事件占总呼吸暂停低通气事件的50%以上;无陈施呼吸。(4)疾病的发生属于服用阿片类药物或呼吸抑制剂的结果,药物与呼吸暂停之间为因果关系。(5)疾病不能以现有的睡眠疾病、神经系统疾病或服用其他药物解释。
4.2.5 原发性CSA 满足(1)+(2)+(3)+(4)。(1)临床症状(1个或多个):困倦;睡眠起始或维持困难,频繁从睡眠中醒来或非恢复性睡眠;因气促而憋醒;打鼾;他人目击的呼吸暂停。(2)PSG:中枢型呼吸暂停/低通气事件≥5次/h;中枢型呼吸暂停和低通气事件占总呼吸暂停低通气事件的50%以上;无陈施呼吸。(3)没有日间或夜间肺泡低通气的证据。(4)疾病不能以另一现患睡眠障碍、内科或神经系统疾病、药物或物质使用来解释。
4.2.6 治疗相关性CSA 满足(1)+(2)+(3)。(1)诊断性PSG显示:睡眠中以阻塞型为主的异常呼吸事件≥5次/h。(2)使用无备用呼吸频率的气道正压设备治疗期间,PSG显示阻塞型呼吸暂停事件显著消除后,持续存在或新出现中枢型呼吸暂停或低通气,伴以下所有情况:①PSG显示中枢型呼吸暂停/低通气事件≥5次/h;②中枢型呼吸暂停和低通气事件占总呼吸暂停低通气事件的50%以上。(3)中枢型呼吸暂停不能用其他中枢性睡眠呼吸暂停疾病解释。
4.3 老年SAS 病情分度 应充分考虑临床症状、合并症情况、AHI及夜间SaO2等实验室检查指标,目前主要根据AHI将OSA分为轻度(5次/h≤AHI<15次/h)、中度(15次/h≤AHI <30次/h)、重度(AHI≥30次/h)。SaO2下降的严重程度也很重要,但目前还没有被广泛接受的评价SaO2下降严重程度的指标,常用的有SaO2下降(通常被定义SaO2下降>4%)指数、最低SaO2、平均SaO2、SaO2降至某一阈值以下所持续的时间[33]。对于>65岁的衰弱老年人群,有研究将AHI≥10次/h定为诊断OSA的指标,且不进行病情分度[34]。
5 老年SAS评估流程
5.1 OSA评估流程 OSA评估主要依据病史采集、体格检查、危险因素、PSG或HSAT结果明确诊断,并评估合并症及鉴别诊断,具体流程见图1。

图1 OSA评估流程图Figure 1 Evaluation flow chart of obstructive sleep apnea in older adults
5.2 CSA评估流程 CSA评估主要依据病史采集、体格检查、危险因素、PSG结果,根据病史及相关检查确定CSA类型,指导疾病治疗,具体流程见图2。
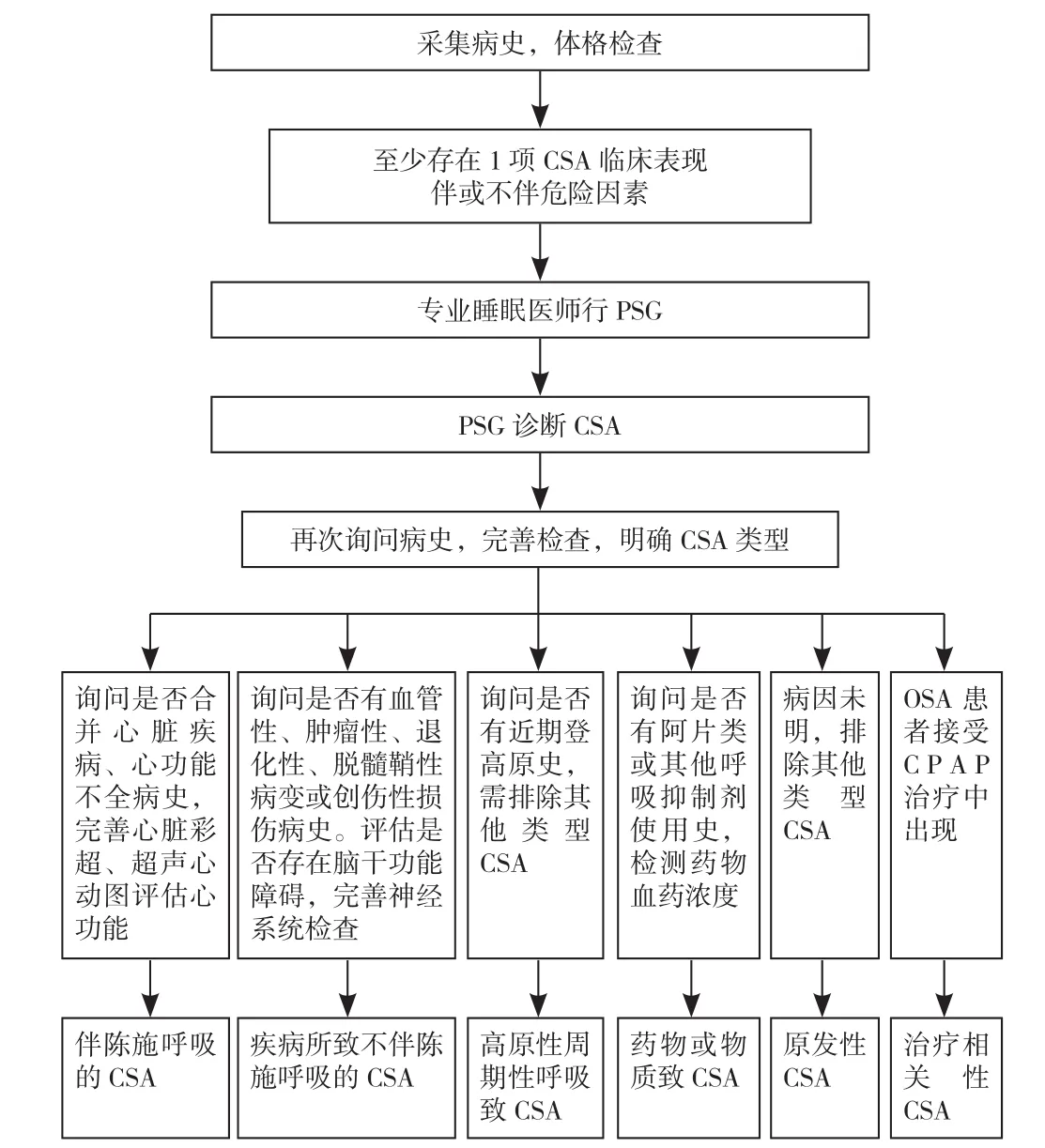
图2 CSA评估流程图Figure 2 Evaluation flow chart of central sleep apnea in older adults
6 老年SAS鉴别诊断
老年SAS需要鉴别引起打鼾、日间嗜睡、夜间呼吸困难的疾病,内科疾病或神经肌肉疾病相关的睡眠低通气疾病及其他相关睡眠疾病。
6.1 单纯鼾症 夜间有不同程度打鼾,AHI<5次/h,日间无症状。
6.2 上气道阻力综合征 夜间可出现不同频度、程度打鼾,虽上气道阻力增高,但AHI<5次/h,日间嗜睡或疲劳,试验性无创通气治疗有效则支持诊断。
6.3 肥胖低通气综合征 过度肥胖(BMI>30 kg/m2),清醒时 CO2潴留,PaCO2>45 mm Hg,多数患者合并 OSA[35]。
6.4 睡眠相关肺泡低通气 患者PSG或者HAST显示反复SaO2下降,但无明确气流阻塞。动脉血(或替代监测方法)PaCO2升高且>55 mm Hg持续时间≥10 min,或睡眠期动脉血(或替代监测方法)PaCO2较清醒仰卧位增高≥10 mm Hg并且>50 mm Hg持续时间≥10 min可诊断[36]。需要注意,如果睡眠期存在明确呼吸暂停或低通气,则应诊断OSA或在OSA基础上增加睡眠相关低通气的评估。
6.5 发作性睡病 主要临床表现为难以控制的白天嗜睡、发作性猝倒、睡眠瘫痪和睡眠幻觉,多在青少年起病,主要诊断依据为多次睡眠潜伏期试验时异常的快速眼球运动睡眠[37]。鉴别时应注意询问发病年龄、主要症状及PSG结果,同时应注意该病与OSA合并的可能性很大,应考虑继发性发作性睡病的可能,临床上不可漏诊。
6.6 不宁腿综合征和睡眠周期性肢体运动障碍 不宁腿综合征患者日间犯困,晚间强烈腿动需求,常伴异样不适感,安静或卧位时严重,活动时缓解,夜间入睡前加重,主要通过患者病史及临床症状诊断,PSG可作为鉴别其他睡眠疾病的重要辅助检查[38]。睡眠周期性肢体运动障碍的PSG有典型的周期性腿动,应和睡眠呼吸事件相关的腿动鉴别。后者经呼吸机治疗后常可消失。通过详细向患者及同室睡眠者询问患者睡眠病史,结合查体和PSG 结果可以鉴别。
6.7 惊恐发作 夜间惊恐发作是在睡眠中出现喘气和窒息的症状,与SAS的憋气症状相似。老年人中睡眠困扰因素常导致广泛性焦虑和惊恐发作。夜间惊恐发作患者夜间PSG不显示SAS特征性的低通气或低SaO2模式[39]。惊恐发作的频率较低,伴有强烈的自主觉醒,无过度困倦,OSA患者通常无惊恐发作病史。
6.8 失眠及药物或其他物质所致的嗜睡 老年人易出现睡眠节律紊乱和夜间片段睡眠,失眠药物在老年人中使用较为常见,常导致日间疲劳、过度嗜睡及小睡次数增多等相应的临床症状。使用药物/物质的患者,如有与SAS一致的症状和体征,应给予确认。PSG不作为常规检查,但PSG可排除其他睡眠疾病[40]。
6.9 昼夜节律紊乱 睡眠时相前移综合征和不规律睡眠——觉醒节律障碍是老年人两种常见的疾病。睡眠日志有助于诊断和监测治疗反应[41]。诊断不明确或疑有其他睡眠障碍,需使用PSG进行鉴别。
6.10 快速眼球运动睡眠行为障碍(RBD) RBD是老年人中常见的一种睡眠疾病,其特点是患者在快速眼球运动睡眠出现各种与梦境高度吻合的行为,可能会伤害自己或他人。其非运动症状及特点为轻度认知功能障碍,且PSG的肌电监测显示在R期肌肉迟缓丧失[42]。一些重度OSA患者可能会出现与RBD相似的临床症状,OSA患者R期伴有肌肉迟缓丧失。RBD和OSA可以发生在同一患者,尤其是老年人,需要PSG确诊并排除其他情况。
7 老年SAS相关合并症
7.1 高血压 SAS是高血压发生和发展的重要的独立危险因素之一[43]。在日间血压正常的老年人群中SAS患者较非SAS患者发生夜间高血压的风险更高,且以舒张压升高为主。
7.2 脑卒中 老年人SAS与脑血管病密切相关。SAS既是脑卒中的危险因素又是脑卒中的结果。脑血管病变患者SAS发生率随年龄增长而增高[44]。
7.3 慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD) COPD与OSA并存的概率极高,两种疾病的发病率随年龄增长而增加。COPD合并OSA称为重叠综合征,此类患者较单纯OSA或COPD者更容易发生严重的与睡眠相关的低氧血症,更易引起肺动脉高压及发展为慢性肺源性心脏病[45]。
7.4 认知功能损伤 SAS影响认知功能,尤其是夜间低氧血症与认知功能受损关系密切,AHI增高与记忆力减退相关[46]。
7.5 阿尔茨海默病 SAS可能会使老年人患阿尔茨海默病的风险增加。SAS与阿尔茨海默病互为因果,长期SAS可导致正常人认知功能障碍,SAS引起的睡眠障碍也能促使阿尔茨海默病加重[47]。
7.6 帕金森病 中、重度帕金森病患者在清醒时常有阻塞性睡眠呼吸障碍。一些患者在夜间睡眠时可产生呼吸模式紊乱,伴有中枢型或阻塞型呼吸暂停。OSA也可能是帕金森病发病的独立危险因素[48],其可明显影响患者认知功能、运动功能及其他非运动症状等。
7.7 癫痫 SAS与癫痫相互影响。SAS可增加癫痫发作频率,加重癫痫症状及影响认知功能,同时癫痫会影响睡眠结构。癫痫患者更易出现噩梦、睡眠片段化、失眠、觉醒后疲倦与异态睡眠等。SAS患者罹患癫痫的风险明显增高[49]。
说明:本共识适用于各级医院从事睡眠呼吸疾病相关的临床医师、护理人员、技术人员对60岁以上老年人进行睡眠呼吸暂停评估。
共识专家委员会名单(按汉语拼音排序):陈开兵(甘肃中医药大学附属医院)、陈兴良(四川省第四人民医院)、陈宇洁(四川省第四人民医院)、董西林(西安交通大学第二附属医院)、董霄松(北京大学人民医院)、杜延玲(延安大学附属医院)、高莹卉(北京大学国际医院)、韩芳(北京大学人民医院)、韩继明(延安大学医学院)、何沁泽(四川省第四人民医院)、贺波(榆林市第二医院)、胡克(武汉大学人民医院)、李建华(解放军总医院第二医学中心)、李庆云(上海交通大学医学院附属瑞金医院)、李瑶(四川省第四人民医院)、李勇(四川省第四人民医院)、林俊岭(首都医科大学附属北京朝阳医院)、刘霖(解放军总医院第二医学中心)、刘清源(解放军总医院第二医学中心)、吕东升(内蒙古自治区第三医院)、吕云辉(云南省第一人民医院)、欧琼(广东省人民医院)、钱小顺(解放军总医院第二医学中心)、王慧玲(邯郸市中心医院)、王玮(中国医科大学附属第一医院)、王晓成(榆林市第二医院)、王怡(四川省第四人民医院)、徐伟豪(广东省人民医院)、杨凌麟(四川省第四人民医院)、俞红霞(北京大学国际医院)、张桂芝(解放军总医院第二医学中心)、张立(四川省第四人民医院)、赵力博(解放军总医院第二医学中心)、周长喜(解放军总医院第二医学中心)
共识撰写者名单:陈宇洁(四川省第四人民医院)、韩芳(北京大学人民医院)、钱小顺(解放军总医院第二医学中心)、刘霖(解放军总医院第二医学中心)、王怡(四川省第四人民医院)、杨凌麟(四川省第四人民医院)
本共识无利益冲突。
附录:本共识所用名词及定义[50-51]
1.睡眠呼吸暂停(sleep apnea,SA):睡眠中鼻腔温度传感器、气道正压(PAP)设备气流(或替代传感器)较事件前基线水平下降≥90%,且持续时间≥10 s。
2.阻塞型呼吸暂停(obstructive apnea,OA):满足睡眠呼吸暂停诊断标准,并且在整个呼吸气流缺失期间存在持续或增加的吸气努力。
3.中枢型呼吸暂停(central apnea,CA):满足睡眠呼吸暂停诊断标准,并且在整个呼吸气流缺失期间不存在吸气努力。
4.混合型呼吸暂停(mixed apnea,MA):满足睡眠呼吸暂停诊断标准,事件开始部分缺乏吸气努力,事件后半部分出现吸气努力。
5.低通气(hypopnea):睡眠中鼻腔压力传感器、PAP设备气流(或低通气替代传感器)较基线水平降低≥30%,持续时间≥10 s,并伴脉搏血氧饱和度(SaO2)较事件前基线值下降≥3%或伴有觉醒。
6.觉醒(arousal):在非快速眼球运动睡眠(N1、N2、N3期),若脑电频率突然改变,出现包括α、θ波和/或频率>16 Hz的波(不包括梭形波),至少持续3 s,频率改变前存在至少10 s的稳定睡眠。在快速眼球运动睡眠(R期)要求以上脑电改变的同时至少有1 s颏肌电频率增高。
7.呼吸暂停低通气指数 (apnea hypopnea index,AHI):每小时睡眠时间呼吸暂停次数与低通气次数之和。
8.阻塞性睡眠呼吸暂停 (obstructive sleep apnea,OSA):睡眠状态下反复发作完全或者部分上气道阻塞事件,与频繁的SaO2下降和觉醒相关。伴有日间症状,并且夜间睡眠中阻塞型呼吸事件超过一定标准(≥5次/h)的一类睡眠呼吸紊乱疾病。
9.中枢性睡眠呼吸暂停(central sleep apnea,CSA):睡眠中呼吸暂停时,口和鼻气流以及胸、腹式呼吸运动同时停止,引起低氧血症、高碳酸血症、睡眠片段化,从而使机体发生一系列病理生理改变的睡眠疾病。
10.复杂性睡眠呼吸暂停(complex sleep apnea,CompSA):在持续气道正压通气(CPAP) 治疗过程中,当达到最佳治疗水平时,阻塞型呼吸事件清除,但出现了中枢型呼吸暂停指数(CAI)≥5 次/ h,或以潮式呼吸为主的情况。
11.衰弱(frailty):机体对生理储备的降低和多系统的失调导致的内外应激状态下保持内环境稳定能力的受限,从而增加对应激事件易感性的一种老年综合征。衰弱是年龄和躯体疾病积累的表达,当其达到生理系统阈值时就会导致不良的健康结果。

