宫腔镜下子宫内膜息肉切除术治疗子宫内膜息肉的效果
程胜花
子宫内膜息肉(endometrial polyps,EP)是子宫良性疾病,以子宫腔局部内膜过度生长导致的阴道不规则出血和白带异常为主要症状[1-2]。手术治疗是其主要的治疗模式,术后并发症会影响女性的正常生活,同时会增加子宫内膜非典型增生、子宫内膜癌和其他恶性疾病发生的风险[3]。因此,及时就诊并选择有效的治疗方法非常重要。子宫内膜息肉的药物治疗并不令人满意。药物治疗通常不能显著改善患者的症状,并可能延缓病情。因此,EP的主要治疗方法是手术治疗。传统手术对医生的技术要求很高,尽管传统刮宫术可以有效切除EP患者的病灶,但由于术中刮宫术的手术范围有限,它更可能对正常子宫内膜造成损害,严重的情况下,甚至可能引起子宫壁受损。并且容易发生术中的不良事件,例如子宫穿孔、空气栓塞和肺栓塞,复发率较高[4-5]。子宫内膜造成的损伤瘢痕不利于子宫内膜的修复,需要将其恢复为平坦光滑的表面,从而进一步提高了怀孕卵的着床率,从而提高了妊娠率。但是它在减少月经量方面是较弱的,并且由于不能完全刮除息肉的根部和周围组织,因此会导致较高的复发率。近年来,一些研究人员表明,EP切除术更有利于该病的预后。宫腔镜下EP切除术(hysteroscopic endometrial polypectomy,HEP)是近年来的一种新的治疗方法,具有创伤小、术后恢复快的优点。但是目前很少有将HEP与传统程序进行比较的特殊研究[6]。基于此,本文探讨HEP治疗EP的安全性及其对妊娠结局的影响,现将结果报道如下。
1 资料与方法
1.1 一般资料
回顾性分析红安县人民医院2018年1月-2019年12月收治的200例EP患者为研究对象。纳入标准:符合“妇科内镜”中EP疾病的相关诊断标准;术前超声检查发现子宫内膜息肉的存在,息肉可能是不孕的唯一原因;至少有不孕史超过1年,并愿意怀孕。排除标准:男性不育引起的不育;拒绝参与研究;严重心肝肾功能性疾病。按照治疗方式将其分为A组及B组,每组100例。A组年龄24~40岁,平均(31.5±4.2)岁;息肉大小平均(1.03±0.33)cm;数量平均(3.12±0.34)个。B组年龄23~41岁,平均(32.3±3.1)岁;息肉大小平均(1.12±0.12)cm;数量平均(3.01±0.22)个。两组一般资料比较差异无统计学意义(P>0.05),有可比性。
1.2 方法
术前准备:手术在月经干净后的4~7 d,并在手术前1 d的早晚服用米非司酮,50 mg/次,并将其放在阴道子宫颈扩张棒中,所有患者均接受麻醉,对患者的外阴、阴道和子宫进行碘伏消毒。麻醉生效后,夹住子宫颈的前唇以进一步探查子宫颈的深度。之后,将宫颈管扩张,并再次检查息肉的具体位置、大小和数目。
A组进行传统的刮宫术:在超声监测下,采取截石术的麻醉方法,使用刮匙刮除患者宫腔的息肉,以确保息肉被清除干净,最后,进行常规消毒,并将组织送去进行医学病理检查。
B组采用HEP,于月经后4~7 d进行手术治疗,以5%葡萄糖作为子宫扩张液,子宫扩张压力设定为95 mmHg。(1)脊髓麻醉,取截石位,并进行消毒。(2)插入内镜,以110 ml/min的子宫扩张液的流速进行子宫扩张手术。(3)通过宫腔镜用环形电极横切息肉的底部。凝结功率为30~50 W,切除功率为70~80 W。根据息肉及其周围组织的具体情况,进行电切除,负压被充分吸引。内窥镜检查证实息肉是否已完全去除。(4)手术后,将Foley球囊导管置于子宫腔内,并向球囊内灌注3~5 ml的0.9%氯化钠注射液,以使其稳定在子宫颈中,需要留置6~7 d。手术后取出组织,进行病理检查并给予患者抗生素以防止感染。
1.3 观察指标及评价标准
(1)月经量、子宫内膜厚度:统计两组术前及术后3、6、12个月月经量、子宫内膜厚度。(2)复发及不良反应:比较两组术后1年两组复发及不良反应(术后感染及宫颈撕裂)发生情况。(3)妊娠率:比较两组妊娠率,统计两组术后6、12个月的妊娠率。妊娠率=妊娠/总例数×100%。
1.4 统计学处理
2 结果
2.1 两组月经量比较
术前两组月经量比较差异无统计学意义(P>0.05),术后3、6、12个月,B组月经量均少于A 组(P<0.05),见表 1。
表1 两组月经量比较[ml,(±s)]

表1 两组月经量比较[ml,(±s)]
组别 术前 术后3个月 术后6个月 术后12个月A 组(n=100) 327.51±151.34 248.66±87.52 272.79±51.36 302.77±82.35 B 组(n=100) 326.43±150.62 137.58±54.27 169.53±42.16 202.31±67.16 t值 1.031 5.169 4.932 12.301 P值 0.152 0.001 0.039 0.000
2.2 两组子宫内膜厚度比较
术前两组子宫内膜厚度比较差异无统计学意义在(P>0.05),术后3、6、12个月,B组子宫内膜厚度均低于A组(P<0.05),见表2。
表2 两组子宫内膜厚度比较[mm,(±s)]
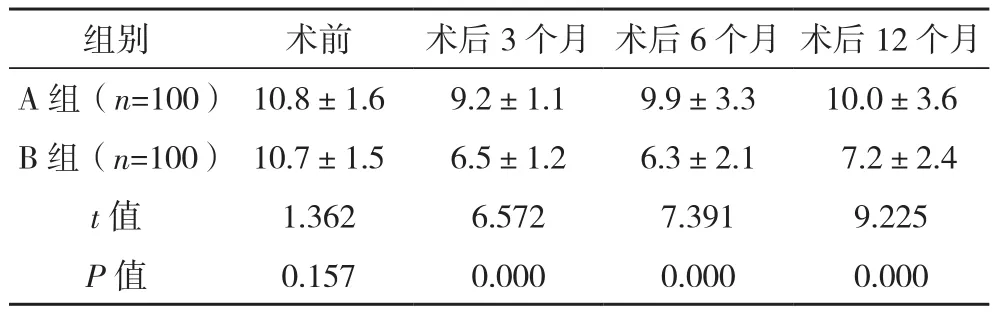
表2 两组子宫内膜厚度比较[mm,(±s)]
组别 术前 术后3个月 术后6个月 术后12个月A组(n=100) 10.8±1.6 9.2±1.1 9.9±3.3 10.0±3.6 B组(n=100) 10.7±1.5 6.5±1.2 6.3±2.1 7.2±2.4 t值 1.362 6.572 7.391 9.225 P值 0.157 0.000 0.000 0.000
2.3 两组复发及不良反应比较
B组复发率及不良反应发生率均低于A组(P<0.05),见表 3。
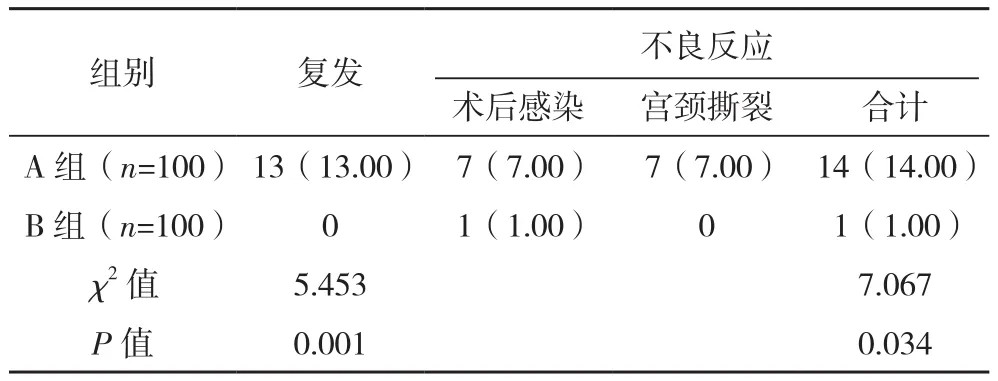
表3 两组复发及不良反应比较[例(%)]
2.4 两组妊娠率比较
术后6个月后,B组妊娠率(16.00%)与A组(15.00%)比较,差异无统计学意义(P>0.05),术后12个月,B组妊娠率为35.00%,明显高于A组的 20.00%(P<0.05),见表 4。

表4 两组妊娠率比较[例(%)]
3 讨论
3.1 EP的治疗
EP常见于35岁以上的女性[7]。该病的特征是月经量增加和阴道不规则出血[8-9]。在严重的情况下,会导致不孕并影响患者的家庭和生活[10]。目前,宫腔镜EP切除术和EP刮除术主要用于临床治疗[11]。EP的刮除术使用刮匙除去EP。子宫内膜造成的损伤瘢痕不利于子宫内膜的修复,并将其恢复为平坦光滑的表面,从而进一步提高了怀孕卵的着床率,从而提高了妊娠率[12]。但是它在减少月经量方面是较弱的,并且由于不能完全刮除息肉的根部和周围组织,因此导致较高的复发率[13]。与刮除EP相比,宫腔镜EP切除术的优点是:(1)采用锥形电极,并采用电切和电凝术去除息肉根部周围的组织,也可用于通电。它凝结子宫角并连接血管,进一步避免息肉再生。(2)去除息肉时,可以保护子宫内膜的底部并使子宫内膜的功能层变薄。在保护子宫内膜的基础上,可以缩小子宫内膜以减少月经量[14]。
3.2 宫腔镜在EP的应用
宫腔镜技术的发展变得越来越成熟,由于它具有直接手术,定位准确,诊断率高,术中出血少,并发症少,速度快等优点,已被广泛用于EP不孕症的临床治疗。宫腔镜电切术是使用环形电极切除息肉的根部,然后用刮匙轻轻刮除子宫腔,然后使用宫腔镜检查以确保息肉被彻底清洁,对患者造成很小的创伤,而且复发率低。本研究结果表明,与应用传统的刮宫术的A组相比,术后1年,B组复发率及不良反应发生率低(P<0.05)。术后3、6、12个月,B组子宫内膜厚度均低于A组(P<0.05),表明EP患者HEP治疗效果确切,可以减少手术创伤和子宫内膜厚度,减少不良反应的发生,有利于患者的预后。分析的原因是,尽管传统刮宫术可以有效切除EP患者的病灶,但由于术中刮宫术的手术范围有限,它更可能对正常子宫内膜造成损害,在严重的情况下,甚至可能引起子宫壁受损。随着宫腔镜技术的不断进步,已逐渐应用于EP患者的治疗,可有效避免传统刮宫术的盲目性。外科医生可以通过宫腔镜在视觉上观察病变部位,以准确地去除息肉组织。HEP手术中在宫腔镜下,可以清晰地观察到息肉的形状,可以进行针对性的切除治疗,可以缩短手术时间,避免手术中意外碰伤和刮伤,减少了手术出血的发生。促进患者恢复术后健康。另外,HEP可以在手术过程中最大限度地去除息肉组织,避免了手术后息肉的重新生长,并同时减少了子宫内膜的厚度。这与国外的一项研究结论相似[15]。同时,本研究随访了两组术后妊娠情况,术后6个月,两组妊娠率比较差异无统计学意义(P>0.05),但术后12个月,B组妊娠率高于A组(P<0.05)。
综上,HEP治疗EP不良反应较少,术后妊娠率高,应积极推广应用。

