转基因抗虫、耐除草剂及品质改良复合性状玉米BBHTL8-1的分子特征及功能评价
邹俊杰 ,徐妙云 ,张兰 ,罗彦忠 ,刘源 ,郑红艳 ,王磊 *
(1.中国农业科学院生物技术研究所,农业农村部农业基因组学重点实验室(北京),北京 100081;2.三亚中国农业科学院国家南繁研究院,海南 三亚 572000)
玉米是我国种植面积较大的粮食作物之一,也是重要的饲料及工业原料,在保障国家粮食安全和促进国民经济发展中发挥重要作用。玉米螟作为重要的鳞翅目类害虫,每年都对我国的玉米生产造成重大损失[1]。杂草也严重危害玉米生产,一般年份减产10%~20%,严重年份可达30%~50%以上[2]。利用转基因技术培育的抗虫、耐除草剂转基因玉米成为农业害虫控制和杂草防除的有效手段,能够有效减少化学药剂的施用,降低人工成本,提高玉米产量和品质,对于保护生态环境和生物多样性具有重要意义。抗虫和耐除草剂转基因玉米的研制对于我国玉米产业的发展具有重要意义,转基因玉米的培育也将是大势所趋[3]。
自1996年转基因作物商业化种植以来,转基因作物的种植面积持续增加。2018年,转基因作物种植面积达1.91×108hm2,累计种植面积达到25×108hm2,目前已有70个国家/地区应用了转基因作物。其中,具有复合性状的转基因作物种植面积增加了4%,占全球总转基因作物种植面积的42%[4]。转基因作物复合性状以抗虫耐除草剂、多基因复合抗虫为主,涉及的作物主要包括棉花、玉米、大豆和油菜[5]。我国也开展了复合性状转基因玉米的研究,获得具有复合抗虫、耐除草剂性状的转基因玉米转化体[2,6-10],也获得兼抗虫、耐除草剂、耐干旱的转基因玉米材料[11]。
维生素E(vitamine E,VE)是人类和动物必需的维生素,具有显著的抗氧化性能[12-13]。饲料中必需添加外源合成的维生素E才能满足生产的需求,因此提高玉米中的维生素E含量具有良好的营养价值和应用前景。HPT(homogentisate phytyltransferase,尿黑酸植基转移酶)和TMT(γtocopherol methyltransferase,γ-生育酚甲基转移酶)是维生素E合成途径中的关键基因,分别控制VE合成的总量及控制低活性VE组分γ-生育酚向高活性VE组分α-生育酚的转变[14]。已有研究表明,HPT和γ-TMT共表达可以提高总生育酚和α-生育酚含量,单独表达TMT可以提高α-生育酚含量[15-19]。将玉米ZmTMT在拟南芥和玉米中过量表达,转基因拟南芥和玉米种子中的α-生育酚含量显著提高[20]。
为获得抗虫、耐除草剂和高维生素E含量的转基因玉米,在前期研究中将抗鳞翅目和鞘翅目害虫基因Cry1Ab和Cry3Bb、耐草甘膦基因cp4epsps(农杆菌CP4菌株5-烯醇式丙酮酰莽草酸-3-磷酸合酶基因)、维生素E合成途径中的ZmHPT和ZmTMT共5个基因构建在一个载体上,通过农杆菌转化和回交育种,获得了含有5个外源基因表达框的转基因玉米材料BBHTL8-1。本研究对BBHTL8-1的分子特征和遗传稳定性进行了分析,并对转基因玉米的抗虫、耐除草剂性能以及籽粒中维生素E含量进行了评价,旨在为培育抗虫耐除草剂及品质改良的玉米新品系奠定基础。
1 材料与方法
1.1 试验材料
转基因玉米材料BBHTL8-1由本课题组创制,BC4F1、BC5F1和BC6F1为BBHTL8-1与玉米优良自交系郑58(Zheng 58)不同回交世代材料,非转基因对照材料为回交亲本材料郑58,均由本课题组保存。转基因田间试验在河北廊坊中国农科院生物技术研究所试验基地进行。田间试验每个小区面积为6 m2(2 m×3 m),行距50 cm,株距20 cm,3次重复,播种后按正常栽培管理。温室种植条件按照《农业转基因生物安全评价管理办法》[21]执行,并已备案(农基安办报告字〔2018〕第427号,农基安审字〔2019〕第012号)。
1.2 试验方法
1.2.1 BBHTL8-1材料的获得将Cry1Ab、Cry3Bb、cp4epsps、ZmHPT、ZmTMT5个基因构建在一个载体pL8上,载体骨架为pCAMBIA1300,含有5个基因表达框(约18.9 kb),其中Cry1Ab表达框含E35S启动子,Cry3Bb表达框含OsAct2启动子,cp4epsps表达框含玉米Ubi启动子,ZmHPT表达框和ZmTMT表达框均含玉米胚特异表达GLB1启动子,具体结构如图1所示。将含有5个基因表达框的载体转入农杆菌中,利用农杆菌介导的幼胚转化方法[22]将外源基因导入受体玉米材料Hi-II中,对转基因阳性植株进行分子鉴定。利用回交转育的方法将外源片段导入优良自交系郑58,经过6代回交后再自交筛选,获得了转基因玉米材料BBHTL8-1。

图1 BBHTL8-1外源T-DNA插入片段基因表达框Fig.1 Structure of T-DNA region containing transgenic expression cassettes in BBHTL8-1
1.2.2 BBHTL8-1材料外源插入片段鉴定 取田间生长到3~5叶期的BBHTL8-1和郑58的叶片,利用植物基因组DNA提取试剂盒(DP302-03,全式金公司)提取玉米基因组DNA。利用高通量全基因组重测序[23]和侧翼序列PCR测序方法,确定BBHTL8-1转基因株系外源T-DNA片段插入位置和两端基因组序列。根据BBHTL8-1外源基因表达框序列及外源序列插入玉米基因组的位置,设计Cry1Ab、Cry3Bb、cp4epsps、ZmHPT、ZmTMT特异性扩增引物以及BBHTL8-1外源片段插入基因组特异性检测引物(表1),由上海生工生物技术有限公司合成。

表1 本研究中应用的引物序列Table 1 Primers used in this study
PCR反应体系:2×TSINGKE Master Mix 10 μL,正反向引物(10 μmol·L-1)各 0.4 μL,ddH2O 8.2 μL,DNA模板 1 μL。PCR扩增条件为:94 ℃3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,35个循环;72℃ 10 min。
1.2.3 BBHTL8-1材料外源插入基因实时荧光定量 PCR(qRT-PCR) 参照SV Total RNA Isolation System(Promega,USA)方法提取玉米BBHTL8-1植株5叶期幼苗的根、茎、叶,以及成熟植株的根、茎、叶和种子的RNA。利用反转录试剂盒A3500-Reverse Transcription System(Promega,USA)合成cDNA。采用 SYBR PremixExTaq™(DRR041A,TAKARA)荧光定量试剂盒(引物见表1)检测外源基因表达量,PCR仪为Applied Biosystems Prism 7500 analyzer。
1.2.4 BBHTL8-1不同组织蛋白表达量测定 采用酶联免疫分析(ELISA)方法对BBHTL8-1玉米和非转基因对照玉米地上部整株和籽粒样本中的Cry1Ab、Cry3Bb、CP4EPSPS、ZmHPT、ZmTMT蛋白的水平进行分析检测。分别在玉米5叶期、开花期、成熟期取材,包括根、茎、叶、花穗、种子等组织。取植物材料50 mg,用液氮研磨成粉末,加300 μL蛋白提取 buffer溶解蛋白,12 000 r·min—1离心,取上清200 μL,—80 ℃保存;进一步稀释100倍备用。阴性对照为非转基因自交系郑58。分析方法按照EnviroLogix公司试剂盒说明书进行。
ELISA操作步骤如下:分别取50 μL稀释好的样品加入96孔酶标板(美国Crystalgen公司)进行反应,3次重复;室温下孵育30 min;移去上清,用wash buffer洗3~4次;分别加50 μL相应蛋白抗体;室温下孵育1 h;移去上清,用wash buffer洗3~4次;加100 μL底物,室温下孵育30 min;加100 μL反应终止液,利用酶标仪(Biotek Synergy H1,美国Bioeck公司)测定OD450吸光值;根据标准曲线分 别 计算 Cry1Ab、Cry3Bb、CP4EPSPS、ZmHPT和ZmTMT蛋白含量。
1.2.5 BBHTL8-1玉米螟抗虫性鉴定 ①室内玉米螟抗性鉴定。分别选取田间玉米心叶期的心叶、吐丝期的花丝、乳熟期的籽粒,在室内可控条件下鉴定对亚洲玉米螟的抗性。将从田间采回的材料在0.3%NaClO溶液中浸泡3 min消毒,自来水冲洗2遍、蒸馏水冲洗1遍,放在滤纸上将水分吸干。用无菌剪刀将试验材料剪成约1.5 cm×2.0 cm的小片(段),分别置于培养板中,每孔放适量玉米组织,单头饲养亚洲玉米螟初孵幼虫,10孔(饲养10头幼虫)作为一个处理,每个处理5次重复,即每个组织测试50头幼虫。置于温度28℃,湿度80%,光照周期16 h光照/8 h黑暗的人工气候箱内饲养,期间根据各组织被取食消耗情况随时添加相同来源的新组织。从接虫第2天开始每2 d调查1次幼虫存活状况,记录存活幼虫数,调查3次。
②田间玉米螟抗性鉴定。供试材料生长到大喇叭口期开始接种亚洲玉米螟,将玉米螟初孵幼虫接于心叶中,每株接虫20~30头,定期观察虫害发生情况。采用国际玉米螟协作组制定的9级分级标准[2]统计危害等级。亚洲玉米螟初孵幼虫购自中国农业科学院植物保护研究所。
1.2.6 BBHTL8-1田间草甘膦耐受性评价 将转基因材料及非转基对照材料各种6行(3次重复),行长4 m,行距为60 cm,株距30 cm。BBHTL8-1及非转基因对照郑58生长至5~6叶期时,喷施不同含量的草甘膦,为推荐含量的4倍,对照喷施清水,分别在1周和2周后调查植株死亡率和药害症状。草甘膦为孟山都公司生产的41%草甘膦异丙胺盐水剂。
1.2.7 BBHTL8-1籽粒生育酚含量测定 采用甲醇/氯仿提取的方法提取生育酚[19],并用HPLC(high-performance liquid chromatography)检 测BBHTL8-1和非转基因对照中不同种类生育酚的含量。检测方法如下:分别将转基因玉米种子和非转基因对照研磨成粉末,称取100 mg,加入600 μL甲醇氯仿混合液(2∶1),混匀;加入氯仿200 μL,混匀;加入 ddH2O,250 μL,混匀;10 000 r·min—1室温离心20 min;吸取下层氯仿(各样品应等体积)至新的EP管,氮气吹干氯仿;加入100 μL无水乙醇混匀,HPLC测定维生素E含量。利用α-、γ-、δ-生育酚标准品作对照进行质检。
1.2.8 BBHTL8-1农艺性状调查 在玉米生长期间调查出苗期、抽雄时期、吐丝期。吐丝后测量株高、穗位高。收获果穗后考种,测量穗行数、百粒重等农艺性状指标。
2 结果与分析
2.1 BBHTL8-1转基因材料的遗传稳定性分析
为了获得转基因抗虫、耐除草剂及营养品质改良玉米,将抗虫基因Cry1Ab和Cry3Bb、耐草甘膦基因cp4epsps、维生素E合成途径中的ZmHPT和ZmTMT构建在一个载体上,包含5个表达框。利用PCR和试纸条对BBHTL8-1株系回交转育后代进行了连续3代跟踪检测,回交株系PCR检测的阳性植株与阴性植株比例接近1∶1,与单个外源片段插入回交株系理论分离比接近,分离比符合单位点插入的孟德尔遗传规律。对BBHTL8-1中外源基因进行PCR鉴定,图2A为BC5F1代中阳性植株PCR结果,表明外源基因在多代回交株系中均能够稳定遗传。对BBHTL8-1材料3’端侧翼序列进行特异性PCR检测,扩增片段大小在240 bp左右(图2B),与理论片段大小相符,对PCR扩增片段进行测序,测序结果能够分别比对上玉米基因组序列和插入片段序列,表明BBHTL8-1的3’端特异性引物对可以用于BBHTL8-1转基因株系特异性片段检测。

图2 BBHTL8-1外源插入片段PCR鉴定Fig.2 Verification of the transgenic fragments in BBHTL8-1
二代测序技术可以对外源插入片段在转基因植株中插入位置、插入拷贝数、外源基因的完整性和遗传稳定性进行分子特征检测[23]。为了确定BBHTL8-1中外源片段在基因组插入位置,对BBHTL8-1进行高通量全基因组测序和侧翼序列PCR测序,与玉米基因组序列B73参考序列RefGen_v4(http://ensembl.gramene.org/Zea_mays/Info/Index)进行比对发现,外源基因插入在玉米基因组第4染色体180 575 645~180 577 000之间,外源插入片段位于基因间区,基因组序列有31 bp的丢失。
2.2 BBHTL8-1中外源插入基因相对表达量和蛋白表达量分析
2.2.1 外源插入基因相对表达量分析 BBHTL8-1 材料中含有5个基因表达框,为验证这5个基因的表达情况,在转录水平进行了检测。qRT-PCR结果(图3)表明,Cry1Ab、Cry3Bb、cp4epsps在5叶期和成熟期的根、茎、叶等组织中表达稳定,在种子中表达量相对较低。ZmHPT和ZmTMT由胚特异性启动子启动,因此ZmHPT和ZmTMT在五叶期根、茎、叶中表达量低,而ZmHPT和ZmTMT在成熟期种子中的相对表达量较高。

图3 BBHTL8-1材料中目标基因在不同时期相对表达量Fig.3 Relative expression levels of target genes in different tissues of BBHTL8-1 lines at different growth stages
2.2.2 蛋白表达量分析 为了检测外源插入片段中5个基因在BBHTL8-1材料中表达情况,利用酶联免疫检测了它们在5叶期、开花期和成熟期不同组织中的蛋白表达量。结果表明,Cry1Ab、Cry3Bb和CP4EPSPS的蛋白水平与转录水平类似,在不同生长时期中根、茎、叶及雄穗中均有较高表达,在种子中的表达水平较低。ZmHPT和ZmTMT在5叶期和开花期组织中表达量低,只在种子中有较高表达(图4)。
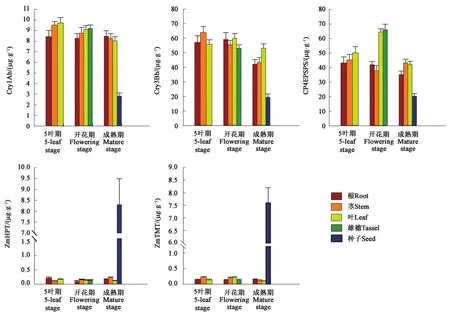
图4 BBHTL8-1材料中在不同时期目标蛋白量Fig.4 Levels of target proteins in different tissues of BBHTL8-1 plants at different growth stages
2.3 BBHTL8-1抗虫和耐除草剂性能评价
2.3.1 抗玉米螟性能 为了评价BBHTL8-1的抗虫性能,进行了玉米螟室内生测试验。取BBHTL8-1的心叶、花丝和籽粒喂食玉米螟,观察不同时期玉米螟幼虫死亡率,2 d后玉米螟死亡率在60%左右,喂食6 d后没有存活的玉米螟,而非转基因对照喂食玉米螟6 d后的死亡率在5%左右,说明BBHTL8-1对玉米螟有较高抗性(表2)。

表2 室内饲喂BBHTL8-1不同组织玉米螟幼虫死亡率Table 2 Mortality of corn borer by feeding BBHTL8-1 different tissues
对BBHTL8-1材料进行田间玉米螟抗性评价,在大喇叭口期进行玉米螟接虫试验,生长3周后统计虫害,根据虫孔大小、梳理及分布情况,对照玉米螟抗虫分级标准,BBHTL8-1叶片虫孔针刺状,稀少且分散,抗性等级为1级,BBHTL8-1为高抗玉米螟材料(图5)。

图5 抗玉米螟性能评价Fig.5 Evaluation of Asian corn borer resistance
2.3.2 耐除草剂性能 BBHTL8-1中含有CP4EPSPS蛋白,能够使玉米具有抗草甘膦的特性,对BBHTL8-1抗除草剂性能进行评价,按照正常喷施浓度的4倍进行喷施,在1周和2周后调查死亡率。未喷施除草剂对照组,BBHTL8-1和对照郑58长势一致。喷施草甘膦BBHTL8-1生长不受影响,与未喷施长势一致,而对照郑58则全部死亡,说明BBHTL8-1具有很好的草甘膦抗性(图6)。

图6 抗虫耐除草剂性能评价Fig.6 Evaluation of herbicide tolerance
2.4 BBHTL8-1维生素E组分含量评价
利用胚特异启动子在BBHTL8-1玉米籽粒中过量表达ZmHPT和ZmTMT,对 BBHTL8-1和非转基因对照郑58成熟籽粒不同世代中不同种类生育酚含量进行了检测,结果表明,郑58籽粒中维生素E的组分以γ-生育酚的含量为最高,而转基因植株籽粒中以α-生育酚的含量最高。说明ZmTMT在玉米体内能正常发挥其功能,将低活性的γ-生育酚转为了高活性的α-生育酚。另外,BBHTL8-1籽粒中总生育酚含量也较郑58对照提高约20%(表3)。

表3 BBHTL8-1籽粒中维生素E组分含量Table 3 Content of VE composition of maize seeds in BBHTL8-1 and Zheng 58 (mg·100 g—1)
2.5 BBHTL8-1农艺性状评价
为了研究BBHTL8-1中外源片段5个基因的插入是否会影响玉米农艺性状,将BBHTL8-1与郑58的生育周期、抽雄期、株高、穗位高、穗行数、百粒重、萌发率等农艺性状进行了观察和比较,结果(表4)表明:在正常栽培条件下,转基因BBHTL8-1植株与对照郑58在生育周期、抽雄期、株高、穗位高、穗行数、百粒重、萌发率方面无显著差别,适应性与对照郑58相当。在田间农业生产过程中,因BBHTL8-1具有耐除草剂性能,同时含有抗鳞翅目和鞘翅目害虫基因,在玉米螟、黏虫、棉铃虫、双斑萤叶甲等虫害严重时,其生长性能可能要优于对照郑58。

表4 BBHTL8-1与郑58农艺性状比较Table 4 Comparison of agronomic trais between BBHTL8-1 and Zheng 58
3 讨论
与单性状抗虫或耐除草剂转基因作物相比,复合性状转基因作物能够将多个性状聚集在一个作物,不仅能满足农业发展需求,同时也开辟了新的育种途径[24]。复合性状转基因作物的种植面积呈现逐年增加的趋势。2018年,复合性状的转基因作物种植面积占总面积的42%[4]。转基因作物的复合性状主要以抗虫耐除草剂、多基因复合抗虫为主,涉及的作物包括棉花、玉米、大豆和油菜。由陶氏益农和孟山都公司合作研制的Smartstax™转基因玉米含有8个新基因,具有抗地上害虫和地下害虫以及抗除草剂3种性状[5]。我国自2008年启动转基因生物新品种培育重大专项以来,已培育了众多具有自主知识产权的抗虫耐除草剂复合性状转基因玉米优良转化体[3]。本研究获得的BBHTL8-1株系,Cry1Ab和Cry3Bb蛋白分别抗鳞翅目和鞘翅目害虫,CP4EPSPS耐受草甘膦除草剂,ZmHPT和ZmTMT能够提高籽粒中维生素E组分的含量及有活性的α-生育酚含量。因此,BBHTL8-1是具有多基因抗虫、耐除草剂及品质改良复合性状的转基因玉米株系,将具有广阔的应用前景。
复合性状获得一般通过3个途径,共转化、再转化以及杂交育种复合[25]。共转化已被证明是迄今为止在植物中引入多种基因的最有前途的方法之一,主要优点就是共同导入的外源基因整合在染色体同一位置,确保聚合的不同基因不会在后代分离[26]。目前大多数具有复合性状的转基因作物都是利用传统的育种手段获得的,复合性状对于T-DNA的遗传稳定性没有影响[25]。除了抗虫耐除草剂外,复合抗病性状的基因赋予转基因作物有效抵抗病虫害及杂草的能力[27]。本研究中通过将5个基因表达框聚合在同一载体上,并利用农杆菌侵染玉米幼胚筛选获得了BBHTL8-1株系,这5个基因在专辑株系中能稳定遗传,在转录水平和蛋白水平表达方面具有稳定性(图1~3)。随着生物技术的发展,聚合更多基因成为可能,利用GAANTRY stacking系统可以将含有10个25.8 kb的T-DNA片段导入植物体,并可以聚合更多的基因,获得具有多个复合性状的转基因植物[26]。
本研究中获得的BBHTL8-1与非转基因对照在农艺性状上没有明显差异。进一步的研究将对BBHTL8-1的分子特征、环境安全和食品安全等方面进行环境释放阶段的安全评价,为BBHTL8-1下一阶段的转基因安全评价申报奠定基础,加快转基因抗虫耐除草剂及品质改良玉米新品系的培育。

