油菜素内酯调控植物根系发育机制研究进展
吴志勇,顾红,程大伟,李兰,何莎莎,李明,陈锦永
(中国农业科学院郑州果树研究所,果树生长发育与品质控制重点开放实验室,郑州 450009)
油菜素甾醇(brassinosteroids,BRs)是继生长素(auxin)、细胞分裂素(cytokinin,CTK)、赤霉素(gibberellin,GA)、乙烯(ethylene,ETH)和脱落酸(abscisic acid,ABA)之后被发现的第6类植物激素,参与调控植物发育的各个过程,其中对植物根系发育过程具有重要调控作用。根系是植物的重要器官,具有吸收水分和养分、改善土壤理化性质、合成激素等功能,对植物生长发育具有重要作用。健壮的根系对产量提高至关重要,研究人员将通过改良和利用根系结构来提高产量认定为新的绿色革命[1],但其茁壮成长需要内源激素和外界环境的共同调节。BR作为调控植物根系生长发育的重要激素之一,与众多内源植物激素相互作用,形成一个复杂的调控网络,共同调控植物根、茎、叶、花等器官的生长发育[2]。目前,科学家对BR的生理功能、结构、合成与代谢途径以及信号转导通路等方面的研究取得了诸多进展。本文总结概述了BR信号通路及其在模式植物拟南芥根系中的调控网络,进一步揭示其在根系生长发育中的调控机制,为BR在调控根系发育中的应用提供理论依据。
1 BR的发现
1970年,美国科学家Mitchell等[3]从油菜花粉中提取出一种活性极高的物质,经过研究发现其对菜豆生长具有较为明显的促进作用,并将其命名为油菜素(brassin)。1979年,Grove等[4]对其化学结构进行分析,认定为一种甾醇类化合物,正式将其命名为油菜素内酯(brassinolide,BL)。此后,众多与油菜素内酯类似的化合物从不同植物中被分离出来,统称为油菜素甾醇类化合物(brassinosteroids,BRs)[5]。经研究发现,植物根、茎、叶、果实、种子等器官均含有BR,且BR在其发育过程中具有不可替代的作用。因此,认为BR对植物生长发育具有重要作用。
2 BR信号通路研究
BRI1(brassinosteroid insensitive 1)受体在细胞表面接收BR信号。目前认为BR信号激活BRI1活性存在两种机制:一种机制认为BAK1(BRI1-associated recepor kinase 1)是 BRI1共受体,与其结构相似,二者在体内外均可进行相互作用,BR首先诱导BRI1与BAK1形成异二聚体,然后在BRI1和BAK1之间发生相互磷酸化[6-9],进而调控根细胞发育;另一种机制认为BR结合并诱导BRI1的同型二聚体构象发生变化,激活其活性后再磷酸化 BAK1[10],磷酸化后的 BRI1 和 BAK1作用于下游原件BES1(BRI1-EMS-suppressor 1)和BZR1(brassinazole-resistant 1),使它们在细胞核内接收上游信号[10-14],二者活性被激活后进一步调控根细胞发生分裂或分化。
在BR信号转导过程中,BIN2(brassinosteroid insensitive 2)激酶是抑制BR信号转导的关键。分析突变体bin2-1表明,BIN2在BR信号转导中通过磷酸化作用使BES1和BZR1失活,它们不能与DNA结合而丧失功能,从而阻遏BR的信号转导[15-18]。相反,BR信号转导正常是BIN2激酶被降解所造成的,且施加有活性的外源BR能够减少BIN2激酶的积累[19]。此外,研究发现BSU1(BRI1-suppressor1)编码的丝氨酸/苏氨酸蛋白激酶也能拮抗BIN2激酶,通过调控BES1的磷酸化状态提高BES1的去磷酸化水平,进一步活化细胞核内BR诱导基因的表达[20]。
3 BR调控植物根系生长发育
3.1 BR调控根系干细胞生态位
干细胞生态位由QC(quiescent center)细胞和周围干细胞组成,QC细胞对于维持干细胞生态位稳定和生长状态至关重要(图1)。研究表明,BR对QC细胞和干细胞具有重要调控作用,BRI1家族成员BRL1(BRI1-like1)、BRL3和共受体BAK1在干细胞中表达水平较高,BR与它们结合并激活其活性,活化后的BRL1和BRL3相互作用调控转录因子WOX5(wuschel-related homeobox 5),并进一步调控QC细胞的稳定和分裂[21-23]。
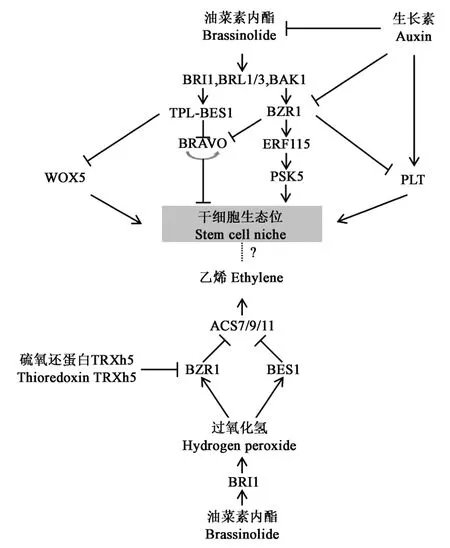
图1 BR调控根系干细胞生态位[21]Fig.1 BR regulates root stem cell niche[21]
前人研究发现,BRAVO CENTER(brassinosteroids at vascular and organizing center)和ERF115(ethylene response factor 115)在调控QC细胞方面起到相反的作用[24-25]。BR信号激活BES1转录因子后直接抑制BRAVO表达,从而调控QC细胞,且BRAVO具有自我转录功能[24]。另外,研究发现了Groucho/Tup1转录家族TPL(topless)和BES1-TPL的相互作用能够提高BES1的转录活性,且BES1-TPL的相互作用能更有效地抑制BRAVO表达,这对于BES1介导的QC细胞分裂是必不可少的[25]。BZR1也可以直接抑制BRAVO表达,从而促进QC细胞分裂[26]。相反,BZR1介导的BR信号通过激活ERF115,使得PSK5表达上调,进而促进QC细胞分裂[27]。
PLETHORA(PLT)是AP2转录因子家族的成员,对于维持干细胞生态位具有重要作用[28-29]。AUXIN能够诱导PLT表达,但BZR1介导的BR信号能够抑制其表达,这表明BR和AUXIN对QC细胞分裂具有拮抗作用[30]。
H2O2(hydrogen peroxide)对于BR促进QC细胞分裂也是必需的(图1)。H2O2能够促进BZR1和BES1转录,但BZR1的氧化还原介质TRXh5的过表达却使其转录活性降低,抑制QC细胞分裂[31]。在另一项研究中发现,BES1和BZR1转录因子能够直接与ACS7/9/11启动子相互作用来调控ETH表达,从而调控根系生长[32],但是否能够调控干细胞生态位,目前还没有明确结论,需要进一步研究。
3.2 BR调控根尖分生区
根分生组织是决定根发育的关键区域,不断进行增殖和分化。BR对其调控具有时空平衡和激素互作平衡的特点[33]。作用部位不同,BR调控机制也不尽相同。根表皮细胞中的BRI1感受BR信号,能够完全恢复突变体bri1-116的分生组织大小,而中柱的BRI1对其影响较小,这表明表皮中的BRI1可以通过感知BR信号控制根分生组织大小[34]。研究也发现,根表皮中的BRI1感受BR信号能够促进根分生组织中AUXIN表达,进而促进根分生组织增殖,而中柱中BR信号激活BAK1、BRL1和BRL3活性则抵消这种作用,表现为促进分化[35]。
SHY2(short hypocotyl 2)是AUXIN信号的阻遏物,BRX(brevis radix)参与BR信号途径,在BR同AUXIN、CTK互作调控根分生组织生长和发育过程中,SHY2和BRX发挥着重要作用。从图2可以看出,根分生组织发育早期受到激素平衡的调控,CTK通过作用于ARR12转录因子激活SHY2表达,并进一步抑制PIN表达,从而调控根分生组织发育[36-37]。BRX能被IAA大量诱导,却被BR轻微抑制,在与SHY2竞争中,BRX占据优势,可短暂增强PIN3表达,二者共同调控根分生组织发育[38-39]。此时,根分生组织主要进行分裂生长。随着根分生组织的发育,CTK也激活了ARR1/AHK3转录因子,它与ARR12转录因子一起诱导SHY2表达,SHY2大量表达能够抑制BRX功能,二者共同调控根分生组织发育[37-40]。此外,最近研究发现,BR信号可通过诱导BES1的表达抑制SHY2表达,且BES1还能够直接作用于PIN7来调控根分生组织发育[41]。以上结果表明,BR能较好地维持根分生组织分裂与分化的平衡。
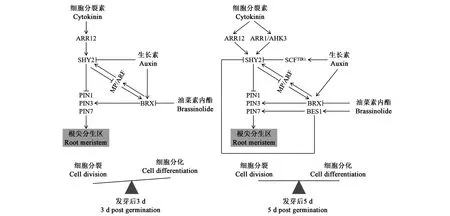
图2 BR调控根尖分生区Fig.2 BR regulates root apical meristem
3.3 BR调控根细胞伸长
细胞伸长对根系生长发育具有重要作用。研究发现,BR对根表皮细胞伸长具有特异作用。在根毛细胞中表达的BRI1促进了根伸长区内所有不同类型细胞的伸长,而在非根毛细胞中表达的BRI1则表现出相反作用[42](图3)。此外,非根毛细胞中BRI1表达还促进了ETH合成基因的表达,导致ETH含量增加,使得非根毛细胞的细胞壁中积累了大量结晶纤维素,从而抑制根的生长[42]。
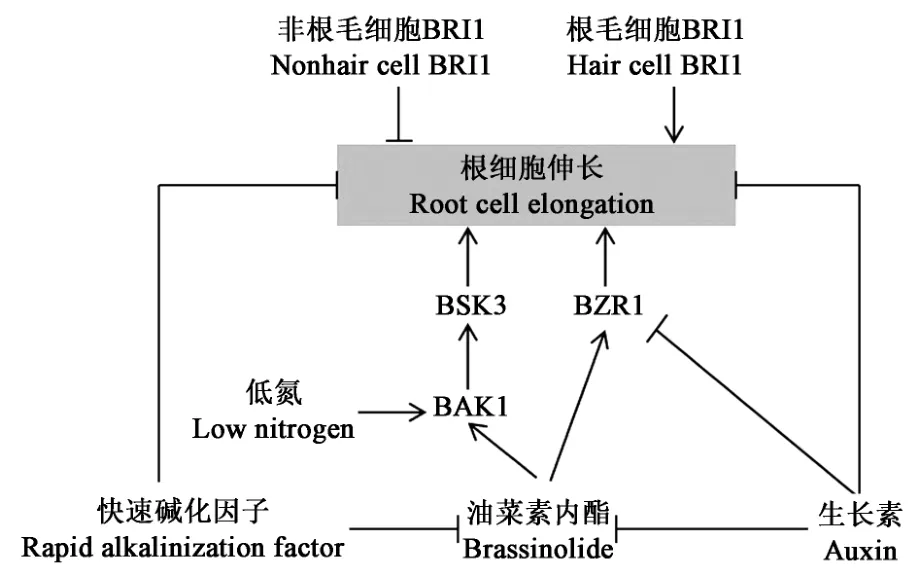
图3 BR调控根细胞伸长Fig.3 BR regulates root cell elongation
RALF(rapid alkalinization factor)是一种肽类激素。过表达AtRALF1能够使根细胞体积减小,而沉默AtRALF1则能增加根细胞体积,从而促进根生长[43](图3)。RALF和BR同时处理则会使BR合成基因以及RALF诱导的与细胞壁重排相关的基因表达下调,从而影响根细胞生长[43]。
BR和AUXIN在根细胞生长过程中的拮抗作用通过BZR1完成(图3)。BZR1主要在过渡区和伸长区的表皮细胞核中转录,能够激活大部分参与细胞壁形成的基因表达,而AUXIN通过抑制BZR1转录,间接抑制这些基因表达,这表明BR和AUXIN在根细胞伸长中表现为相互拮抗[30]。
此外,最新研究表明,低氮可上调BAK1的表达量,通过激活BR信号,进一步促进下游BSK3表达,进而促进根细胞伸长[44]。
3.4 BR调控侧根生长发育
植物侧根能够从周围环境汲取水分和养分,对维持植物生长具有重要作用。AUXIN和BR共同调控侧根生长发育(图4)。早期研究发现,低浓度BR通过增加AUXIN的极性运输促进侧根的发育;相反,高浓度BR则抑制侧根形成[45-46]。DWF4(dwarf 4)是BR合成路径上的重要调控因子。研究发现,AUXIN通过促进DWF4转录来调控侧根发育,且DWF4可促进BR合成,因此BR和AUXIN在调控侧根发育方面表现出协同作用,虽然BR也可以抑制DWF4转录,但是DWF4的负反馈机制可能更多的是在维持BR含量稳定方面起重要作用[47-49]。此外,BR信号转导的负调控因子BIN2 对侧根发育有积极作用,Puna[47]推测,BIN2可能参与到DWF4的调控中,具体机制还需要进一步研究。在另一项研究中发现,BIN2在上游调控因子TDIF-TDR(tracheary element differentiation inhibitory factor-tdif receptor)作用下通过磷酸化ARF7/19,能够进一步调节侧根发育中的AUXIN信号[49]。Kim等[50]研究发现,过表达BARK1(BAK1-associatingreceptor-likekinase1)能够促进侧根发育,并观察到ARF(auxinresponsefactor)的表达量在BARK1过表达植株中会被上调,因此猜测BARK1蛋白可能通过AUXIN的调控参与到BR调控的侧根发育中。
此外,BR还与其他信号共同调控侧根发育(图4)。RALF是一种多肽信号,沉默AtRALF可以增加侧根数量,而过表达AtRALF则减少侧根数,且AtRALF能够诱导BR合成路径中DWF4和CPD(constitutivephotomorphogenesisanddwarfism)基因表达量下调,这些结果表明AtRALF在调控侧根发育方面和BR相互拮抗[51]。RAV1是一种DNA结合蛋白,BR能够下调RAV1转录,RAV1过表达能够延缓侧根发育,但具体机制还需进一步研究[52]。LPE(lysophosphatidylethanolamine)是 PLA2水解磷脂酰乙醇胺的产物,能够激活BR信号转导中的基因表达,促进侧根发育[53]。Vercruyssen 等[54]发现,BR和CKX3(cytokinin oxidase/dehydrogenase 3)的联合作用能够进一步促进侧根的形成和伸长,且认为CTK的缺乏增强了BR对侧根生长的影响。之后研究发现,CTK受体基因AHK2和AHK3突变能促使植株产生高密度侧根,且ahk2、ahk3双突变体在侧根生长中对BR高度敏感,这表明CTK通过AHK2和AHK3与BR在侧根发育中相互拮抗[55]。Glc对调节侧根发育也有重要作用,研究表明,Glc通过激活 HXK1(hexokinase 1)促进BR信号传导,并通过调节根系中生长素输出载体PIN1、PIN2、PGP1和MDR1以及生长素输入载体AUX1、LAX2和LAX3的转录水平,促进参与侧根发生的AUX/IAAs(IAA14/SLR等)的降解,AUX/IAAs的降解进一步激活ARF7/ARF19,从而促进侧根的发育[46]。此外,最新研究发现,BR诱导BRS1(BRI1 suppressor 1)转录能够促进侧根原基突破内皮层、皮层和表皮,从而促进侧根长出[56]。
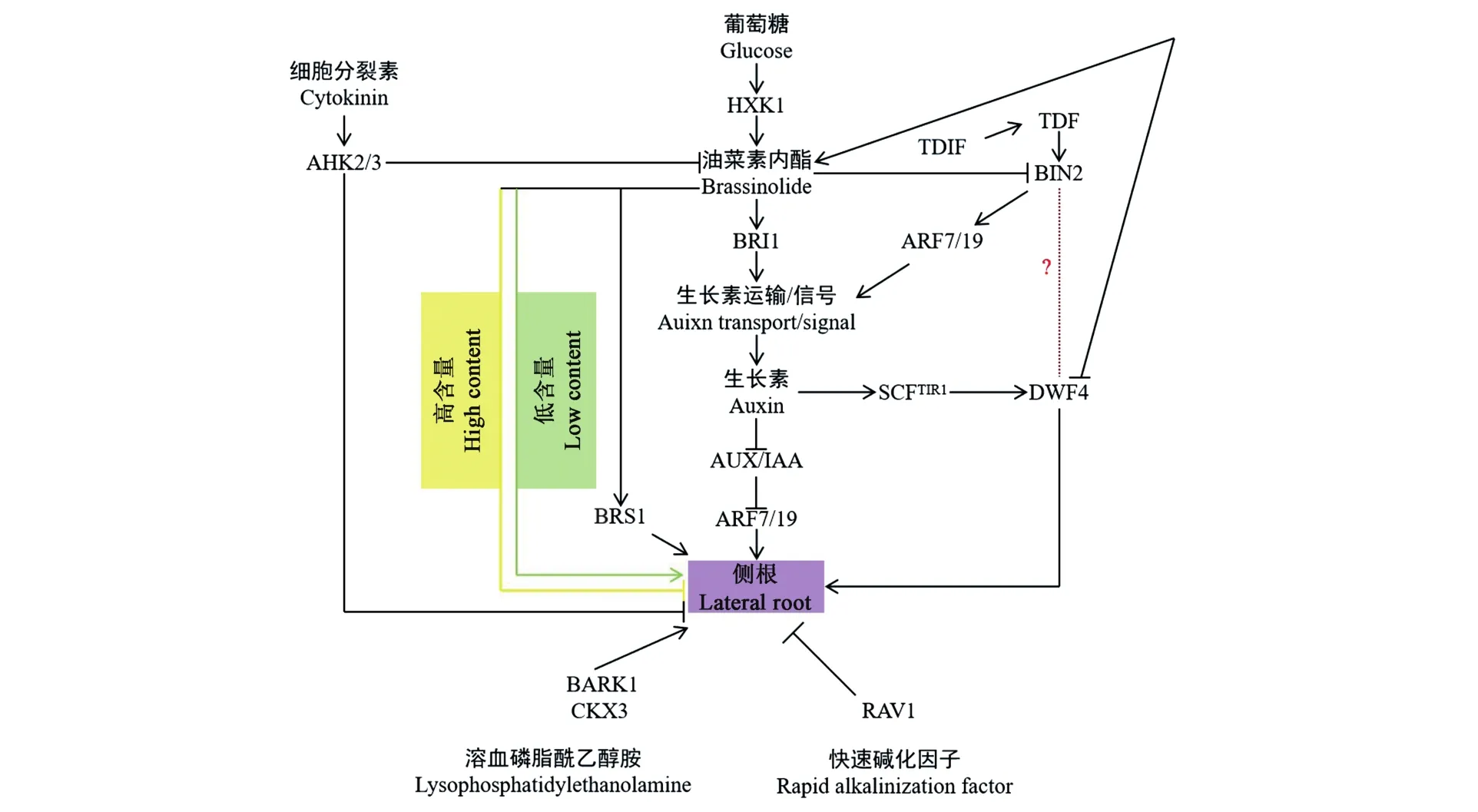
图4 BR调控侧根生长发育Fig.4 BR regulates lateral root growth and development
3.5 BR调控根毛生长发育
根毛由分生区的表皮细胞分化形成,根毛的形成不仅增大了主根和侧根的整体表面积,而且增强了与土壤周围环境的互动(图5)。表皮细胞因其在皮层细胞下的位置不同而发育成根毛细胞和非根毛细胞两种不同类型的细胞,当表皮细胞位于两个相邻皮层细胞的空隙时会发育成根毛细胞,而紧邻单个皮层细胞时会发育成非根毛细胞[57-59]。研究表明,根毛细胞的分化受到一系列转录因子调控,如WER(werewolf)、TTG(transparenttesta glabra)、GL3(glabra 3)、EGL3(enhancer of glabra 3)、GL2(glabra 2)、CPC(caprice)等[60-64]。Kuppusamy等[65]首次将BR应用于根毛发育的研究,提出BR对根毛细胞的调控是必需的,通过调控WER、GL2和CPC的转录来影响根毛细胞的早期发育阶段,非根毛细胞中的BR信号通过作用于BRI1诱导WER表达,导致CPC积累,而CPC能够转移到邻近的根毛细胞中,抑制WER和GL2表达。此外,Kuppusamy等[65]还进一步证实了根毛细胞中转移进来的CPC能够促进SCM(scrambled)积累,进一步抑制WER表达。Cheng等[66]研究发现,在没有 BR 时,WER-GL3/EGL3-TTG1复合体由于WER表达量下调和BIN2的磷酸化导致其在根毛细胞和非根毛细胞中的形成和活性都受到抑制,从而抑制GL2表达;当有BR时,BR信号能够抑制BIN2激酶活性,使得根毛细胞中的EGL3和TTG1未被磷酸化而行使正常功能,形成的WER-EGL3-TTG1复合体能够促进GL2的表达;在非根毛细胞中,GL3与WER和TTG1形成复合体并促进GL2的表达。
最新研究发现,AGP21(arabinogalactan peptide 21)对根毛发育也是必需的(图5)。BR信号激活转录因子BZR1正向调控AGP21,AGP21通过抑制GL2的表达,激活下游基因RHD6(roothairdefective6)、RSL4(roothairdefectivelike-4)、EXP7(exportin7),从而促进根毛的发育[67]。
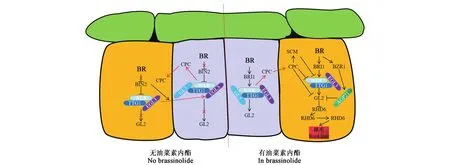
图5 BR调控根毛生长发育[33]Fig.5 BR regulates root hair growth and development[33]
3.6 BR调控根系向地性
植物根系向着地心引力的方向生长,能够深入土壤中吸收水分和养分,维持地上部分生长。BR与AUXIN共同调控根的向地性。BR通过促进AUXIN输出载体PIN2蛋白从根尖向伸长区的积累,并刺激ROP2(rho-of-plant2)在向性反应中的表达和分散定位,从而增强植物的向性反应[68]。Kim等[69]研究发现,BR能够提高突变体auxi-7和pin2根的向地性,而施加AUXIN能够减弱BR诱导的根系重力敏感性。Lanza等[70]研究发现,BR通过改变PIN2极性定位和AUXIN梯度来调节根的重力响应。BR信号转导与内吞PIN2分选之间的相互作用,通过减少细胞伸长差异来确定重力诱导根弯曲的速率,BR通过调控PIN2分类和在细胞内的分布来控制着侧向PIN2梯度的形成,但这并不是根系弯曲的先决条件,而是抑制了AUXIN的不对称流动和信号转导[71]。
BR还与其他信号共同调控根系向地性。Glc通过增加BR受体BRI1的内吞作用,增强BR信号转导,诱导根偏差反应,而CTK和ETH与BR起拮抗作用,在BR下游起作用,以控制这种反应[72-73]。big5-1突变体和big3-1、big5-1双突变体根系弯曲加速,表现出强的根系重力反应,用BR处理野生型拟南芥表现出扭曲的根系生长,相比之下突变体对BR处理不敏感,弯曲根显著减少[74]。
4 展望
BR作为一种植物内源激素,与其他激素一样,也有其庞大而复杂的信号调控网络。虽然BR在根系发育过程中的主要调控机制研究已经取得很大进展,但仍有许多问题尚待研究,如:①为何低含量的BR能够促进根系发育,而高含量的BR却抑制根系发育;②BR是否还与其他信号分子在调控根系发育方面有关联;③植物如何通过感受内外环境线索来控制BR动态平衡等。
综上分析,今后应从以下几个方面对植物根系展开研究:①从蛋白层面深入解析低含量BR和高含量BR调控根系发育的机制;②进一步挖掘与BR互作的其他信号分子种类及其互作机理;③从空间和时间方面研究根系中BR动态平衡机制;④从调控根系网络的整体性方面研究BR与其他激素相互作用的分子机制。因此,对BR调控根系发育机制的深入研究,不仅为完善根系发育机制提供理论基础,也对提高作物产量具有重要意义。

