基于炎症免疫调节探讨秦皮素抗动脉粥样硬化的作用及机制研究①
江 钰 胡金霞 赵翠霞 刘 涛 胡婧灵
(新疆维吾尔自治区中医药研究院老年病科,乌鲁木齐 830000)
动脉粥样硬化(atherosclerosis,AS)是动脉管壁的一种长期的慢性炎症性疾病[1]。AS 及其并发症(冠心病)每年导致的死亡人数高居不下,严重危害人类健康[2]。在AS 的发病过程中,免疫反应发挥多重而复杂的作用,贯穿AS 的发生发展[3]。越来越多的证据显示,AS 不但具有慢性炎症的特征,其炎症反应的起始与持续都有先天性和获得性免疫应答的参与[4]。秦皮素(fraxetin,FRA)别名白蜡树内酯,是一种天然香豆素类化合物,具有多种药理学作用,如抗氧化、抗炎、抗菌、抗肿瘤等[5]。因此设想秦皮素可能参与调节AS过程中的炎症免疫反应,并具有抗AS 的作用。本研究将系统地探讨秦皮素在体内对AS 的抵抗作用,并综合评价其对体内AS 模型炎症反应、免疫反应的调节作用,为AS 的治疗提供新的方法,为秦皮素的成药发展奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 80 只雄性5 周龄C57BL/6 背景的ApoE-/-小鼠,体质量(13~15)g,购自新疆医科大学动物实验中心。将实验动物饲养于新疆医科大学动物实验中心动物房。饲养温度为(22±2)℃,湿度为(60±5)%,光照/黑暗周期为12 h。2 周适应环境,正常饮水饮食。
1.1.2 主要试剂 秦皮素(纯度≥98%)购自上海源叶生物科技有限公司;苏木精-伊红(HE)试剂盒、二氨基联苯胺(3,3'-diaminnobenzidine,DAB)显色盒及免疫组化试剂盒购自北京索莱宝生物科技有限公司;Masson 染色试剂盒购自美国Sigma 公司;氧化型低密度脂蛋白(oxidized low density lipoprotein,oxLDL)试剂盒、TNF-α 试剂盒、IL-1β 试剂盒及IL-6试剂盒购自南京凯基生物科技有限公司;鼠抗巨噬细胞/单核细胞(Monocyte+Macrophage,MOMA-2)和lexa Fluor®594 标记的驴抗鼠荧光二抗购自美国Abcam公司;兔抗CD40抗体、兔抗基质金属蛋白酶-9(matrix metalloproteinase-9,MMP-9)抗体、兔抗血管细胞黏附分子-1(vascular cell adhesion molecule-1,VCAM-1)抗体和山羊抗兔IgG二抗购自Cell Signaling Technology 公司;Trizol 试剂、cDNA 逆转录试剂盒及SYBR Premix EX TaqTM试剂盒购自日本TaKaRa公司。
1.2 方法
1.2.1 动物造模 建立AS 模型:将ApoE-/-小鼠用高脂饲料(主要成分包括15%脂肪、1.25%胆固醇、0.2%胆酸盐)饲养12周,小鼠在主动脉弓等大动脉处有不同程度的斑块形成,视为造模成功。
1.2.2 实验分组及给药 实验分为4 组:对照组、模型组(AS组)、秦皮素低剂量组(AS+FRA-L组)、秦皮素高剂量组(AS+FRA-H 组),每组20 只小鼠。对照组小鼠使用正常饲料饲养,AS组、AS+FRA-L组及AS+FRA-H 组小鼠使用高脂饲料饲养。给药方式为灌胃,对照组:生理盐水;AS组:生理盐水;AS+FRA-L组:20 mg/kg的秦皮素;AS+FRA-H 组:50 mg/kg的秦皮素,1次/d,连续12周。
1.2.3 血脂水平测定 给药结束后,将各组小鼠禁食12 h,用3%戊巴比妥麻醉小鼠,眼球取血1 ml,4℃高速离心机中以1 000 g 离心15 min 分离血清。利用德国罗氏日立MODULAR全自动生化分析仪测定总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoproteincholesterol,LDL-C)和高密度脂蛋白胆固醇(high density lipoprotein-cholesterol,HDL-C)含量。
1.2.4 ELISA 检测小鼠血清oxLDL、TNF-α、IL-β 及IL-6含量 收集各组小鼠血清进行ELISA 实验检测血清中oxLDL、TNF-α、IL-β及IL-6含量。①加样:设置空白孔、标准孔、待测样品孔。空白孔加样品稀释液50 μl,标准孔加入不同浓度的标准品50 μl,待测样品孔加入不同组别的小鼠血清50 μl。37℃反应60 min;②弃去孔中液体,每孔加入检测A 工作液50 μl,37℃孵育60 min;③弃去孔内液体,洗板3 次后甩干,每孔加入检测B 工作液50 μl,37℃孵育60 min;④弃去孔内液体,洗板3 次后甩干,每孔加入底物溶液45 μl,37℃避光显色15 min;⑤依序每孔加入终止液45 μl,终止显色;⑥用酶联仪在450 nm波长依序测定各孔的光密度(OD 值);⑦以标准品的浓度为横坐标,OD 值为纵坐标,绘制标准曲线,根据样品的OD值由标准曲线查出相应的浓度。
1.2.5 HE染色检测小鼠主动脉中斑块形成情况①处死小鼠后,剪取长约l mm 的主动脉。用最佳切片温度(optimum cutting temperature,OCT)包埋剂包埋,并制作成6 μm 厚的冰冻切片,将切片在蒸馏水中漂洗3 min;②将切片放入苏木素染液中染色5 min,自来水清洗后,置于1%的盐酸乙醇中分化数秒,流水冲洗;③0.6%氨水返蓝,流水冲洗;④将切片放入伊红染液中染色3 min,流水稍洗;⑤梯度乙醇(70%、80%、90%、100%)脱水,各5 min;⑥将切片放入二甲苯Ⅰ、Ⅱ中各5 min;⑦将切片取出,用滤纸轻轻拭干切片上残余的二甲苯,在组织上滴加中性树胶,使用盖玻片封片;⑧待中性树脂完全凝固后,使用莱卡显微镜拍摄照片。
1.2.6 油红O染色检测AS斑块内脂质沉积变化①取各组小鼠主动脉冰冻切片复温1 h,于37℃烘箱中烤片30 min,防止脱片;②将切片放置在60%异丙醇中浸泡1 min,PBS 清洗3 次,3 min/次;③将切片置于油红溶液中染色30 min,37℃温浴,PBS清洗2 次,3 min/次;④使用苏木素染色30~60 s,1%盐酸乙醇分化,1%氨水返蓝,PBS 清洗3 次,3 min/次;⑤滤纸吸干残余水分,甘油明胶封片;⑥使用莱卡显微镜拍摄照片。
1.2.7 Masson 染色观察主动脉中胶原蛋白含量①取各组小鼠主动脉冰冻切片,复温1 h,在37℃烘箱中烤片30 min,防止脱片;②PBS清洗3次,3 min/次,于组织上滴加50 μl Bouin's 2000TM溶液,于60℃烤箱中烤片1~1.5 h;③纯净水冲洗切片至组织无色;④将切片置于苏木素中染色5 min。纯净水清洗切片2 min;⑤在组织上滴加1 滴猩红-酸品红染色液,染色10 min,纯净水清洗切片2 min;⑥在组织上滴加1 滴磷钼酸染液染色12 min,用滤纸洗去多余染液;⑦在组织上滴加1 滴苯胺蓝染色8 min 后,纯净水清洗切片2 min;⑧在组织上滴加1 滴1%的醋酸孵育4 min;⑨分别用70%、80%、90%、100%的乙醇浸泡切片脱水后,二甲苯浸泡2次,2 min/次,中性树胶封片;⑩显微镜观察并拍照。
1.2.8 免疫荧光检测小鼠AS 斑块中巨噬细胞MOMA-2 表达 ①取各组小鼠主动脉冰冻切片,复温1 h,37℃烤箱中烤片30 min,防止脱片;②PBS 清洗3次,2 min/次,用20%血清室温封闭30 min;③弃去血清,使用滤纸吸去残余血清,按适当比例稀释MOMA-2 抗体后取30 μl 滴加在组织上,4℃孵育过夜;④PBS 润洗3 次后,向组织上滴加lexa Fluor®594标记的荧光二抗,避光室温孵育1 h;⑤PBS润洗3次后,在组织上滴加适量4',6-二脒基-2-苯基吲哚二盐酸盐(DAPI)染细胞核,避光孵育10 min;⑥弃掉DAPI 染液,PBS 润洗3 次,用滤纸擦去多余水分,滴加抗猝灭剂封片;⑦使用荧光显微镜在594 nm 激发光下观察并拍摄照片,红色为MOMA-2。
1.2.9 免疫组化检测小鼠主动脉中CD40、MMP-9、VCAM-1 蛋白表达 ①取各组小鼠主动脉冰冻切片,复温1 h,在37℃烘箱中烤片30 min,防止脱片;②用PBS 清洗3 次,3 min/次;③将切片放入新鲜配制的3%H2O2溶液中8 min,使内源性过氧化物灭活,PBS清洗切片3 min×3次;④滴加正常10%山羊血清封闭液,室温孵育20 min 后,用滤纸吸取多余液体;⑤滴加适量稀释的一抗,4℃孵育过夜,PBS清洗3次,3 min/次;⑥滴加相应的二抗,室温孵育2 h 后,PBS清洗3次,3 min/次;⑦取DAB显色试剂盒中的A,B,C试剂各1 滴于切片,室温显色后,于显微镜下观察,显色理想后将切片置于纯净水中终止显色;⑧苏木素轻度复染胞核60 s,流水冲洗60 s,1%盐酸乙醇分化3 s,流水冲洗2 min;⑨梯度乙醇脱水,二甲苯透明,中性树胶封片;⑩使用莱卡显微镜观察并采集图像,目标蛋白呈棕黄色。
1.2.10 qRT-PCR检测小鼠主动脉中CD40、MMP-9、VCAM-1 的mRNA 表达 取各组小鼠的主动脉组织,加入Trizol 溶液后,于组织匀浆机中打碎。转移至EP 管中,静置20 min。每管加入0.2 ml 氯仿,振荡15 s,室温静置5 min。4℃、16 113 g 离心20 min。取上清并加入等体积的异丙醇,混合均匀,静置10 min。4℃、16 113 g 离心20 min,加入适量75%乙醇收集下层沉淀。使用紫外分光光度计检测RNA的纯度和含量,并将每个配对的样品调节至相同浓度,然后按照cDNA 逆转录试剂盒将总RNA 反转录成cDNA。从GenBank 中查出小鼠CD40、MMP-9、VCAM-1和β-actin的mRNA序列,使用Primer Express软件设计专一性引物。使用SYBR Premix EX TaqTM试剂盒进行qRT-PCR。使用FTC-3000p实时PCR系统完成实验后,采用2-ΔΔCt法分析数据。引物序列见表1。
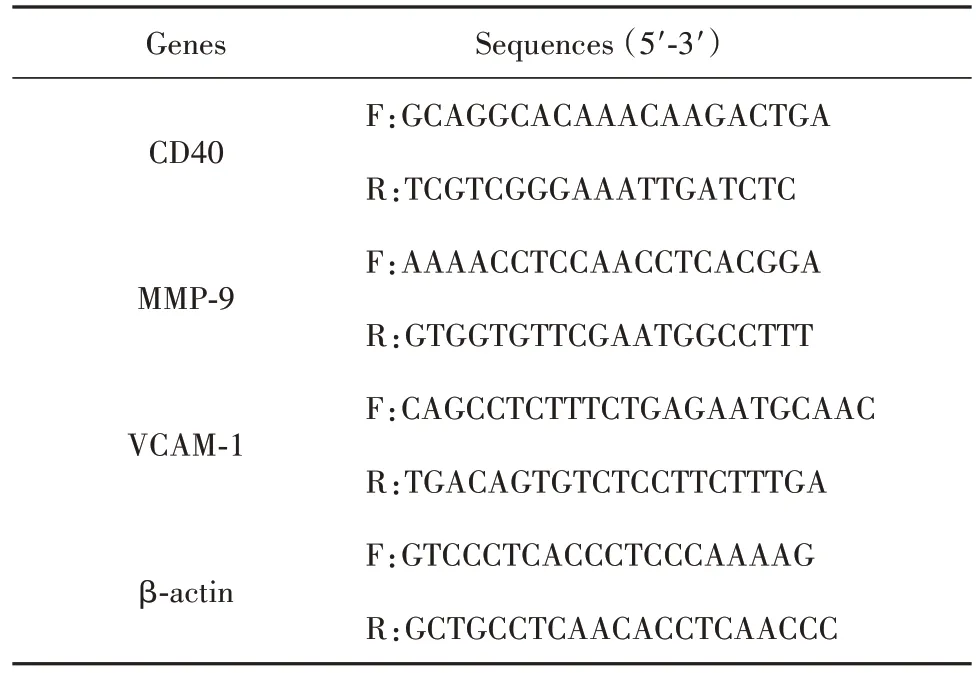
表1 引物序列Tab.1 Primer sequences
1.3 统计学处理 采用SPSS19.0软件进行统计学分析,至少取3次独立实验结果,正态分布数据资料以表示,多组间比较采用单因素方差分析,组间比较采用q检验,率的比较采用χ2检验。检验水准α=0.05。P<0.05表示差异有统计学意义。
2 结果
2.1 各组小鼠血清中TC、TG、LDL-C 和HDL-C 水平比较 如图1 所示,与对照组相比,AS 组小鼠血清中TC、TG、LDL-C 含量显著升高(均P<0.001),HDL-C 含量显著降低(P<0.001);与AS组相比,AS+FRA-L组和AS+FRA-H组小鼠血清中TC、TG、LDL-C含量降低(均P<0.05),HDL-C 含量升高(P<0.05),且AS+FRA-H组作用更明显。
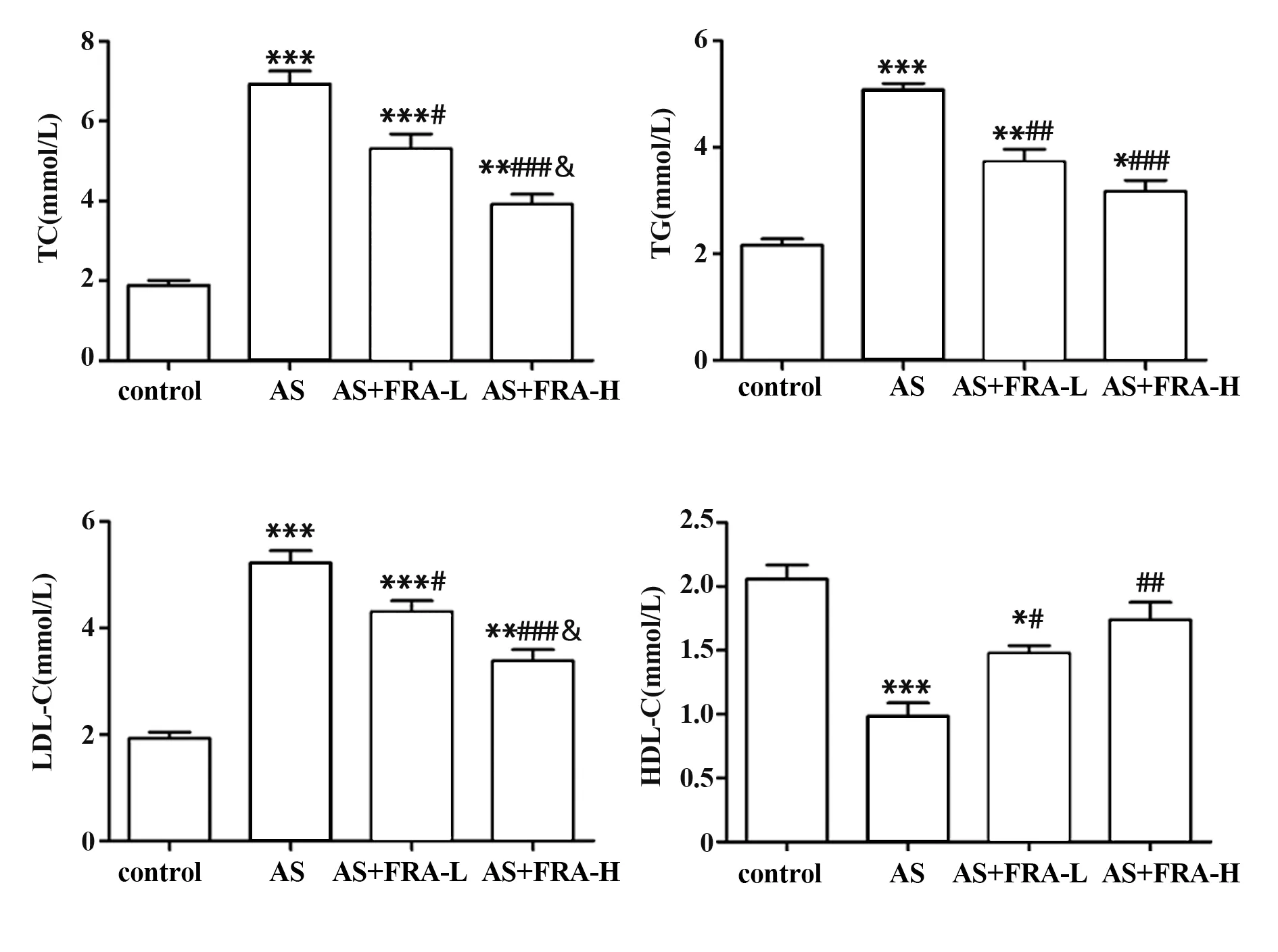
图1 各组小鼠血清中TC、TG、LDL-C和HDL-C水平分析Fig.1 Analysis of TC,TG,LDL-C and HDL-C levels in serum of mice in each group
2.2 各组小鼠血清中oxLDL、TNF-α、IL-1β 和IL-6含量分析 如图2 所示,与对照组相比,AS 组小鼠血清中oxLDL、TNF-α、IL-1β 和IL-6 含量显著升高(均P<0.001);与AS 组相比,AS+FRA-L 组和AS+FRA-H 组小鼠血清中oxLDL、TNF-α、IL-1β 和IL-6含量降低(均P<0.05),且呈剂量依赖性。
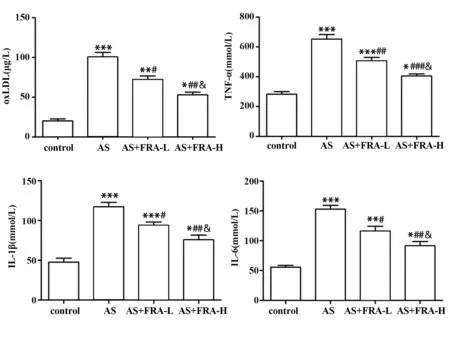
图2 ELISA 检测各组小鼠血清中oxLDL、TNF-α、IL-1β和IL-6含量变化Fig.2 ELISA was used to detect changes of oxLDL,TNF-α,IL-1β and IL-6 in serum of mice in each group
2.3 各组小鼠主动脉根部斑块形成变化 如图3所示,与对照组相比,AS 组小鼠主动脉根部显示出明显的AS 斑块形成(P<0.001);与AS 组相比,AS+FRA-L 组和AS+FRA-H 组小鼠主动脉根部AS 斑块面积明显减小(均P<0.01),且AS+FRA-H 组小鼠主动脉根部AS斑块减少更明显。
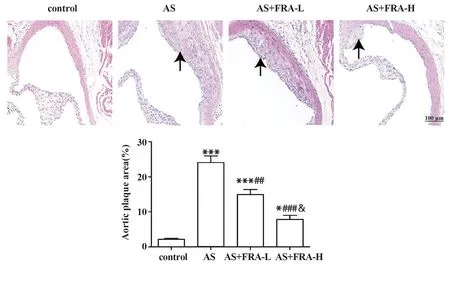
图3 HE 染色检测各组小鼠主动脉根部斑块面积变化(×200)Fig.3 HE staining was used to detect changes of aortic root plaque area of mice in each group(×200)
2.4 各组小鼠主动脉脂质沉积变化 如图4所示,与对照组相比,AS组小鼠主动脉上有大量红色脂质沉积(P<0.001);与AS 组相比,AS+FRA-L 组和AS+FRA-H 组小鼠主动脉上的脂质沉积较少(均P<0.05),其中AS+FRA-H组减少最为明显。
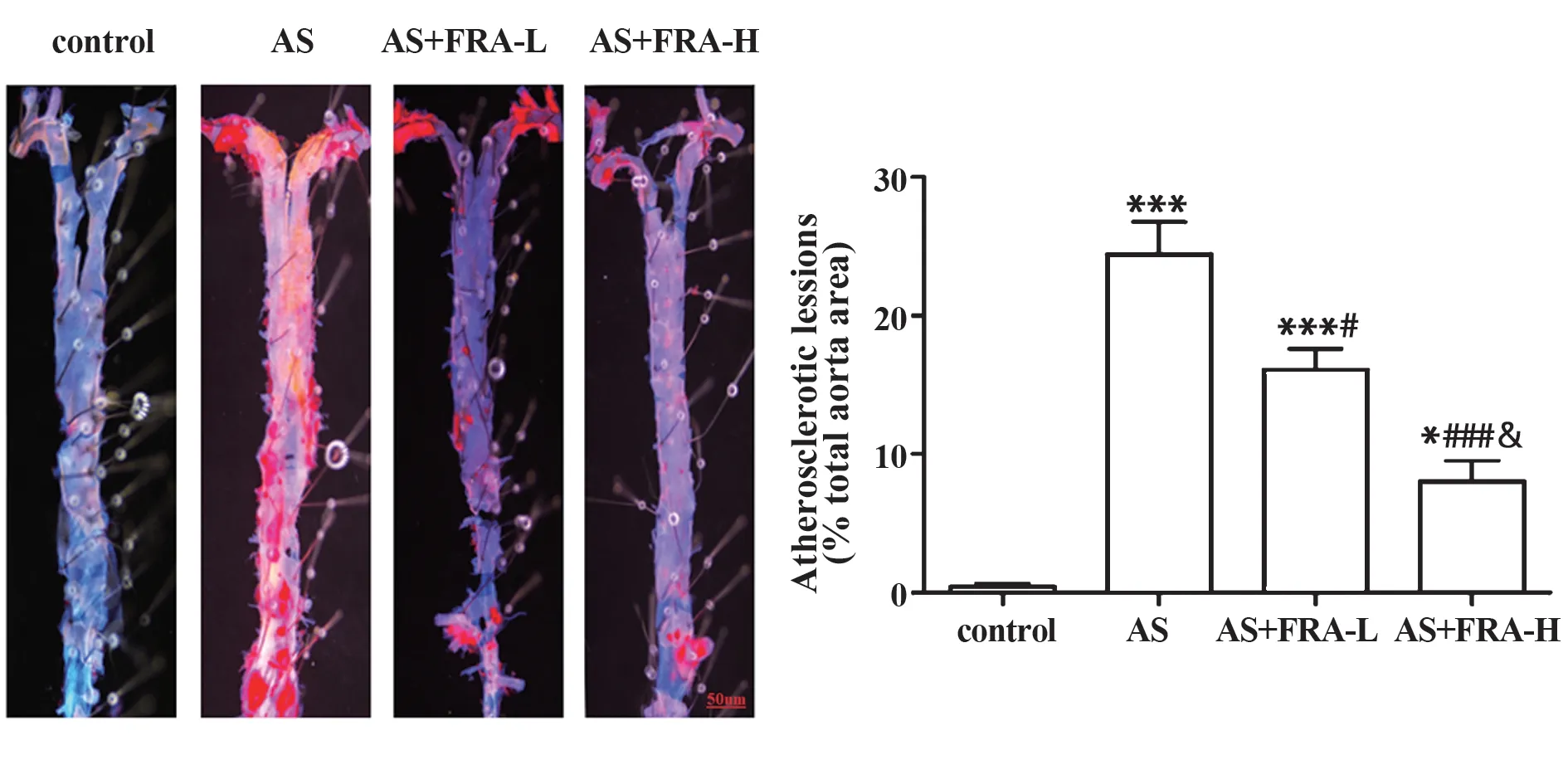
图4 油红O 染色检测各组小鼠主动脉上脂质沉积变化(×100)Fig.4 Changes of lipid deposition on aorta of mice in each group were detected by oil red O staining(×100)
2.5 各组小鼠主动脉中胶原蛋白含量变化 如图5所示,对照组小鼠主动脉壁表现出大量的胶原蛋白和平滑肌纤维,而AS 组小鼠的AS 斑块包含薄薄的纤维帽层和少量基质纤维(P<0.001);与AS 组相比,AS+FRA-L 组和AS+FRA-H 组小鼠主动脉壁表现出更多的胶原蛋白纤维(均P<0.05),且AS+FRA-H组小鼠的主动脉中胶原纤维更为丰富。
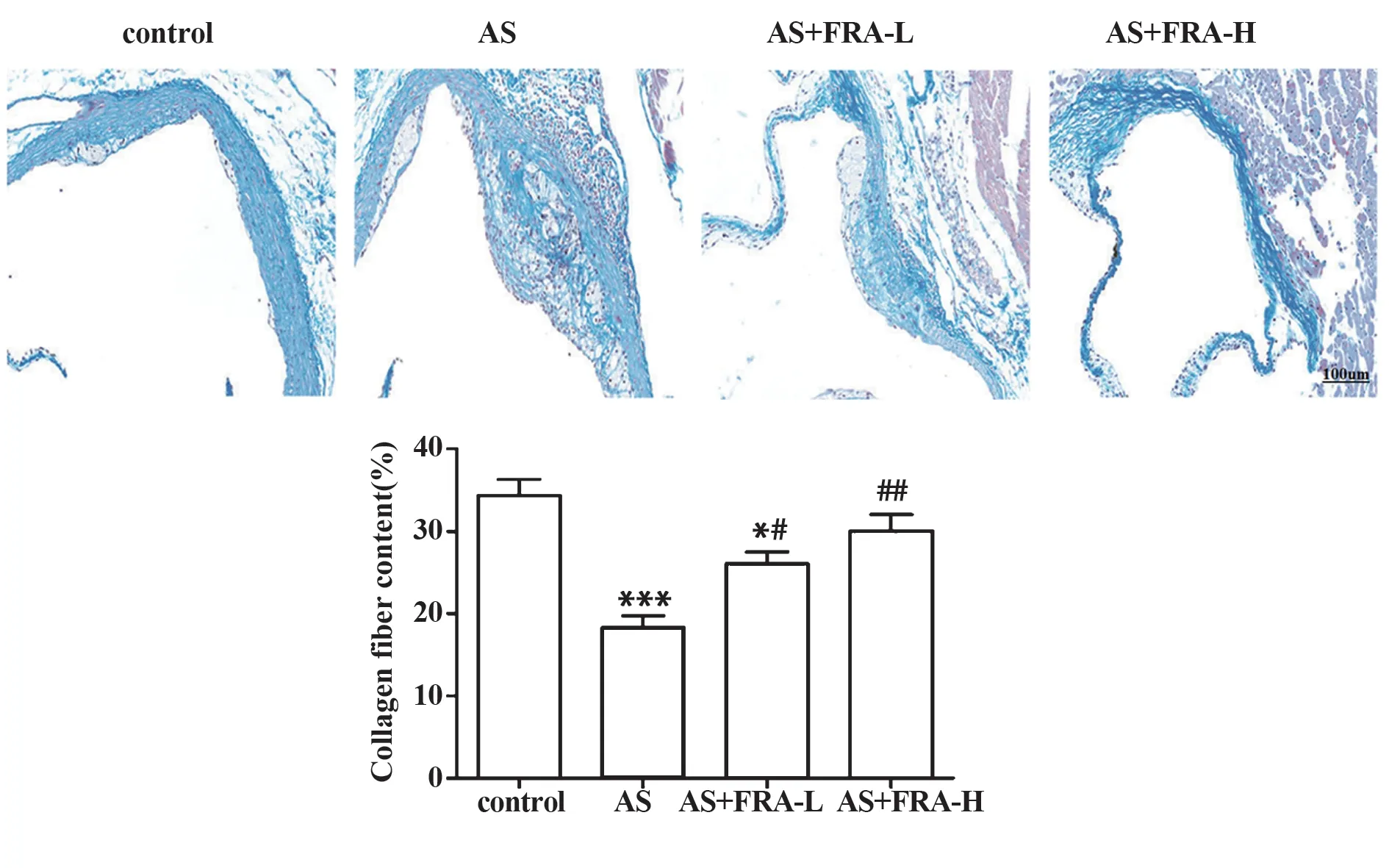
图5 Masson 染色检测小鼠主动脉中胶原蛋白含量变化(×200)Fig.5 Changes of collagen content in mice aorta detected by Masson staining(×200)
2.6 各组小鼠AS斑块中巨噬细胞MOMA-2的表达变化 如图6 所示,对照组小鼠中可见极少的巨噬细胞MOMA-2 表达,而AS 组小鼠的AS 斑块中出现大量巨噬细胞MOMA-2 表达(P<0.001);与AS 组相比,AS+FRA-L组和AS+FRA-H组小鼠AS斑块中巨噬细胞MOMA-2 表达减少(均P<0.05),且AS+FRA-H组小鼠AS斑块中巨噬细胞MOMA-2表达更少。
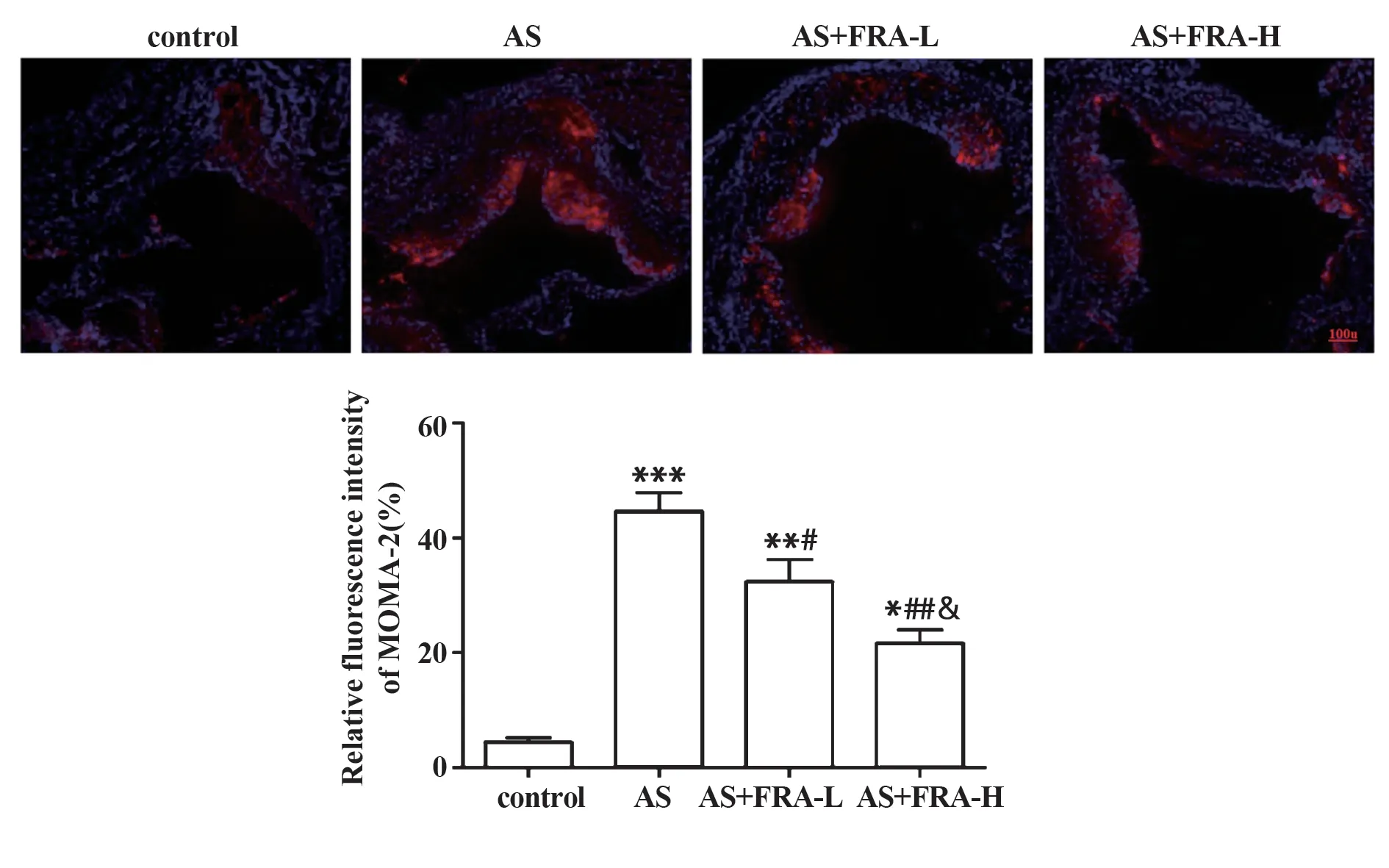
图6 免疫荧光检测各组小鼠巨噬细胞MOMA-2 的表达情况(×200)Fig.6 Expression of MOMA-2 in macrophages of mice in each group was detected by immunofluorescence(×200)
2.7 各组小鼠主动脉中CD40、MMP-9、VCAM-1 蛋白表达情况 如图7 所示,对照组小鼠主动脉中CD40、MMP-9、VCAM-1 蛋白表达甚少,AS 组小鼠主动脉中CD40、MMP-9、VCAM-1 蛋白表达上调(P<0.001);与AS 组相比,AS+FRA-L 组和AS+FRA-H组小鼠主动脉中CD40、MMP-9、VCAM-1 蛋白表达下调(P<0.05),其中AS+FRA-H组减少最为明显。
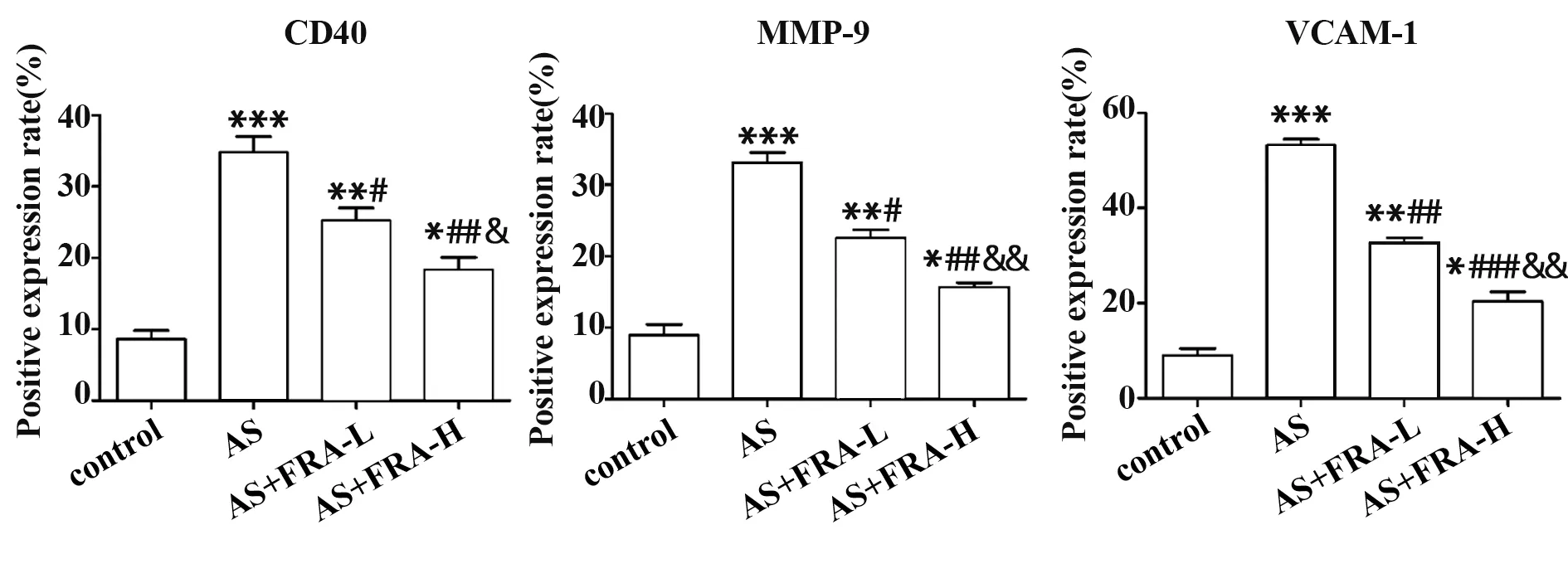
图7 免疫组化检测各组小鼠主动脉中CD40、MMP-9、VCAM-1蛋白表达情况Fig.7 Immunohistochemistry was used to detect expres⁃sions of CD40,MMP-9 and VCAM-1 in aorta of mice in each group
2.8 各组小鼠主动脉中CD40、MMP-9、VCAM-1 mRNA表达情况 如图8所示,与对照组相比,AS组小鼠主动脉中CD40、MMP-9、VCAM-1 mRNA 的表达显著上调(P<0.001);与AS 组相比,AS+FRA-L 组和AS+FRA-H 组小鼠主动脉中CD40、MMP-9、VCAM-1 mRNA表达下调(P<0.05),其中AS+FRA-H组下调最为明显。
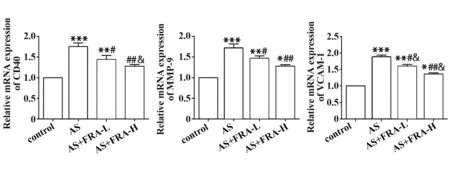
图8 qRT-PCR 检测各组小鼠主动脉中CD40、MMP-9、VCAM-1表达情况Fig.8 Expressions of CD40,MMP-9 and VCAM-1 in aorta of mice in each group was detected by qRT-PCR
3 讨论
AS是心血管和脑血管病的潜在病理基础,炎症和脂质代谢在其发生和发展中发挥重要作用[6]。AS的病理过程进展缓慢,主要在冠脉管腔严重狭窄和急性血栓形成严重阻断血流时表现出临床症状,阻断流向心脏的血流将发生冠状动脉性心脏病,阻断流向脑部的血流将导致缺血性脑卒中,肢体末端的血流量减少会导致外周血管疾病。AS 在老年人中很普遍,且其发病率随着年龄的增长而增加。AS的实质是内皮功能紊乱后血管免疫稳态失衡,其中LDL-C过高、HDL-C 过低及炎症反应对AS 的影响最为引人关注[7-10]。
在AS形成初期,主动脉内膜下的巨噬细胞和血管平滑肌细胞大量吞噬低密度脂蛋白,细胞内胆固醇沉积,从而形成泡沫细胞。本研究发现,AS 组小鼠血清中TC、TG、LDL-C含量显著升高,HDL-C 含量显著降低,其主动脉根部显示出明显的AS 斑块形成,且主动脉上具有大量红色脂质沉积,主动脉壁的胶原蛋白和平滑肌纤维明显减少;秦皮素能降低AS 小鼠血清中TC、TG、LDL-C 的表达水平,提高HDL-C 表达水平,减少主动脉根部AS 斑块形成,且主动脉上红色脂质沉积减少,主动脉壁上的胶原蛋增加。因此,秦皮素可能对血脂水平有调节作用,减轻斑块形成和脂质沉积,从而减轻AS的形成。
AS的特征是脂质在动脉血管墙内沉积,引起各种免疫细胞、血管固有细胞(如:巨噬细胞、T 淋巴细胞)、内皮细胞和血管平滑肌细胞的活化、迁移和增殖,产生一系列免疫炎症反应,释放大量的炎症细胞因子[11]。CD40 与其配体(CD40L)分别属于TNF和TNF 超家族成员,是一对互补跨膜糖蛋白[12]。CD40/CD40L 是免疫系统细胞间信息传递的主要介质[13]。研究表明CD40 信号系统参与了氧化修饰oxLDL引起的免疫应答过程[14]。oxLDL 可促进CD40/CD40L 的激活与表达,可诱导巨噬细胞、内皮细胞、血管平滑肌细胞等表达产生黏附分子如VCAM-1、细胞间黏附分子-1(intercellular adhesion molecule-1,ICAM-1)等,诱使免疫成分细胞黏附到血管壁[15-16]。CD40/CD40L 信号系统还可促进巨噬细胞、血管内皮细胞、T 细胞表达和释放炎症细胞因子(TNF-α、IL-β、IL-6 等)及单核细胞炎蛋白-1(monocyte chemotactic protein 1,MCP-1)等,吸引和支配T 细胞、巨噬细胞到AS 斑块内,维持慢性炎症反应,从而促进AS 斑块的发展[17]。CD40/CD40L 相互作用还可诱导巨噬细胞、内皮细胞、血管平滑肌细胞表达和释放MMP 和组织因子,促进斑块不稳定、破裂及局部血栓形成[18]。本实验发现,AS 组小鼠血清中oxLDL、TNF-α、IL-1β和IL-6的含量显著升高,且AS 斑块中巨噬细胞MOMA-2 的表达明显上调,CD40、MMP-9、VCAM-1 蛋白和mRNA 表达也上调;秦皮素能降低oxLDL 及炎症因子表达,使AS 斑块中巨噬细胞MOMA-2 的表达下调,CD40、MMP-9、VCAM-1 蛋白和mRNA 表达也下调。因此,秦皮素可能对炎症反应、免疫反应具有调节作用,对AS 有抵抗作用。
综上所述,本实验结果表明秦皮素可有效改善AS,其可能与调控脂质物质的释放,抑制炎症反应,调节免疫反应有关,为中药现代化研究起促进作用,为AS的治疗提供新的方案。

