脊髓损伤患者运动想象期间的近红外脑功能成像研究
邹 颖,张长杰,孔 瑛
1.中南大学湘雅二医院康复科,长沙 410011;2.岳阳职业技术学院,湖南 岳阳 414000
脊髓损伤(spinal cord injury,SCI)是由于不同病因引起脊髓结构和功能的损害,造成脊髓损伤水平以下的运动、感觉、括约肌及植物神经功能障碍[1]。因其严重影响患者的工作和生活,SCI后如何促进患者运动功能恢复成为当前最重要的课题之一。
运动想象(motor imagery,MI)是大脑的一种主动认知活动,是指受试者在意识上执行特定运动而不产生实际的运动输出[2]。目前常见MI有两种:第一种是视觉运动想象(visual motion imagery,VMI),要求被试者从第三人称角度在脑海中清晰地看到自己或他人做特定运动过程的画面;第二种是动觉运动想象(kinesthetic motion imagery,KMI),要求被试者从第一人称视角进行想象(即被试在心理排演运动过程并体验运动的感觉但不发生实际运动)[3]。MI疗法作为康复治疗手段,具有安全、有效、低成本和可反复使用性,已广泛应用于正常人的体育[4]、音乐[5]等领域中。近来,MI被应用于改善脑卒中[6]、帕金森[7]和SCI后的运动康复[8-10]中,但MI疗法的治疗机制至今缺乏明确结论,仍存在广泛争议。
运动执行(motor execution,ME)是指用实际动作执行运动过程,伴随可见的运动输出。良好的ME是肢体运动功能障碍患者的康复目标,MI作为康复治疗技术,其疗效通常采用行为学/临床量表进行评定[8-9]。其弊端为具有一定主观性,而神经影像学技术则可通过MI和ME脑区激活对比,从客观角度对MI疗效进行评价,同时还可从脑功能角度对MI疗法的机制提供理论依据。
近红外脑功能成像(functional near-infraed spectroscopy,fNIRS)是一种新兴的影像学技术,是基于光学手段检测的血红蛋白变化引起光谱吸收的变化,基于神经-血管耦合机制,脑功能活动的变化会引起局部脑血流的变化,神经元活动的增加伴随脑氧代谢的增加,在大脑皮层血管中的氧合血红蛋白(oxyhemoglobin,HbO2)和脱氧血红蛋白(deoxymyoglobin,HbR)对近红外光波段的光波产生不同程度的吸收,造成近红外光衰减,根据光衰减量与组织中发色团浓度变化的相关性,fNIRS可以定量分析脑组织中HbO2和HbR的浓度变化。fNIRS对比功能性磁共振与脑电图功能成像具有时空分辨率高、抗干扰性强、人群适用广泛、应用场景无限制、可移动性好等技术优势,因此fNIRS 被越来越广泛地应用于神经康复、精神疾病等临床领域[11]。
既往研究发现SCI后大脑也会发生结构和功能上的改变[10],SCI恢复缺乏明确机制可能是由于以往大多数研究集中在脊髓损伤的局部病变,而忽略了潜在的脑改变。本课题拟通过fNIRS技术对SCI患者在MI任务态下的大脑皮层结构和功能的改变进行研究,为探讨合理的康复治疗手段提供理论依据。
资料与方法
1一般资料
前瞻性研究2021年6月—2021年8月中南大学湘雅二医院康复科收治的21例SCI患者及同期面向社会公开招募的23名健康志愿者,将受试者分成SCI组与健康组。

SCI组患者男性14例,女性7例;年龄29~63岁,平均47.4岁;平均病程为(6.1±5.7)个月。根据《脊髓损伤神经学分类国际标准》[12],A级3例,B级7例,C级5例,D级6例,均为椎体骨折。健康组男性14名,女性9名;年龄20~64岁,平均41.4岁。本研究方案经中南大学湘雅二医院医学伦理委员会批准(LYG2021062),受试者在试验前均签署知情同意书。
2试验方法
2.1任务态模式 采用区块设计:任务期20s,静息期30s,任务期与静息期重复交替5次,考虑到受试者需要适应检测环境以及保证fNIRS信号达到稳态,区块前加入10s基线静息数据,共采集260s数据。
2.2任务设置 受试者戴好fNIRS配套的光学探查头帽,取仰卧位,双上肢静置于身体两侧,双下肢伸直,待熟悉环境后开始试验。ME:健康受试者注意听取指令并根据指令的节奏进行右膝关节反复屈伸动作(脚底贴床面,屈膝60°,伸膝180°),频率约为0.25Hz,活动20s后,休息30s,重复5次。运动过程由研究者全程监控。MI:所有受试者根据电脑指令进行右膝关节屈伸的MI,频率、幅度和模式与ME相同。本试验采用KMI而非VMI,研究表明KMI与ME激活脑区更为相似[10]。
2.3近红外数据记录 使用fNIRS系统(NirSmartⅡ-3000B,丹阳慧创医疗设备有限公司),采用连续波激光二极管记录皮层活动。本研究中,28个NIRS探头(14个光源和14个探测器)组成35个有效观测通道(图1),使用支架固定fNIRS灯,并将光源与检测器的距离设置为3cm。定义每个通道的中心为该通道探测的主要脑区,并以此点为原点进行每个通道的脑区定位。根据大脑区域和Brodmann区域(BA)分为12个感兴趣区域(region of intrest,ROI):左运动区(L-MA,对应通道34/35),右运动区(R-MA,对应通道18/31),左感觉区(L-SA,对应通道28/29/32/33),右感觉区(R-SA,对应通道1/15/17/30),左缘上回(L-SMG,对应通道13/14),右缘上回(R-SMG,对应通道2/16),左背外侧前额叶(L-DLPFC,对应通道24/26),右背外侧前额叶(R-DLPFC,对应通道21/23),左布洛卡区(L-Broca,对应通道11/12/25/27),右布洛卡区(R-Broca,对应通道3/4/19/20),左侧额极(L-FP,对应通道8/9/10),右侧额极(R-FP,对应通道5/6/7)。

图1 通道排布:紫色S表示发射器,蓝色D表示探测器,灰色CH表示通道。a.上方视角的通道排布情况;b.前方视角的通道排布情况
3统计学分析

结 果
1一般资料比较
两组受试者一般资料比较见表1。两组受试者在年龄、受教育程度、性别经统计学检验后P值均>0.05,表明两组被试一般资料差异无统计学意义,具有可比性。

表1 两组受试者一般资料比较
2SCI组MI与健康组MI、ME时共同激活脑区
采用NirSpark软件,对三组△[HbO]值分别行单样本t检验,结果示:健康组ME任务时,激活通道见图2a;健康组MI任务时,激活通道见图2b;SCI组MI时,激活通道见图2c。
3SCI组MI与健康组MI任务时激活通道及对应脑区差异
采用NirSpark软件,对两组△[HbO]值行双样本t检验,结果示:对比健康组MI,SCI组MI时3通道(t=2.211,P=0.032)、21通道(t=2.285,P=0.027)及30通道(t=2.147,P=0.037)有更多的激活,以上均未经FDR校正,见图3。再采用SPSS软件对两组受试者MI任务时ROI的HbOβ值进行对比分析,结果示:与健康组MI相比,SCI组MI期间右感觉区,左缘上回,左、右背外侧前额叶,左、右布洛卡三角区,左、右额极有更多的激活,其中显著性激活增多的是右感觉区(t=1.843,P=0.009)与左背外侧前额叶(t=1.517,P=0.034),见表2、图4。

图2 SCI组MI、健康组MI与ME期间脑区激活模式:采用NirSpark软件行单样本t检验,P<0.05,经FDR校正,采纳为显著激活通道。a.显示健康组ME任务期间,2、3、4、5、7、9、11、12、19、20、25、27、32、33和34通道被激活;b.显示健康组MI任务期间2、16、27、32、33和35通道被激活;c.显示SCI组MI任务期间9、13、17、25、27、29和35通道被激活。根据通道配准信息,健康组与SCI组MI任务时激活的运动区为前运动皮层,健康组ME期间运动区仅有初级运动皮层激活;SCI组MI期间,健康组ME及MI期间有相似激活脑区,左感觉区、左运动区、缘上回和左布洛卡三角区被共同激活。矩阵表示t值,ME表示运动执行,MI表示运动想象
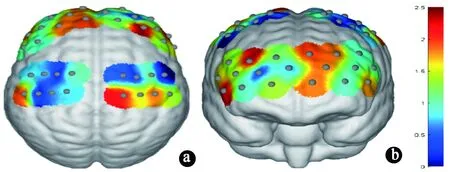
图3 SCI组与健康组MI任务期间脑区激活差异:采用NirSpark软件行独立样本t检验,P<0.05,未经FDR校正,采纳为激活差异通道。a.上方视角的两组MI任务期间通道激活差异;b.前方视角的两组MI任务期间通道激活差异。a、b(结合NirSprak系统计算)显示:相较于健康组MI,SCI组MI任务期间3、21、30通道激活显著性增多。矩阵表示t值,MI表示运动想象

表2 MI任务时两组各脑区HbO的β值对比

*表示P在0.01~0.05,**表示P<0.01;MI:运动想象;L/R:左/右;MA:运动区;SA:感觉区;SMG:缘上回;DLPFC:背外侧前额叶;BROCA:布洛卡区;FP:额极
讨 论
本研究中,SCI组MI、健康组ME及MI任务期间有相同激活脑区,左感觉区、左运动区、缘上回和左布洛卡三角区被共同激活。大量临床研究表明MI疗法可改善SCI后患者的运动功能[8-9],但多以运动相关参数评定为依据,本研究结果为SCI患者MI运动疗法机制提供了神经影像学理论依据。
健康组与SCI组MI期间前运动皮层(premotor cortex,PMC)及辅助运动区(supplemental motor area,SMA)激活,虽有研究显示初级运动皮层(primary motor cortex,M1)参与到MI中[13],但实际MI任务中运动区仍以PMC及SMA激活为主[14],这种激活模式可能与MI期间PMC参与运动计划[15],并且运动启动前PMC/SMA抑制M1的兴奋性有关[16];健康组ME时运动区仅M1激活,则与M1参与运动执行相关[17],但Economo等[18]和Li等[19]团队在老鼠延迟反应任务中发现:背侧前运动皮层(被视为灵长类动物的PMC的同源物),含两种神经元,一种投射至丘脑优先参与运动计划,一种投射至脑干和脊髓的运动前中心在运动执行中发挥作用,说明除了M1,PMC也参与运动执行。但本研究中健康组ME期间仅有M1激活却无PMC的激活,可能原因是:运动启动时PMC兴奋性通过皮质皮质通路[20]或皮质丘脑通路[21]促进M1激活增加[20],但运动启动后随着M1激活增多可能会反向抑制PMC/SMA的兴奋性。这可以解释本试验的结果,但证据薄弱,需做正常成人ME期间的PMC/SMA与M1的脑网络连接分析来进一步验证。
与健康组MI比较,SCI组MI时右感觉区有更多的激活,这可能与感觉皮层参与运动学习有关,Ohashi等[22]及Kumar等[23]研究显示人类运动学习过程中,体感皮层兴奋性的变化先于运动皮层,参与到人类巩固运动记忆中[24],知觉学习会导致额叶运动区域发生变化[25],有助于运动学习。结合本研究结果提示:(1)SCI患者或由于肢体运动功能缺失,代偿性需要启动更多的感觉皮层来促进运动学习;(2)MI疗法可能通过增加SCI患者感觉皮层激活,从而增强患者运动学习能力。
SCI组L-DLPFC激活增多则可能与内隐序列学习能力代偿性增多有关。最新研究表明,对健康受试者L-DLPFC行阳极经颅直流电刺激(transcranial direct current stimulation,tDCS),结果示内隐运动学习任务的反应时间明显增快[26],DLPFC的theta爆发刺激可以改变纹状体和海马体中与运动序列学习相关的网络功能连接[27],以上表明DLPFC是负责序列学习的神经元底物的一部分。对于SCI患者而言,L-DLPFC的刺激疗法更多应用于SCI后的神经性疼痛[28]。最新一项Meta分析[29]报道称,L-DLPFC高频经颅磁刺激减少了神经性疼痛,并且观察到刺激后长达3个月的后续镇痛效果,与L-DLPFC参与调节大脑垂体后叶的催产素分泌水平,从而缓解疼痛有关[30]。由此可见,SCI组L-DLPFC的激活增多除与隐性运动序列学习有关外,或与代偿性抑制神经性疼痛也产生关联;而R-DLPFC激活增多则可能因患者生活自理能力下降导致情绪低落引起。研究表明重度抑郁常出现R-DLPFC的过度激活[31],通过激活L-DLPFC,抑制R-DLPFC,可以达到缓解抑郁的作用[32]。
本研究局限性在于样本量有限,后续可增加样本量,分析获得更为客观的结论对本研究结果予以补充和修正;且本研究为横断面研究,缺乏行为学/临床量表对MI疗效的评估,后续可采用相对长时多频次MI疗法,对行为学参数评分与相关脑区激活强度行线性相关分析,进一步挖掘MI疗法的机制。
综上可见,DLPFC是一个功能和结构上的异质性区域,涉及认知、情感和感觉加工,DLPFC的应用治疗似乎可以同时改善SCI患者运动序列学习、抑郁及缓解神经性疼痛,可为SCI后的康复治疗提供一个新的研究和治疗方向。同时本研究从皮层激活角度证实MI疗法可改善SCI患者肢体运动功能:(1)SCI组MI期间脑区激活模式与健康组ME期间相似;(2)SCI患者或通过MI疗法激活更多的感觉皮层与左背外侧前额叶来增强运动学习和隐性序列学习能力。
作者贡献声明:邹颖:文章撰写、临床试验、收集数据及分析;张长杰:指导研究、数据分析;孔瑛:文献解读、试验讨论、验证数据

