多发伤后急性肾损伤导致慢性肾功能不全的临床分析
李 楠,刘思秀,赵 敏,王恒进,蒋春明
南京大学医学院附属鼓楼医院肾内科,南京 210002
随着我国社会经济和医学的迅速发展,多发伤患者的病死率逐年下降,治愈率稳步提升,然而此类患者的长期预后情况、生活质量、相关并发症、靶器官损害情况却没有得到足够的关注[1-3]。急性肾损伤(acute kidney injury,AKI) 是指各种病因导致的急性肾功能损害,并且导致水电解质代谢紊乱等一系列临床变化,是多发伤后的常见并发症之一,部分患者可能发展为慢性肾功能不全,甚至需要长期透析治疗[1,4-5],因此有必要了解多发伤后AKI向慢性肾功能不全发展的驱动因素、变化规律、预测指标,以期待更好地解决临床问题。本文通过前瞻性研究笔者医院2014年3月—2017年10月收治的多发伤后AKI患者临床资料,分析其肾功能变化规律,探讨慢性肾功能不全的独立危险因素,旨在为临床提供参考。
资料与方法
1一般资料
纳入标准:(1)明确创伤史;(2)年龄18~70岁;(3)受伤24h内来院就诊;(4)合并AKI;(5)创伤前1年内有肾功能检测指标。排除标准:(1)既往合并泌尿系统疾病、肾功能异常或使用肾毒性药物;(2)生命体征不稳,创伤后1周内死亡;(3)既往存在严重呼吸、循环、消化系统疾病。
AKI的诊断标准:48h内血肌酐上升>26.5mol/L或较前升高50%,尿量减少0.5mL/(kg·h)。慢性肾功能不全的诊断标准: 创伤4年后患者的肾小球滤过率(estimated glomerular filtration rate,eGFR)与受伤前相比下降25%。
2研究方法
收集患者的临床资料,包括年龄、性别、致伤原因、肌酐、尿素氮、胱抑素C (cystatin C,CysC)、白介素-6(interleukin 6,IL-6)、中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinase-associated lipocalin,NGAL)、尿白蛋白肌酐比(albumin creatinine ratio,ACR)等。根据患者受伤4年后eGFR下降25%为界限分为正常组和慢性肾功能不全组(图1)。比较两组之间的差异,探讨受伤3个月后的检测指标对于预测4年后肾功能的作用。本研究获得笔者医院医学伦理委员会批准(20211207615),患者均已签署知情同意书。
3统计学分析
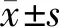
结 果
本组共收治多发伤合并AKI患者103例,其中男性68例,女性35例;年龄22~69岁,平均39.9岁。致伤原因:道路交通伤55例,高处坠落伤30例,砸伤12例,其他6例。根据患者4年后eGFR下降25%分为慢性肾功能不全组(32例)和正常组(71例),见图1。根据ROC曲线,计算CysC预测慢性肾损伤的最佳临界点为0.74mg/L, 其敏感度为81%,特异度为62%,曲线下面积为0.773(图2)。单因素分析显示糖尿病患者在AKI后更容易发展为慢性肾功能不全(P=0.015);慢性肾功能不全患者的IL-6和CysC显著升高(表1)。多因素分析提示CysC与AKI损伤后慢性肾功能不全密切相关(表2)。
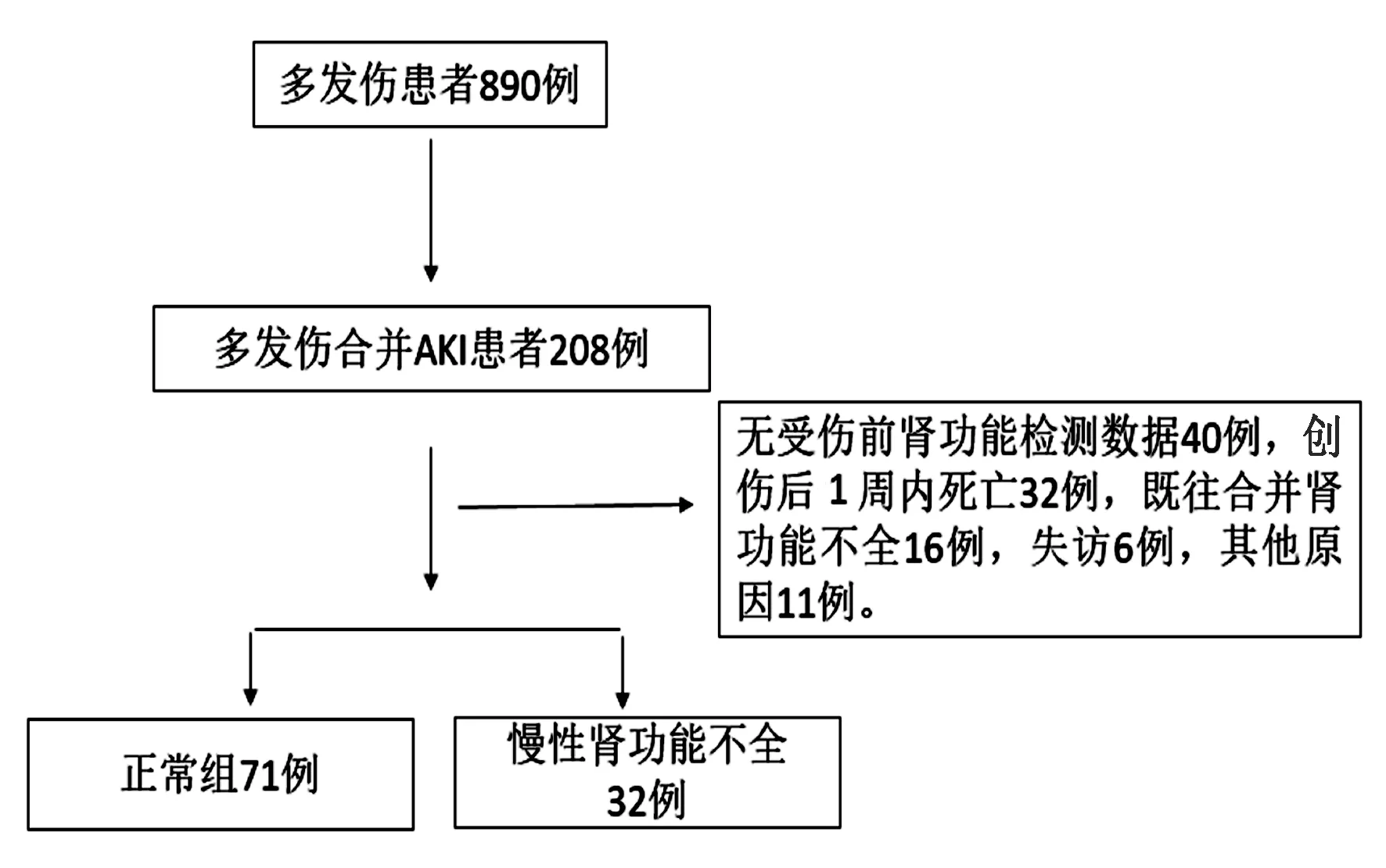
图1 纳入患者流程图

图2 损伤后3个月的CysC对慢性肾损伤预测价值的ROC曲线
表1 患者预后影响因素的单因素分析结果
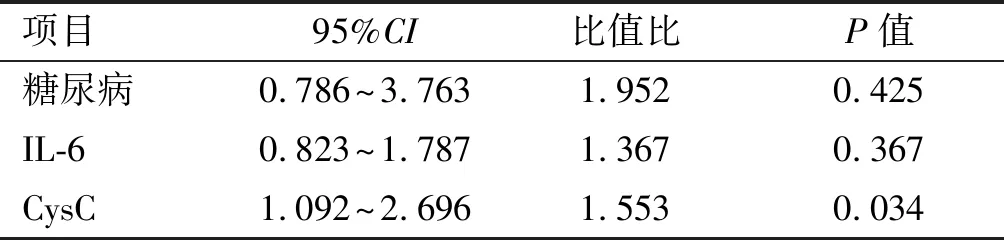
表2 患者预后不良影响因素的多因素Logistic回归分析
讨 论
多发伤后AKI进展为慢性肾功能不全是临床容易忽视的问题,且未见有全面、系统的研究[1]。造成这一现象主要有以下原因:(1)AKI早期治疗效果好,肌酐明显下降,患者生存率及生活质量短期内显著提高;(2)肾功能恢复后短时间内肾功能相对稳定,无明显诱因很少出现肾功能急剧恶化。但本研究发现多发伤后AKI进展为慢性肾功能不全的比例较高,约为31.1%。虽然在随访的4年中无患者发展为尿毒症,但是随访时间较短,多发伤患者恢复后一般生存期较长,需进行更长时间的随访。还有重要的问题是肾毒性药物的使用。临床上,很大一部分药物需要经过肾脏代谢,具有肾毒性,而且这些药物可能是常用药,或是某些疾病的特效药。因此,应意识到部分患者将会转变为慢性肾功能不全,早期预测指标的监测有利于更加针对性的管理,定期检测肾功能、维持健康的生活习惯、避免使用肾毒性药物。
目前国内外的研究主要集中在AKI的治疗与预防,对于多发伤后AKI进展为慢性肾功能不全的研究较少[6]。多发伤后导致AKI 的主要病理生理机制包括急性缺血、脓毒血症、炎症反应等[6-8]。AKI 向慢性肾功能不全转化的具体分子机制极其复杂,虽然对其病理生理变化的认识日益增加,但是其中的具体分子机制尚不明确,并且目前也没有特异性的预测指标[9]。笔者通过监测创伤3个月后患者血液指标,筛选出能够预测进展为慢性肾功能不全的生物标志物。结果显示进展为慢性肾功能不全的患者血液中IL-6明显升高。AKI进展为慢性肾功能不全的具体分子机制包括炎症反应导致的细胞死亡、细胞周期阻滞和微血管损伤[10-12]。AKI发生时,巨噬细胞、中性粒细胞、树突状细胞产生炎症因子,激活瀑布炎症反应因子,加剧炎症信号通路激活所致的肾脏组织炎性损伤[13]。炎症小体NLPR3(nod-like receptor family protein 3)被激活,引起Caspase-1的剪切和活化,后续导致相关细胞的程序性死亡。持续的慢性炎症反应是指机体在炎症因子、补体、免疫复合物及内毒素等的共同作用下引起的一种炎症反应状态,其特征性表现为全身循环中炎症性细胞因子升高[14]。持续的慢性炎症反应造成肾脏纤维化,基底膜细胞通透性改变,肾小球细胞凋亡,体内代谢紊乱加重,炎症、氧化应激增加,最终引起肾功能部分减退[13]。AKI时巨噬细胞浸润,以促炎表型为主,在修复阶段以非炎症表型为主。在这种情况下,巨噬细胞的Wnt信号通路的长时间激活会加重肾脏间质纤维化,导致不适当、过度地修复,破坏肾功能,加速慢性肾功能不全的进展。因此缓解患者体内的过度炎症反应、达到新的平衡可能是未来研究的方向。
近年来,国内外生物学家和临床医师开始寻找能够客观、准确地反映患者伤情变化并与其预后密切相关的影响因子。CysC在细胞中稳定表达,由122个氨基酸残基组成,可由机体有核细胞产生,产生率恒定,不能与血浆蛋白相结合,且不受年龄、性别、饮食、炎症等因素的影响[1,15]。研究表明肾脏是体内唯一能够清除CysC的脏器,CysC能够自由通过肾小球,其在近端肾小管被重吸收并完全降解,肾小管本身不能够分泌CysC,因此CysC是理想的测定eGFR的内源性标志物,其血中浓度由肾小球滤过率决定,而不依赖任何其他因素[16]。CysC与多发伤密切相关,准确反映创伤严重程度,并能预测恢复情况。AKI患者伴有CysC的升高,但随着病情的好转,CysC的含量逐渐减少,甚至恢复正常[15]。笔者的研究结果显示,创伤后3个月患者血清CysC仍然升高,提示随着时间的推移可能出现慢性肾功能不全,因此血清CysC可以作为监测多发伤后AKI向慢性肾功能不全发展的重要预测指标。在临床工作中应该定期检测血清CysC的表达,检测肾功能变化,警惕慢性肾功能不全的发生,做到早发现、早治疗,减少慢性肾功能不全的发生,改善患者的预后。
综上所述,笔者的研究结果提示炎症反应可能参与了多发伤后AKI向慢性肾功能不全的转化,以此为靶点的临床治疗有待进一步论证。eGFR和CysC能够准确反应肾脏的滤过功能,可以用于检测AKI患者的肾功能情况,对于慢性肾功能不全的发生也有一定的提示作用。
作者贡献声明:李楠、刘思秀:课题实施、撰写论文;赵敏:患者随访、统计工作;王恒进、蒋春明:课题总体设计

