亚甲基蓝在鲤体内消除规律研究
李涛 贾立平 李锋刚 王绿洲
(陕西省水产研究与技术推广总站,陕西西安 710086)
亚甲基蓝(methylene blue,MB)属于噻嗪类染料,在空气中较稳定,可溶于水、乙醇、氯仿,不溶于醚类[1]。它最重要的性质是氧化还原性,在好氧菌的作用下亚甲基蓝能氧化成无色亚甲基蓝。此外,亚甲基蓝有3种代谢物:亚甲基蓝的去二甲基代谢物[天青A(azure A,AZA)]、去一甲基代谢物[天青B(azure B,AZB)]和去三甲基代谢物[天青C(azure C,AZC)][2]。随着孔雀石绿、结晶紫等三苯甲烷类染料被禁止在水产养殖中使用,以及全国范围“三鱼两药”专项整治活动的开展,养殖过程和收储运环节中违法使用硝基呋喃类药物、孔雀石绿等禁用兽药及其他化合物的现象明显减少。与此同时,亚甲基蓝成为1种消毒剂替代品,在水产养殖过程中被用于治疗某些鱼病或作为消毒剂使用[3-4]。国外有研究表明,亚甲基蓝及其代谢物具有生殖毒性和“三致”作用[5-8]。目前美国食品监督管理局(food and drug administration,FDA)、欧盟96/23/EC指令和日本《肯定列表》都对亚甲基蓝在水产品中的残留量制定了检测标准[9-10]。尽管我国《水产养殖用药明白纸》中未将亚甲基蓝列为禁用药物,但若在水产养殖过程中违规使用,仍存在一定的安全风险。鉴于亚甲基蓝会对水生动物及人体存在潜在的危害[11-18],笔者以鲤(Cyprinuscarpio)为研究对象,探究亚甲基蓝及代谢物在水产动物体内的分布和消除规律,以期为加强该药物在水产行业的监管提供数据支持。
1 材料和方法
1.1 材料
1.1.1 实验动物及试验用水
试验在陕西省水产研究与技术推广总站西安草滩实验基地进行。试验用鲤购自陕西省合阳县基地,共100尾,体质量(500±50)g,体长(27.01±1.92)cm,健康无病。试验用水为无污染的地下水,水温(23±2)℃,pH为8.6,溶解氧为4.6 mg/L。暂养及试验期间24 h增氧,每天换水1次,暂养1周后进行试验。
1.1.2 试剂及仪器
试剂:亚甲基蓝、天青A和天青C纯度均大于95%,天青B纯度为94%(美国Sigma-Aldrich公司);乙腈、甲醇为色谱纯(德国Merck公司),二氯甲烷、甲酸为色谱纯,盐酸羟胺、对甲苯磺酸均为分析纯(国药化学试剂有限公司)。
仪器:Accela超高效液相色谱,TSQ Quantum Access Max三重四级杆质谱仪(美国Thermo Fisher公司);万分之一电子天平,高速冷冻离心机,漩涡振荡器,高速离心机,固相萃取装置,等。
1.2 试验方法
1.2.1 药浴
常温下,在暂养池用15 mg/L亚甲基蓝溶液对鲤进行药浴0.5 h,药浴后用清水冲洗干净,将鱼置于水族箱中,于给药后0.083 h,0.25 h,0.5 h,1 h,2 h,4 h,8 h,12 h,1 d,3 d,5 d,8 d,12 d,15 d,30 d,60 d各时长节点分别采集肌肉、肝脏、血液等组织的样品,每个时间点3个重复,样品置于-20 ℃冰箱中保存备用。
1.2.2 样品采集
血液样品采集:用干净纱布擦干鱼体,断尾取血于离心管(事先加入0.3 mL 10 g/L的肝素钠)内,混合均匀后冷冻离心(5 000 r/min,10 min),取上层血浆,-18 ℃保存待测。
肌肉及肝脏样品采集:取出整个肝脏,均质化后装入离心管;取肌肉,切成小方块,均质化后装入样品袋密封。肌肉及肝脏均置于-18 ℃保存待测。
1.2.3 样品检测
检测方法参考崔瑾等[19]《超高效液相色谱—电喷雾串联质谱法测定水产品中亚甲基蓝及代谢物》中的方法。采用超高效液相色谱—电喷雾串联质谱法同时检测水产品中亚甲基蓝及其代谢物。试样用10 mL乙腈提取3次,并在体系中添加盐酸羟胺、对甲苯磺酸等以提高提取效率。提取液经对丙磺酸固相萃取小柱净化,按V(乙腈)∶V(乙酸铵,1 mol/L)=1∶1洗脱,采用Thermo Hypersil C18色谱柱,以甲醇和0.2%甲酸为流动相进行梯度洗脱分离,电喷雾离子源(ESI)正离子模式,采用选择反应监测(SRM)扫描模式。
1.3 数据处理
药代动力学参数采用上海中医药大学开发的PK Solver药动学药效学数据处理软件进行分析。标准曲线和药-时曲线图采用EXCEL 2007进行计算和绘制。
2 结果
2.1 标准曲线、检出限、回收率和精密度
4种物质的标准溶液质量浓度在1~1 000 g/L范围内峰面积(Y)与浓度(X)呈良好的线性关系,相关系数均大于0.998。亚甲基蓝、天青A、天青B、天青C的线性方程分别为Y=2 886.046 746X,Y=552.048 819X,Y=955.517 930X,Y=269.901 437X;平均回收率分别为92.14%~105.65%,89.23%~101.50%,87.02%~103.67%,91.37%~106.54%。日内与日间变异系数均不大于10%,检测限为1.0 μg/kg(血液中为1.0 μg/L)。
2.2 亚甲基蓝及其代谢物在血液中的分布和消除规律
试验结果显示(见表1~表2),以15 mg/L的亚甲基蓝浸泡鲤0.5 h后,鲤血液中亚甲基蓝、天青B均有检出,天青C痕量检出,而天青A未检出。其中,亚甲基蓝和天青B均在0.083 h处达到最高值,峰浓度值Cmax分别为61.59 μg/L和4.97 μg/L,鲤血液中亚甲基蓝(MB)、天青B(AZB)、天青C(AZC)质量浓度随时长的变化曲线见图1。鲤血液中,亚甲基蓝5 min即达到峰值,然后缓慢下降,至24 h后低于检测限(1 μg/L);天青B同样于5 min时达到最高浓度,接着迅速下降,又缓慢上升,12 h时升至第2个峰值2.34 μg/L,同样在24 h后低于检测限。

表1 血液中亚甲基蓝、天青B、天青C的残留量(n=3) 单位:μg/L

表2 目标物质在鲤血液中的代谢动力学参数

图1 目标物质在鲤血液中的消除规律
2.3 亚甲基蓝及其代谢物在肝胰脏中的分布和消除规律
目标物质在鲤组织中的残留量及药动学参数见表3~表4。亚甲基蓝于1 h达到第1个峰值,Cmax为311.31 μg/kg,于12 h达到第2个峰值,Cmax为152.81 μg/kg,接着缓慢下降,直至30 d仍然有检出;肝脏中天青A、天青B和天青C的变化规律基本上呈现先迅速上升、再缓慢下降的趋势,直至低于检测限。这3种代谢物均于4 h时达到最高浓度,Cmax分别为30.09、129.94和38.36 μg/kg。这说明药浴后,亚甲基蓝在鲤肝脏中逐渐转化为天青A、天青B和天青C,其中天青B的占比最大,天青A和天青C基本相当。此外,3种物质在鲤肝胰脏组织中的残留时间均较长。亚甲基蓝在鲤肝脏中经过吸收分布消除后,直至30 d仍有检出(15.81 μg/kg),而天青A和天青C开始低于检测限的时长分别为24 h(1 d)和120 h(5 d),天青B在30 d仍然有少量检出(4.34 μg/kg)(见图2)。

表3 肝胰脏中亚甲基蓝、天青A、天青B、天青C的残留量 单位:μg/kg

表4 目标物质在鲤肝胰脏中的代谢动力学参数

图2 目标物质在鲤肝胰脏中的消除规律
2.4 亚甲基蓝及其代谢物在肌肉中的分布和消除规律
目标物质在鲤肌肉中的残留量和药动学参数见表5~表6、图3。结果显示,天青C仅在5 min时有检出外(1.14 μg/kg),其他时间点均未检出;而亚甲基蓝和天青B在肌肉中的变化规律与在血液和肝胰脏中的类似,均呈现先上升后下降的趋势,并且均于1 h时达到最高值,Cmax分别为99.02和13.89 μg/kg。可以推论,亚甲基蓝在鲤肌肉中一边吸收,一边代谢,迅速地转化成天青A和天青B。
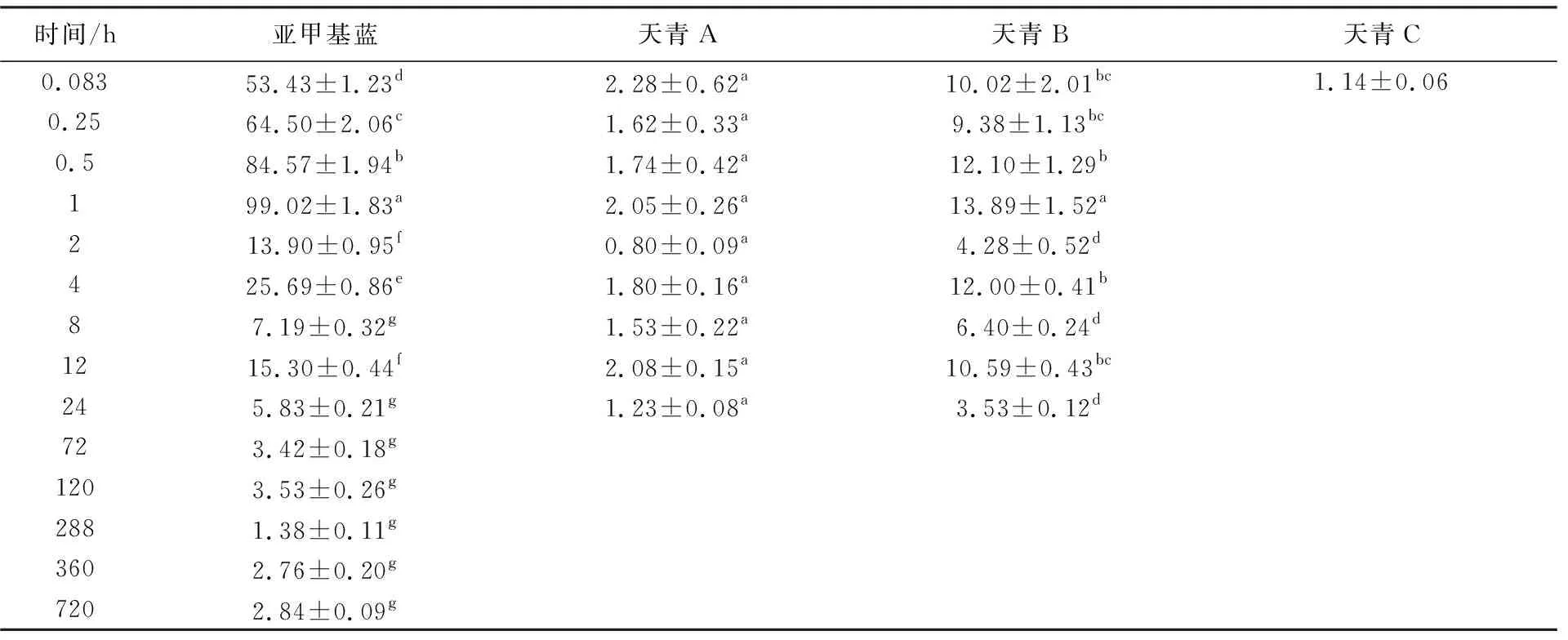
表5 肌肉中亚甲基蓝、天青A、天青B、天青C的残留含量 单位:μg/kg

表6 目标物质在鲤肌肉中代谢动力学参数

图3 目标物质在鲤肌肉中的消除规律
在药浴后的鲤肌肉中,亚甲基蓝于1 h达峰,2 h后迅速下降至13.90 μg/kg,之后缓慢波动,至12 h后开始缓慢下降,直至30 d还有少量检出(2.84 μg/kg);天青A于5 min达到第1个峰值,之后缓慢波动,于1 h达到第2个峰值(2.05 μg/kg),于12 h达到第3个峰值(2.08 μg/kg),然后缓慢下降,至24 h开始低于检测限;天青B于1 h达到最高峰值,之后缓慢波动,于4 h达到第2个峰值(12.00 μg/kg),于12 h达到第3个峰值(10.59 μg/kg),然后开始下降,72 h后开始低于检测限。
3 讨论
3.1 亚甲基蓝及其代谢物在鲤血液中的动力学规律
通常以达峰时间、峰浓度值和药-时曲线下面积来反映药物在机体内的吸收速度和程度[20]。本研究中,鲤在质量浓度为15 mg/L的亚甲基蓝溶液中浸泡30 min后,亚甲基蓝和天青B在血液中的浓度迅速(0.083 h)达到峰值,说明亚甲基蓝和天青B在血液中快速被吸收并代谢产生相应的代谢产物。天青B的达峰浓度为4.97 μg/L,而天青A和天青C几乎未检出。亚甲基蓝在生物体内的代谢会产生N-去甲基化分子,其中天青B是主要的代谢产物,天青A是次生代谢产物[21],故推测血液中的亚甲基蓝能迅速地代谢为去一甲基代谢物——天青B。同时,这也说明亚甲基蓝通过药浴的方式进入血液中,并且在血液中边富集,边吸收,边排泄,仅产生少量的去二甲基产物。这与对鲫、异育银鲫及日本鳗鲡的试验结果相一致[22-24]。结合Cmax和AUC值可以得知,亚甲基蓝和天青B在鲤体内吸收迅速,且吸收程度较高,这一结果与人和狗等部分哺乳动物是一致的[25]。
3.2 亚甲基蓝及其代谢物在鲤组织中的分布和消除规律
虽然在国家发布的禁用渔药清单上,亚甲基蓝没有被列为禁用渔药,但是亚甲基蓝及其代谢物结构中确实含有与孔雀石绿一样的高残留的三苯甲烷结构,一旦在水产品中残留并被人食用,同样会导致畸形的发生。目前,关于亚甲基蓝及其代谢物的研究仅限于其在水产品中残留的检测分析方法,而在大宗水产品组织中分布与消除规律的研究较少。本文研究了亚甲基蓝及其代谢物在鲤肝胰脏和肌肉组织中的分布与消除过程,结果表明,亚甲基蓝、天青A、天青B这3种噻嗪类染料在鲤肝胰脏中的浓度远高于在肌肉中的,且残留时间长,至第30天仍被检出。同一时间点,肝胰脏中亚甲基蓝及其代谢物的浓度均比肌肉中的要高,这可能是因为肝胰脏组织作为代谢组织,蓄积了较高浓度的亚甲基蓝及其代谢物,这与其他药物在鲤体内代谢的研究结果一致[26-31]。
3.3 亚甲基蓝药-时曲线多峰现象
本研究发现,目标物质在鲤体内吸收过程中出现不同程度的双峰或多峰现象。药物在鱼体内吸收的双峰现象并不少见,如喹乙醇在鲤体内的药动学研究也发现,药物的吸收存在双峰或多峰现象[32]。产生双峰或多峰现象的原因多样,除药物本身的脂溶性和药物剂型等因素外,肝循环(EHC)被认为是最可能产生吸收多峰的一种机制[33]。药物被鱼类摄取后,可能以代谢物或以原形进入胆汁,而后经胆总管进入肠道,经肠道细菌水解,其中一部分被肠重新吸收,另一部分则被消除。重吸收的药物借静脉血流再次入肝,如此形成肠-肝循环。如果重吸收的一部分药量足够大,导致血药浓度一次、再次地升高,便形成多峰。此外,不同肠段吸收的差异[34]、不规则的胃排空[35]、药物从体循环分泌到肠腔所导致的肠分泌以及药物制剂[36]均是导致出现双峰曲线的因素。
4 结论
虽然在国家发布的《水产养殖用药明白纸2020年1、2号》中未将亚甲基蓝列为禁用渔药,但是亚甲基蓝及其代谢物结构中也含有与孔雀石绿一样高残留的三苯甲烷结构,一旦残留在食品中被人们食用,有可能会导致畸形的发生。本研究结果表明,亚甲基蓝及其代谢物主要残留在鲤鱼的可食部分,且残留时间长,含量高。建议相关部门加强水产品中亚甲基蓝及其代谢物全链条上的监管力度。

