初探DNMT2基因在乳腺癌中的表达
谢济阳 张生辉 段雯芝 张妍蓉 李云龙 何娴婕
摘要:目的:探讨DNMT2基因在乳腺癌中的表达及序列分析。方法 采用雌性 SD作为种鼠传代肿瘤。通过Walker-256肿瘤细胞株在含10%小牛血清 1640培养液通过细胞培养技术传代培养扩增,细胞悬液约 1.5ml(细胞数约1.0x107 )种鼠腹腔内注射,约1周后可形成腹水瘤。测定乳腺癌组织及癌旁组织中DNMT2 mRNA 表达水平;通过免疫组化染色测定乳腺癌组织中DNMT2表达程度。结果 DNMT2 mRNA 在乳腺癌组织中的相对表达水平显著高于乳腺癌旁组织(P< 0.05)。乳腺癌组织中DNMT2表达程度及阳性表达率显著增加。结论 DNMT2在乳腺癌组织中有表达,与乳腺癌的发生发展有一定的相关性。
关键词:DNMT2;乳腺癌;中老年
女性全年龄段恶性肿瘤中乳腺癌发病率排在首位,且发病率呈逐渐升高和发病年龄逐渐年轻化的趋势[1]。目前研究结果表明在乳腺癌的发生发展过程中抑癌基因的高甲基化和癌基因的低甲基化起到非常重要的作用,并且这种异常的甲基化和机体内DNMTs表达水平的变化就是导致这种异常甲基化治病的机制之一[2]。甲基化在机体内的修饰是在DNMTs作用下形成mC的过程,所以理论上来讲甲基化应该与DNMT的活性有关。本文就是采用实时荧光定量PCR技术检测乳腺癌组织以及对应的乳腺癌旁组织中DNMT2 基因相对表达水平及与临床病理特征之间的关系。
1材料和方法
1.1實验动物
雌性 SD(Sprague-Dawley)小鼠 45只,体重 200±l0g。另 SD 小鼠 12只,体重 50~60g,雌雄不限,作为种鼠传代肿瘤。
1.2 实验方法
1.2.1 乳腺癌模型制作
Walker-256肿瘤细胞株在含 10%小牛血清 1640培养液通过细胞培养技术传代培养扩增,细胞悬液约 1.5ml(细胞数约1.0x107 )种鼠腹腔内注射,约 1周后可形成腹水瘤。无菌抽取腹水约 3ml,癌性腹水呈黄色浑浊样或淡红色洗肉水样。取少量稀释并计数 ,之后腹水 800r/min离心约 5min,弃上清,沉淀细胞用 PBS缓冲液稀释,调节悬液细胞浓度至 4X107/ml。实验组小鼠 10%水合氯醛腹腔麻醉,仰卧位,左侧腋窝皮肤消毒,皮下缓慢注射细胞悬液 0.8ml(细胞数约 3X107)。注射针退出后穿刺点针口消毒。待动物出瘤。
1.2.2 乳腺癌组织标本
瘤体形成后,处死小鼠,取下瘤体组织和瘤体周围组织,清洗掉表面血迹后立即放入室温保存的RNAlater溶液中,4℃过夜保存,然后-80℃保存。所有标本均经过病理证实。切片制备:切片脱蜡至水,在PBS中平衡10分钟,以蒸馏水新鲜配制的3%H202室温20分钟灭活内源性过氧化物酶。微波修复抗原:将切片浸入PH6.0、0.01M枸椽酸盐缓冲液,微波炉高火加热5分钟。缓慢冷却后,放在PBS中再平衡10分钟。备用。
1.2.3 实时荧光定量PCR
采Trizol试剂盒分别提取其总RNA,使用DNaseI试剂提纯;紫外分光光度仪测定A260/A280值;采用逆转录试剂盒获得cDNA,-80℃保存备用;引物合成DNMT2:5-TTGGAATAGGGGACCTCGTGTG-3,5-AGAGACCTCGGAGAACTTGCCATC-3,扩增产物152bp;反应条件为:94℃预变性5 min; 94℃变性30s,68℃退火30s,72℃延伸3 min, 30个循环;72℃延伸10 min,收集溶解曲线;以倍比稀释的cDNA作为模板,检测循环阈值(Ct)可采用2-Δt法计算其相对表达量。
1.2.4 免疫组化染色
石蜡切片脱腊,3%H2O2 室温孵30 min,然后 PBS 冲洗,滴加 10%正常山羊血清封闭液 37 ℃孵育 30 min; 加入一抗兔抗大鼠抗体 (1:100稀释)孵育,PBS 冲洗,滴加二抗山羊抗兔 IgG 孵育,PBS 冲洗, 滴加试剂辣根酶标记链霉卵白素工作液(S-A / HRP)孵育,PBS 冲洗,DAB 显色,苏木精复染,梯度乙醇脱水干燥,二甲苯透明,中性树胶封片。显微镜观察计数。
1.3 统计分析
采用 SPSS 16.0 统计学软件对实验结果数据进行统计分析。各实验均独立重复 3 次,结果数据用 表示。多组间比较应用单因素方差分析,组内两两比较采用 SNK-q 检验。以 P<0.05为差异有统计学意义。
2 结果
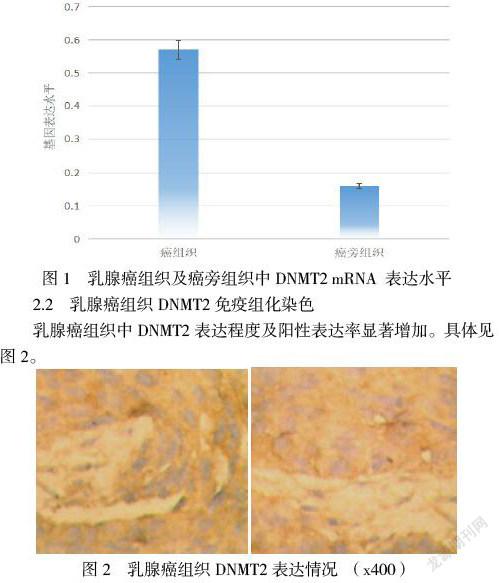
2.1 乳腺癌组织及癌旁组织中DNMT2 mRNA 表达水平比较
DNMT2 mRNA 在乳腺癌组织中的相对表达水平显著高于乳腺癌旁组织(P< 0.05)。具体见图1。
2.2 乳腺癌组织DNMT2免疫组化染色
乳腺癌组织中DNMT2表达程度及阳性表达率显著增加。具体见图2。
3 讨论
乳腺癌的发生机制主要包含有遗传学和表观遗传学两种,其中表观遗传学机制在乳腺癌的发生、发展过程中起着越来越重要的作用[3]。DNA启动子区域的异常甲基化研究的最为深入,主要过程为S-腺昔甲硫氨酸上的甲基在DNMT酶催化的作用下连接到胞嚓陡或腺嘌呤上面形成mC的一种可逆过程,DNMT活性或者功能表达水平的改变可能会诱导机体产生部分疾病甚至肿瘤的发生[4]。目前研究发现甲基化转移酶有DNMT 1,DNMT2,DNMT3a和DNMT3b等4种亚型,DNMTl、DNMT3a和DNMT3b等在胚胎形成及发育、诱导疾病中发挥重要的作用,但DNMT2的作用机制目前还不很清楚[5]。
乳腺癌占据乳腺癌的15%,是一种侵略性很强的癌症,这种类型的乳腺癌是由于缺乏特定的受体蛋白,结合存在的荷尔蒙雌激素和孕激素正常的乳腺细胞[6]。乳腺癌常出现TP53突变,而其他常见癌基因的点突变出现频率较低,因而其对靶向治疗效果不佳[7]。在“美国国家科学院院刊”上,研究人员发现,乳腺癌细胞极易受干扰素-β一种有效的抗微生物药物的影响,这种抗微生物药物也能激活免疫系统。这项新的研究显示干扰素-β损害乳腺癌细胞迁移和形成肿瘤的能力。该研究还表明干扰素-β治疗可以改善某些乳腺癌患者的治疗效果。之后研究人员使用乳腺癌组织数据库验证了他们的实验室结果[8]。
综上所述,DNMT2在乳腺癌組织中存表达,DNMT2基因的检测可能为了解乳腺的发病机制提供参考,且DNMT2的表达也可作为乳腺癌预后判断的依据。
参考文献:
[1]李贺, 左婷婷, 曾红梅,等. 不同年龄女性乳腺癌患者的临床特征及预后分析[J]. 中华肿瘤杂志, 2021, 43(01):126-131.
[2] Tang QQ,Holland-Letz T,Slynko A,et al. DNA methvlation array analysis identifies breast cancer associated RPTOR, MGRN1 and RAPSN hypomethylation in peripheral blood DNA [J].Oncotarget, 2016 , 7 (39):64191-64202.
[3]马彦凝. YY1转录因子对乳腺癌细胞自噬过程的表观遗传学调控作用及其机制研究[D]. 浙江大学, 2016.
[4]Medina一Franco JL,Caulfield T.Advances in the computational development of DNA methyltransferase inhibitors[J]. Drug Discov Today,2011,16(9/10): 418-425.
[5]郭为伟, 高静, 周磊,等. DNA甲基转移酶在胚胎停育绒毛组织中的表达差异及临床意义[J]. 国际妇产科学杂志, 2016(2):203-206.
[6]Jordan M. Reese et al. ERβ inhibits cyclin dependent kinases 1 and 7 in triple negati-ve breast cancer, Oncotarget (2017). DOI: 10.18632/oncotarget.21787.
[7]张丹峰, 杨宏伟, 王曼. DNMTs基因在乳腺癌组织中表达的检测[J]. 宁夏医科大学学报, 2019(4):384-387.
[8]苏畅, 贾英杰, 李小江,等. 香菇多糖联合AdIRF3通过刺激IFN-β表达抑制乳腺癌生长[J]. 中草药, 2019, 50(05):118-123.
项目基金编号:长沙医学院大学生创新创业计划训练项目:长医教[2021]47号-116
第一作者:谢济阳,(2000.6-),男,本科,临床医学专业
通讯作者:何娴婕(1983.12-),本科,讲师,研究方向:妇产科教学

