小檗碱磁性印迹聚合物的制备及其性能测试
王文静,房南南,郝彤彤,刘 蓉,张心怡,宋莹莹,张盼盼,王爱香
(临沂大学 化学化工学院,山东 临沂 276000)
近年来,由于合成药物的毒副作用使人们日益青睐天然药物和中药药材,但是中药活性成分结构复杂、类型多样,再加上含量低和不稳定性,导致了中药活性成分分离纯化困难[1]。目前分离纯化主要依赖于硅胶柱色谱、大孔吸附树脂柱色谱、凝胶柱色谱、制备型高效液相色谱等色谱技术[2]。为了得到纯度高的活性成分,需经多种溶剂萃取和反复柱色谱,不仅溶剂消耗量大、环境污染严重,而且效率和收率也低[3]。分子印迹聚合物具有结合能力和识别能力强、选择性可预定、性质稳定、对环境耐受性强、制备简单等优点[4]。近年来,分子印迹聚合物在分析化学中的应用越来越广泛,在色谱分离、固相萃取等方面展现出良好的应用前景[5-6]。而小檗碱具有广泛的抗菌作用和防癌作用,近几年来又发现了一些新的用途,如治疗原发性高血压、心律失常、高血脂症等,因此,进行小檗碱分子印迹聚合物的合成及其性能的研究具有非常重要的实际意义[7-8]。
1 实验部分
1.1 仪器与试剂
FA2004N电子分析天平,上海精密仪器科学有限公司;DF-101S集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司;TGL-16台式高速离心机,江苏省金坛市医疗仪器厂;KQ3200DV数控超声波清洗器,昆山市超声仪器有限公司;DZF-6051真空干燥箱,上海一恒科学仪器有限公司;HZQ-2数显全温振荡器,江苏省金坛市医疗器械厂;UV3600紫外-可见分光光度计,日本岛津;S3400N扫描电子显微镜,日本日立公司;JEM-2100透射电镜,日本电子株式会社。甲基丙烯酸、丙烯酰胺、N,N-亚甲基双丙烯酰胺,天津市科密欧化学试剂有限公司;过硫酸钾、乙酸、无水乙醇、无水甲醇,天津市鑫铂特有限公司;小檗碱,江苏利恒化工有限公司;药根碱,上海经科化学科技有限公司。本实验所用试剂均为分析纯。
1.2 实验方法
1.2.1小檗碱分子印迹聚合物的制备
将0.237 5 g小檗碱、0.24 mL甲基丙烯酸、0.200 9 g丙烯酰胺、60 mL水置于250 mL的四口瓶中,搅拌过夜,升温至30 ℃,搅拌下加入2.1783 g N,N-亚甲基双丙烯酰胺,使之溶解后降至室温。氮气保护下,加入0.256 1 g过硫酸钾引发剂,采用水浴加热,将溶液升温到80 ℃引发聚合,氮气保护下反应12 h,得到沉淀聚合物。将得到的聚合物甲醇/乙酸(体积比9∶1)混合液抽提72 h洗涤烘干后得到小檗碱分子印迹聚合物。空白聚合物的合成与印迹聚合物的合成步骤一样,只是不加入模板分子。
1.2.2小檗碱分子印迹聚合物吸附实验
吸附容量和吸附速度是表征吸附剂的基本数据,也是评价吸附剂吸附性能的重要数据。吸附容量是吸附剂对底物的最大吸附量,它反映了吸附剂对底物的吸附能力大小,是一个重要的热力学参数。吸附速度表征了达到吸附平衡的快慢,是一个重要的动力学参数。
1.2.2.1测定动力学吸附曲线
称取0.05 g小檗碱印迹聚合物置于250 mL锥形瓶中,加入25 mg/L的小檗碱模板分子溶液,置于振荡器上室温下振荡,振荡速度为250~260 r/min。每隔一段时间,取5~6 mL以12 000 r/min的速度离心约30 min,移取上层清液,用砂芯漏斗抽滤得到澄清液,用紫外可见分光光度计在345 nm处测定溶液的吸光度。通过式(1)可以计算出印迹聚合物的吸附量:
Q=(c0-ct)×V/m
(1)
式(1)中,Q为吸附量,mg/g;c0为模板分子初始浓度,mg/L;ct为不同时间的浓度,mg/L;V为溶液体积,mL;m为印迹聚合物的质量,g。绘制吸附量-时间曲线。
1.2.2.2测定热力学吸附曲线
精确称取9份0.05 g小檗碱印迹聚合物分别置于250 mL锥形瓶中,分别加入30 mL不同浓度的小檗碱溶液,在室温下振荡1 h,以12 000 r/min的速度离心分离,并用砂芯漏斗过滤取上清液,用紫外可见分光光度计在345 nm下测定上清液中小檗碱的浓度。以MIPs的相对平衡吸附量QR为纵坐标,以吸附相对平衡时的底物浓度cR为横坐标作图。
1.2.2.3竞争吸附测试
称取0.1 g小檗碱印迹聚合物两份,分别置于250 mL锥形瓶中,分别加入25 mg/L的小檗碱溶液和药根碱溶液,置于振荡器上,室温下振荡,振荡速率为250~260 r/min。每隔一段时间,取5~6 mL以12 000 r/min的速度离心约30 min,移取上层清液,用砂芯漏斗抽滤得到澄清液,用紫外可见分光光度计分别在其特征波长处测定溶液的吸光度。
2 结果与讨论
2.1 标准曲线
2.1.1小檗碱的标准曲线
用紫外可见分光光度法测定小檗碱溶液,在0~36 mg/L范围内,吸光度和小檗碱的浓度呈良好的线性关系。回归方程为A=0.065 3c+0.009,其中A代表吸光度,c代表溶液浓度(mg/L),相关系数为r=0.999 7。
2.1.2药根碱的标准曲线
用紫外可见分光光度法测定药根碱溶液,在0~35 mg/L范围内,吸光度和药根碱的浓度呈良好的线性关系。回归方程为A=0.058 8c-0.041 3,其中A代表吸光度,c代表溶液浓度(mg/L),相关系数为r=0.994 6。
2.2 吸附性能测试
2.2.1动力学吸附性能测试
图1为不同时间分子印迹聚合物小檗碱的吸附量。

图1 小檗碱吸附动力学曲线
通常MIPs对模板分子的吸附过程可分为三个阶段:首先模板分子运动到聚合物附近,其次是聚合物对其附近分子的物理吸附,最后MIPs通过其所携带的功能基团与其表面的模板分子结合。一般物理吸附的速度很快,可瞬间完成。而本实验中MIPs上的结合基团主要以非共价键的形式与模板分子小檗碱发生结合作用,这种结合的速度也相当快。所以本实验开始阶段的吸附速度很快,基本呈线性增加的,随着吸附时间的延长,吸附量不断增加,表面空腔(未被分子结合的分子腔)不断减少,MIPs对迁移到其附近的分子吸附与结合的数量也相应减少,所以吸附速度开始下降。到60 min以后,内部结合位点也已基本结合完全,吸附量的增加已不明显,此时可以认为吸附基本达到平衡。
2.2.2热力学吸附曲线
图2表示QR随cR的变化,MIPs的相对平衡吸附量随底物平衡浓度的增加而变大。
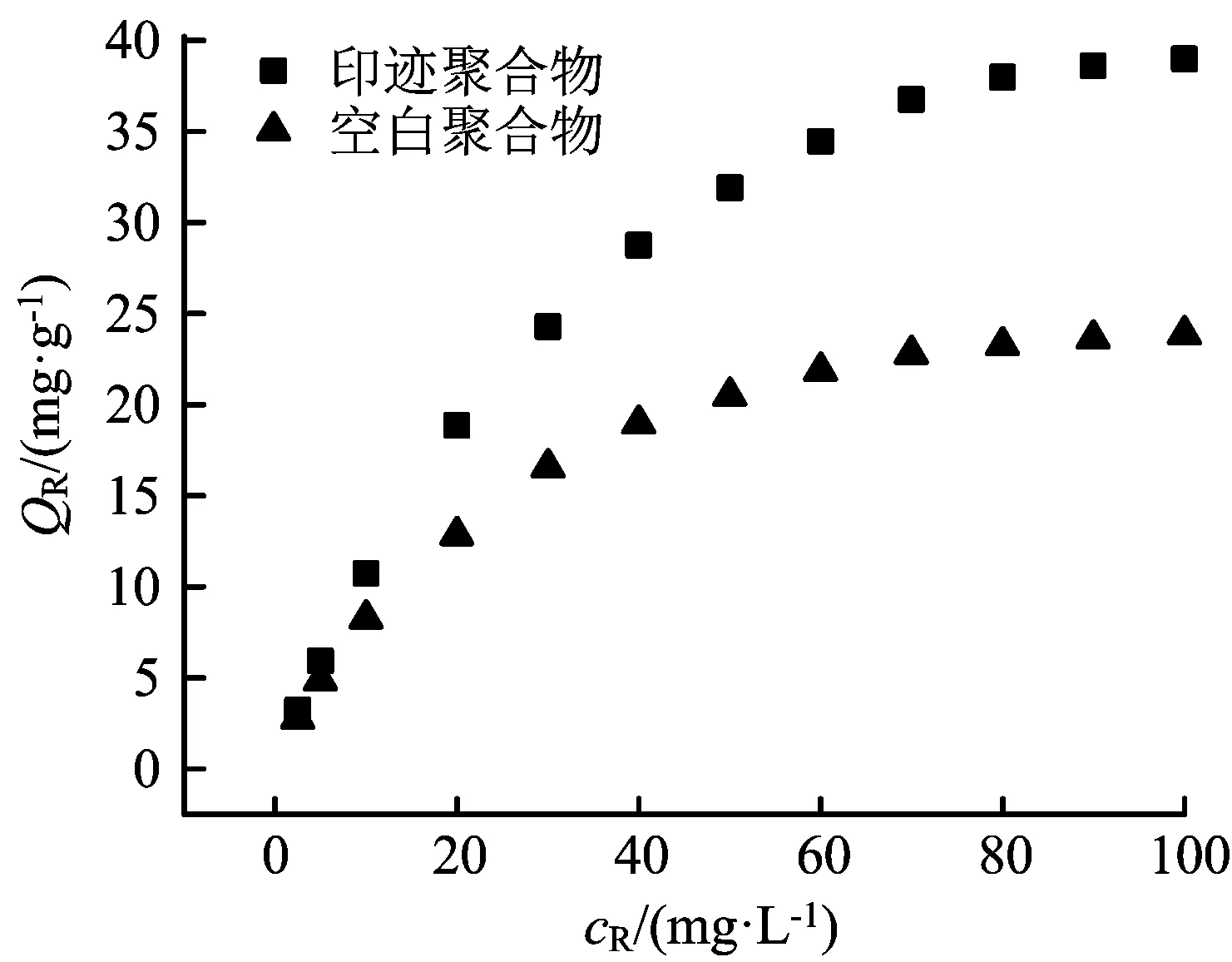
图2 小檗碱的热力学吸附曲线
2.2.3计算饱和吸附量Q0和吸附常数K
据Langmuir等温吸附方程:
cR/QR=cR/QR+1/(KQ0)
(2)
式(2)中Q0为MIPs的饱和吸附量,K为吸附常数。
以cR/QR为纵坐标,cR为横坐标作图,如图3所示。所研究的范围内cR/QR与cR有很好的线性关系,由斜率和截距求得印迹聚合物的K和Q0值分别为0.034 6 L/mg和52.43 mg/g,空白聚合物的K和Q0值分别为0.049 3 L/mg和29.33 mg/g。

图3 cR/QR与cR的关系曲线
2.2.4竞争吸附曲线
竞争吸附曲线见图4。

图4 竞争吸附曲线
由图4可知,在相同时间内,印迹聚合物对小檗碱的吸附量较大,说明制备的印迹聚合物对小檗碱的选择吸附性较好。
2.3 产品表征
小檗碱分子印迹聚合物的形貌图见图5。由图5可见,扫描电镜(SEM)照片表明,制备的小檗碱分子印迹聚合物表面疏松多孔,透射电镜(TEM)照片表明,其粒径约为250 nm。

图5 小檗碱分子印迹聚合物的形貌图
3 结论
以小檗碱为模板分子,以丙烯酰胺和甲基丙烯酸为混合功能单体,N,N-亚甲基双丙烯酰胺为交联剂,过硫酸钾为引发剂,利用沉淀聚合法制备了小檗碱分子印迹聚合物,分别做出其吸附动力学曲线和吸附热力学曲线,其饱和吸附时间为60 min,饱和吸附量为52.43 mg/g,吸附常数为0.034 6 L/mg。并用药根碱作为干扰分子对小檗碱印迹聚合物进行竞争吸附测试,结果表明,小檗碱印迹聚合物对小檗碱的选择吸附性较好。

