基于品质易逝期的模拟中转基地处置对凡纳滨对虾活品和锁鲜品贮藏稳定性的影响
曲秦坤,刘俊荣,赵前,周进,田元勇,徐昙烨
(大连海洋大学 食品科学与工程学院,辽宁 大连 116023)
凡纳滨对虾Litopenaeusvannamei俗称南美白对虾,是目前世界上三大养殖对虾中单产量最高的品种[1-2]。该对虾具有饲料需求量低、生长速度快、出肉率高、体质较好及长时间离水存活等特点,易于进行集约化养殖,较适合中国南方地区养殖[3]。据2020年中国渔业统计年鉴显示,2019年全国南美白对虾海水养殖产量达114万t,占全国虾类海水养殖总产量的79%左右[4]。由于虾养殖的地域性和气候性比较明显,不同品种虾所需环境条件有所差异,适合养殖的区域各不相同,如冬春季节,只有广东、海南、福建等南方省份才有适销鲜活对虾,因此,保活保鲜运输是对虾广泛供应和销售的基本保证[5-6]。
在产业高度集约化的养殖对虾产区,虾产品具有高度的工业化特征,且产品供应呈现全球化的特点,国际市场虾类产品主要为各类冻品形式流通[7]。常见处理方法包括整虾、去头及去皮3种,并分别冻结成整虾、虾尾和虾仁3种产品贴签冷冻销售[8]。
以辽宁大连地区池塘养殖凡纳滨对虾为例,中国北方大多产区养殖对虾产业集约化程度不高,产区呈小型分散状特点,产品主要在本地市场销售,在捕后供应链中养殖户处于被动地位,传统分销模式缺乏品质管理意识,故产业投入与产出不符。目前,对虾出塘后收购商通常对活品采用充氧有水运输进入分销渠道,这种流通方式不仅面临高成本、高排放、低成活率等风险,也会导致市场虾类产品品质变化无常[9-10]。总之,目前对虾出塘后流通环节完全依赖运输批发商的经验,市场尚未建立产品品质理念,活销鲜销均非常被动。
近年来,品质易逝期理念在水产品鲜活品质研究中屡见报道,活品有贝类(菲律宾蛤仔、虾夷扇贝),鲜品有红鳍东方鲀及大菱鲆,多种研究表明,无论是活品还是鲜品,自活体离水开始,都存在一个品质易逝期,该阶段所经历的处置方式对于供应链下游的鲜活品质的影响至关重要[11-14]。尽管水产品在池塘养殖技术上获得了一定成就,但其仍然面临销售端品质欠佳、养殖户获利较低等诸多挑战[15]。
本研究团队对大连地区池塘养殖凡纳滨对虾捕后流通调查发现,流通过程中缺少标准化管理,对易逝期认识不足,从而导致终端产品质量不佳。为提高对虾捕后品质,亟待设计一个具有集散中转性质的集约化初级产品加工基地,在基地中实现原料去杂、分级、保活及锁鲜控制功能,其中产品加工包括活品的暂养恢复、鲜品与冻品的锁鲜处置、产品包装等。为此,针对中转基地的功能需要,本研究中对改进的供应模式中养殖户到中转基地的运输过程及市场销售过程中存在的问题进行了探讨,并借助品质易逝期理念,探讨了活品对虾和锁鲜品在贮藏过程中品质的稳定性,以期改善销售端对虾品质,为推动产业规范化或集约化生产提供科学参考。
1 材料与方法
1.1 材料
池塘养殖凡纳滨对虾于2020年10月采购自大连市瓦房店某对虾养殖场。单尾体质量为20~25 g,体长为10~13 cm,采用商用水箱车打氧保活运输,经过3 h运抵实验室后进行挑选,剔除活力较差和肢体残缺的个体,进入下一步模拟运输处置。
1.2 方法
1.2.1 试验设计 现有养殖对虾离水后主要以初级农产品销售模式为主,因缺乏组织协作导致出塘后品质无法控制(图1),本研究中设计了一个有集散和初级加工性质的中转基地,集中对产地虾原料进行保活及锁鲜控制,以探讨建立产品设计及管理体系的可行性。

图1 小型分散对虾产区销售现状与供应链方案设计Fig.1 Less organized marketing and designed supply chains for the scattered shrimp-farming operations areas
试验方案如表1所示,活体虾抵达实验室(记为I)后进入模拟流通。首先,模拟4 h塘头至中转基地的早期无水运输(I0),随后的基地处置分两组,一组为复水活品组(L),另一组为冰卒锁鲜组(FL),跟踪分析各组品质变化。

表1 试验方案、样品处置及分组细则Tab.1 Scheme and details of sample disposal and grouping
如上所述,活体运抵实验室后立即取样作为模拟塘头样品I(图2(a)),模拟无水运输参照Kuhn等[16]方法并加以改进,挑选健康且活力较好的凡纳滨对虾个体,沥干水分,采用一层湿木屑一层虾的方式装箱(图2(b)、(c)),将泡沫箱用密封袋包装后向袋中充氧一次,使环境中氧气含量达到60%~70%,然后置于15 ℃冰箱中贮藏4 h(图2(d))。

图2 模拟无水运输处理示意图Fig.2 Simulation for waterless transportation process diagram
经4 h模拟运输后,将样品取出分为两组,其中一组放入人工海水中暂养3 d(水温为25.0 ℃,盐度为3.5,密度80尾/m3),取样点时间分别设置为6、12、36、60 h;另外一组将虾放入冰中(虾与冰的体积比为1∶2),冰卒致死后,按照30尾/袋规格装入密封袋中进行为期6 d的冰贮藏。
1.2.2 样品的采集与处理 表2为凡纳滨对虾采样方案,初始原料在 I 点取样,模拟运输4 h后在 I0点取样;活品在复水后6、12、36、60 h分别取样一次,每次设置3个平行;锁鲜品分别在冰卒后6、12、36、60、84、108、132 h分别取样一次,每次设置3个平行。

表2 凡纳滨对虾采样方案Tab.2 Sampling scheme of Pacific white leg shrimp Litopenaeus vannamei
样品处理:使用注射器采集对虾活体血液,获得血液样品;活品虾先使用冰水混合物(冰与水体积比为1∶1)进行冰卒,断头去掉虾壳和虾皮取虾腹部前三节肌肉;锁鲜品直接断头去壳去皮取虾腹部前三节肌肉。
1.2.3 理化分析
1)一般化学组成。分别采用直接干燥法、凯氏定氮法、索氏抽提法、分光光度法、马弗炉灼烧法测定水分、粗蛋白质、粗脂肪、总糖、粗灰分含量。
2)血糖。根据Skudlarek等[9]和Qiu等[17]的方法并略做修改。使用1 mL注射器吸取0.5 mL肝素(20 mg/mL),于虾腹部取血。采用南京建成生物工程研究所葡萄糖试剂盒测定血糖含量。
3)pH。根据刘金洋[18]的测定方法。称取2 g虾肉加入10 mL 碘乙酸钠(20 mmol/L),用玻璃棒将肉充分捣碎,静置30 min,测定至pH不变。每个样品设置3个平行。
4)糖原。根据刘慧慧[19]的测定方法。取2 g虾肌肉肉糜,加入4 mL质量分数30%的KOH溶液,100 ℃水浴消化20 min,冷却至室温后加入20 mL无水乙醇,以3 000g离心15 min;弃上清液后向沉淀中加入10 mL蒸馏水、15 mL无水乙醇和一滴饱和氯化钾,搅拌使沉淀充分溶解,再以3 000g离心15 min;弃上清液后以蒸馏水将沉淀定容至25 mL,倒回试管静置10 min,取0.5 mL上清液加4.5 mL蒸馏水。取60 μL稀释液加入240 μL显色液,混匀沸水煮10 min,流水冷却后静置10 min,取200 μL反应液置于96孔板,在620 nm下测定吸光度。每个样品设置3个平行。显色液配方:称取0.1 g蒽酮溶于50 mL体积分数80%的浓硫酸中,避光储存,现用现配。
5)ATP及其关联物。参照刘慧慧[19]的测定方法。称取1 g虾肌肉肉糜,加入10 mL质量分数5%的PCA,冰浴中捣碎10 min,再加入2 mol/L KOH调节pH至2.0~3.5,加水定容至20 mL,以3 000g离心5 min,取4 mL上清液过0.45 μm滤膜,加入1 mL 0.1 mol/L的磷酸盐缓冲溶液(pH 7.5),用反向高效色谱法测定ATP及其关联物含量。
6)琥珀酸脱氢酶(SDH)。作为有氧代谢的指示酶,SDH常用于缺氧胁迫分析。参照Guderley等[20]的方法并略做修改。称取1 g虾肌肉肉糜,加入10 mL TTC试剂,于37 ℃水浴中发色30 min后立即冷却,加入15 mL无水乙醇,用转子搅拌30 min,以5 000g离心5 min,过0.45 μm滤膜,在485 nm下测定吸光度值,并带入标准曲线中计算分析。TTC试剂配方:0.2% TTC、0.1%琥珀酸钠、2.84% Na2HPO4、2.34% NaCl(均为质量分数)。
7)蛋白溶解度。肌原纤维蛋白提取参照Hashimoto等[21]的方法并略做修改。取适当体积的虾肌肉肉糜,加入6倍体积的20 mmol/L Tris-HCl缓冲溶液(含0.05 mol/L NaCl,pH 7.5),以10 000 r/min均质2次,每次30 s,得到含肌原纤维蛋白的提取液,并通过20 mmol/L Tris-HCl缓冲溶液(含0.05 mol/L NaCl,pH 7.5)调至肌原纤维蛋白浓度为10 mg/mL。调节肌原纤维蛋白所处反应体系中盐浓度分别为0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 mol/L,置于冰水中反应20 min,于4 ℃下以10 000g离心10 min,取上清液通过双缩脲比色法测定蛋白浓度并制作曲线,结果显示,盐浓度为0.1 mol/L时水溶性蛋白全部溶出,在盐浓度为0.6 mol/L时盐溶性蛋白全部溶出。水溶性蛋白是指可以溶于水的蛋白质,盐溶性蛋白是虾肌肉中最主要的蛋白质[22]。
1.3 数据处理
所有试验均进行3次重复,试验数据以平均值±标准误(mean±S.E.)表示,采用SPSS 25软件进行单因素方差分析,用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 凡纳滨对虾原料的基本特性
2.1.1 一般化学组成 经测定,试验凡纳滨对虾可食部位中,肌肉水分含量为74.66%,粗蛋白质含量为19.71%,粗脂肪含量为0.79%,总糖含量为2.36%,粗灰分含量为1.59%(表3)。

表3 凡纳滨对虾原料肌肉的一般化学组成Tab.3 Approximate composition of muscle in raw Pacific white leg shrimp Litopenaeus vannamei
2.1.2 无水运输对凡纳滨对虾生化特性的影响 从表4可见,无水运输4 h会导致血糖和糖原发生显著性下降(P<0.05),琥珀酸脱氢酶(SDH)活性也发生显著性降低(P<0.05),ATP及其关联物和pH则具有一定的稳定性。

表4 无水运输对凡纳滨对虾原料生化特性的影响Tab.4 Effects of waterless transport on biochemical characteristics of raw Pacific white leg shrimp Litopenaeus vannamei
2.2 复水过程中对虾的活力恢复及活品稳定性
2.2.1 pH、血糖、糖原、蛋白溶解度及SDH活性
从表5可见:经过复水6 h后,凡纳滨对虾的血糖含量有所上升,在之后的复水过程中血糖含量显著下降(P<0.05),复水12 h后血糖下降速度有所减缓,在复水36 h后达到最低;无水运输后pH为7.14±0.08,经过6 h的复水其pH显著上升(P<0.05),之后略有波动;糖原在经过复水6 h后同样显著升高(P<0.05),之后的活品贮运过程中逐步下降,复水60 h后糖原含量达到最低(P<0.05);凡纳滨对虾盐溶性蛋白占总蛋白的42%~50%,水溶性和盐溶性两种蛋白在保活过程中均未发生显著的降解(P>0.05);复水过程中SDH酶活力发生显著性下降(P<0.05),复水12 h后几乎检测不到SDH酶活性。

表5 凡纳滨对虾复水后活品贮运过程中pH、血糖、糖原、蛋白溶解度及SDH活性的变化Tab.5 Changes in pH,blood glucose and glycogen contents,protein solubility and SDH activity of rewatered Pacific white leg shrimp Litopenaeus vannamei during live storage
2.2.2 ATP及其关联物 从图3可见,经过6 h的复水,活品对虾肌肉中ATP含量无显著性变化(P>0.05),复水12 h后发生显著下降(P<0.05)。

图3 凡纳滨对虾活品贮藏过程中ATP及其关联物含量变化Fig.3 Changes in contents of ATP and related compounds in Pacific white leg shrimp Litopenaeus vannamei during live storage
2.3 冰卒对虾的锁鲜效应及冰藏稳定性
2.3.1 pH、糖原及蛋白溶解度 从表6可见:凡纳滨对虾在冰藏12 h时各指标(除盐溶性蛋白外)发生显著性下降(P<0.05);冰藏12 h后随贮藏时间延长pH逐渐上升,冰藏36 h与0 h时pH几乎相同,冰藏84 h时达到最大值;糖原含量则在整个冰藏过程中保持下降趋势,冰藏60~132 h发生显著性变化(P<0.05),在108 h时达到最小值;水溶性蛋白溶解度在贮藏的初期(12~36 h)即发生显著的降低(P<0.05),在冰藏132 h时达到最低(P<0.05),盐溶性蛋白溶解度在冰藏60~132 h期间发生了显著的下降(P<0.05)。蛋白溶解度的变化趋势与pH的结果相对应,冰藏期间蛋白质会发生降解生成碱性的含氮化合物。由以上结果可知,冰卒处理可以降低糖原的消耗,维持pH稳定性,呈现较好的冰藏稳定性。
2.3.2 ATP及其关联物 虾死后能量代谢过程中主要能量物质是ATP,虾体ATP分解途径为ATP→ADP→AMP→IMP→HxR→Hx。从图4可见:随着贮存时间的延长,ATP快速降解生成AMP,在冰藏36 h时消耗完全;在60 h前AMP呈快速积累的特性,IMP呈现先升高后下降的变化趋势且在84 h时达到最大含量,在84 h时肌肉中检测到较高的HxR含量。
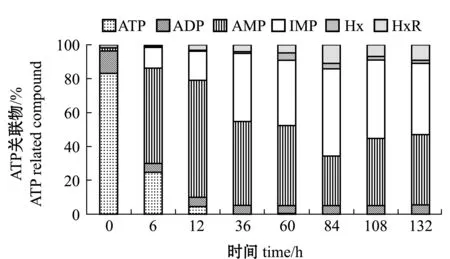
图4 凡纳滨对虾锁鲜品冰藏过程中ATP及其关联物含量变化Fig.4 Changes in contents of ATP and related compound in freshness-locked Pacific white leg shrimp Litopenaeus vannamei during iced storage

表6 凡纳滨对虾锁鲜品冰藏过程中pH、糖原及蛋白溶解度的变化Tab.6 Changes in pH,glycogen content and protein solubility of Pacific white leg shrimp Litopenaeus vannamei during iced storage
2.4 活品与锁鲜品的表观差异
图5为凡纳滨对虾活品与锁鲜品贮藏期间外观比较。从图5可见:活体应激导致酚酶氧化褐变,与原料(I)相比4 h无水运输后(I0)明显发生褐变;无论复水保活还是冰卒锁鲜,贮藏期间虾仁的颜色都会逐渐加深,相同贮藏时间对比褐变受抑制程度,锁鲜品明显优于活品;整体来看,锁鲜品6 d时色泽有所下降,总体趋于稳定,锁鲜效应突出。

I—塘头;I0—无水运输4 h后;L—复水活品组;FL—冰藏锁鲜品组。 I—raw shrimp;I0—4 hours after the waterless transport;L—the rewatered live product group;FL—the iced freshness locked product group.图5 凡纳滨对虾活品与锁鲜品肌肉外观比较Fig.5 Comparison of muscle appearance between live and freshness-locked Pacific white leg shrimp Litopenaeus vannamei
3 讨论
3.1 易逝期活品对虾的品质机制
针对离水初期水产品的品质变化剧烈,本研究团队首先提出了离水初期为水产品品质的摇篮即品质易逝期,易逝期胁迫会使风味急剧下降,适宜条件下的易逝期处置对于水产品品质的可恢复性和贮藏中品质稳定性具有重要的影响[11-12]。
本研究中,针对北方地区对虾以初级农产品为主的流通模式,设立了具有集散性质的中转基地用于初级加工,即品质易逝期处置,因基地设在产区,从池塘到集散地运输不超过1 h,故本研究中设计模拟了相对极限的4 h无水运输,使无水运输对虾体品质的影响最大化,结果表明,多项指标反映了设计的可行性。
活体虾血液中正常血糖指标反映了虾类属性和正常生理状态,与虾类的能量代谢机理和健康状况密切相关,若虾体受到外界因素影响,其血糖指标会随之变化[23]。本研究表明,凡纳滨对虾在无水运输过程中会大量消耗血糖,从塘头初始血糖含量为0.64 mmol/L下降到0.41 mmol/L,虾体经过6 h的暂养恢复,其血糖含量从0.41 mmol/L升高到0.44 mmol/L,在之后的复水36 h时达到最低含量0.23 mmol/L。这表明,经过中转基地复水处置凡纳滨对虾血糖具有一定的可恢复性,但离水会加快虾体的能量消耗。短暂的复水后虾体活力有一定恢复,但游泳、饥饿等胁迫也会消耗血糖,因此,血糖含量变化较为明显。
研究表明,在13~20 ℃水温下虾体会进入低活力状态[24]。本研究中,采用15 ℃的冰箱模拟无水运输,在无水运输4 h期间可能由于较低的温度减小虾体胁迫应答导致pH变化不明显;在之后模拟的活品贮藏保活期间,虾体受到水质和饥饿等胁迫,也会消耗糖原生成乳酸,pH和糖原含量下降,其中,糖原在60 h后下降速度变快。
本研究模拟运输过程中ATP含量几乎无变化,这与pH变化趋势相同,可以确定15 ℃休眠虾体代谢能力减弱;中转基地暂养期间,虾体从休眠中恢复活力,游泳等运动会消耗大量ATP,但适应环境后ATP有轻微的回升,活品贮藏60 h后为了应对虾体外部环境的变化,包括水质下降、氧气含量不足等,ATP大量消耗,同时,虾体随贮藏时间延长其代谢能力也会下降,合成ATP的能力减弱,所以ATP含量随着时间变化发生显著性下降[25]。
本研究中,离水会导致凡纳滨对虾血糖和糖原的消耗,但模拟运输过程中虾体休眠也会适当控制能量的消耗,使虾体能在一定时间内维持机体稳态,有助于散户到中转基地的短途运输。中转基地的暂养池对虾体糖原、血糖等代谢能力具有一定的可恢复性。长时间的活品贮藏后,虾体虽然有活力,但其糖原、ATP等指标显著下降,呈现“活而不鲜”的状态。活品贮藏过程中水体积累的氨氮是最常见的有毒物质,对机体的生理功能具有显著的负面影响,本研究中未对贮藏的水进行更换,随着贮藏时间延长氨氮逐渐累积,最终氨氮累计量超过虾体耐受能力[26]。本试验中凡纳滨对虾活品的贮藏时间为60 h,品质前提下各项活品贮藏参数之间的关联与优化尚具有针对性的实际探索意义。
3.2 易逝期对虾的锁鲜效应
本研究中,在凡纳滨对虾抵达中转基地后采用片冰对虾体进行冰卒“锁鲜”处置,并对冰藏过程中锁鲜品品质变化进行探讨。虾体死后会依靠体内糖原进行无氧糖酵解产生能量,锁鲜处置会影响贮藏中ATP和糖原含量变化。凡纳滨对虾肌肉中ATP快速下降的原因有可能是ATPase前期还处于较高的活性。虾死后Ga2+吸附能力减弱,大量释放到肌原纤维中,从而激活Ga2+-ATP酶活,使ATP快速降解至AMP、IMP[27]。而IMP的降解速度较慢,所以在贮藏过程中主要积蓄IMP。本研究中发现,凡纳滨对虾在冰藏过程中主要积累AMP和IMP,冰藏36 h时ATP完全降解,AMP和IMP含量分别占ATP关联物总量的49.57%和40.18%,冰藏84 h时,AMP和IMP含量分别占ATP关联物总量的29.27%和51.44%,冰藏108 h后IMP占比开始减小。本研究中凡纳滨对虾在贮藏期间的AMP和IMP蓄积与斑节对虾相似[28]。
锁鲜品在冰藏前12 h糖原糖酵解生成乳酸导致pH降低,但在之后的冰藏过程中,由内外源分解酶协同作用导致肌肉中胺类物质积累,pH呈现轻微上升趋势,这是虾类冷藏过程中的普遍变化趋势[29],锁鲜目的是有效延缓这一上升趋势。Chouljenko等[30]认为,虾肌肉pH是虾死后评价虾体新鲜度重要的生化指标,pH<7.95时虾体未腐烂。本研究显示,在132 h时pH<7.95,冰鲜储藏6 d时虾体依旧未腐烂,说明在早期品质易逝期立即进行冰卒锁鲜处置可以有效延迟虾体腐烂。盐溶性蛋白在冰藏84 h时依旧占虾体肌肉总蛋白的30.20%。
外观(酚酶氧化褐变)是甲壳类特别是虾类产品最直观最重要的评判指标之一[7]。消费者挑选水产品时,片面地认为活品优于鲜品,鲜品优于冻品。根据本研究中品质易逝期不同处理结果发现,无水运输会导致虾体肌肉颜色变暗,透明度下降,后易逝期结果发现,基地复水后肌肉颜色未呈现可恢复性,贮运中表现为“活而不鲜”的状态。相比于活品,锁鲜品肌肉褐变速度明显延迟,贮存时间相同的60 h时,锁鲜品呈现青色半透明状,而活品已经完全变红,品质有明显的差异。锁鲜品贮藏到132 h时其肌肉颜色依旧较活品贮藏60 h的品质好。
综上所述,作者认为建立中转基地可以有效地在品质易逝期对凡纳滨对虾进行处置,作为池塘到分销链的缓冲带,可有效缓解因持续运输对活体的胁迫叠加,品质易逝期的锁鲜处置对后品质易逝期具有延迟效应。已有研究发现,红鳍东方鲀死后进行鱼体降温排血和大菱鲆断髓速杀对鱼体后品质易逝期均具有延迟效应[12-13]。
4 结论
针对小型分散产区养殖对虾的初级农产品销售现状,本研究中基于品质调控机理的探索构建了渔后产品设计方案,主要结论归纳如下。
1)养殖凡纳滨对虾活体离水早期存在一个品质易逝期,此为后续供应链至销售端对虾品质的摇篮。该阶段加以适时调控,一方面可消除活体离水应激疲劳,分选后可再进入商品活品流通;另一方面,冰鲜产品更加值得关注,易逝期锁鲜处置能够有效实施源头品质控制,在冰鲜流通过程体现了卓越的锁鲜优势。
2)基于品质易逝期机制,可以将散户的养殖活体进入具有集散性质的产区中转基地进行品质调控,通过有的放矢的产品设计,有计划实施流通销售以改善养殖凡纳滨对虾渔后被动现状,实现渔后的产业化。

