基于lncRNA/GABAA受体探讨产后抑郁的发病及干预机制
冀 荔,王烈宏,刘淑敏
(青海红十字医院a.妇产科; b.检验科,西宁 810000)
产后抑郁症(PPD)是一种以产褥期持续抑郁为特征的精神障碍,主要表现为抑郁、失眠、焦虑、悲伤、内疚、易怒甚至自杀倾向[1]。PPD不仅影响产妇的身心健康,而且剥夺了母亲对婴儿的有效照顾[2]。因此,探讨PPD的病理机制,寻找其发展的关键目标,是一个重要而紧迫的课题。过去几十年基因组测序技术的改进使转录本发现达到了革命性的规模。蛋白质编码序列仅占人类基因组的2%,大量非编码序列被转录为非编码RNA(ncRNA),在许多生物过程的调节中发挥关键作用[3]。长非编码RNA(lncRNA)是一种长度超过200 nt的非编码RNA,大量存在于大脑中(占所有lncRNA的40%),并在哺乳动物神经系统中显示出精确调控的表达模式[3]。有研究[4]表明lncRNA可能参与抑郁症的病理生理过程。然而,lncRNA对PPD的调节作用目前还未见报道。本研究制备了激素模拟妊娠诱导的PPD小鼠模型,之后将MAGI2-AS3鉴定为PPD模型中异常高表达的lncRNA。MAGI2-AS3为多种疾病中细胞活力的调节剂,但其与PPD发病机制之间的确切关联在很大程度上仍然未知[5]。此外,综合生物信息分析和表达谱检测表明在PPD模型中存在推定的MAGI2-AS3/miR-330/γ-氨基丁酸A(GABAA)相互作用。因此,本研究旨在诱导这些分子的表达改变以探测它们在PPD发病和发展中的作用。
1 材料与方法
1.1 小鼠和PPD模型建立
C57BL/6J小鼠(雌性,3月龄)购自上海斯莱克实验动物有限责任公司。小鼠饲养于环境温度为(22±2)℃和12:12 h光/暗循环的房间内自由获取食物和水。参照文献[6]方法将3月龄的雌性C57BL/6J小鼠建立激素模拟妊娠诱导的PPD模型。在1%戊巴比妥钠(60 mg·kg-1,i.p.)麻醉下使用无菌技术对小鼠进行双侧卵巢切除术,并放置7 d。将去卵巢的小鼠皮下注射苯甲酸雌二醇(20 μg·kg-1)和黄体酮(32 mg·kg-1),每天1次,连续16 d。然后停用黄体酮并继续服用高剂量苯甲酸雌二醇(400 μg·kg-1)7 d。苯甲酸雌二醇和黄体酮购自上海阿拉丁生化科技股份有限公司,并溶于芝麻油中。对照小鼠进行假手术并仅接受芝麻油处理。
1.2 行为评估
在造模前和造模第33天测量蔗糖偏好,在造模第33天进行尾悬试验和强迫游泳测试。
1.2.1 蔗糖偏好测试(SPT)
SPT试验持续4 d。在开始2 d,分别给小鼠两瓶含1%蔗糖溶液和纯水。每6 h切换1次两瓶溶液的位置。在接下来的2 d里,小鼠禁止饮水和饮食18 h,然后暴露在预先称重的瓶子中6 h,每2 h切换1次瓶子的位置。蔗糖偏好指数计算为消耗的蔗糖溶液与液体摄入总量的百分比。
1.2.2 尾悬试验(TST)
小鼠的尾巴用胶带缠住,倒扣在钩子上。在6 min 试验期的最后4 min内,由一名对研究一无所知的观察人员记录不动时间。不动定义为小鼠被动地悬挂并且完全静止。
1.2.3 强迫游泳测试(FST)
将每只试验小鼠放置在含有淡水[(25±1)℃,深15 cm)]的透明圆柱体(高25 cm,内径15 cm)中6 min。在6 min试验期的最后4 min内,由一名对研究一无所知的观察人员记录不动时间。每次试验后都要换水。不动定义为小鼠漂浮在水中不挣扎或只是轻微移动以保持呼吸。
1.3 苏木精和伊红(HE)染色
行为评估后,对每组小鼠进行麻醉并向上固定,暴露心脏。左心灌注4%多聚甲醛固定,获得小鼠脑组织。将海马分离固定在Bouin氏液中,梯度酒精脱水,二甲苯浸泡,石蜡包埋,切成5 μm切片,二甲苯脱蜡。然后使用HE染色试剂盒(上海Beyotime公司)对切片进行染色。将切片在苏木精中浸泡12 min,在1%盐酸乙醇中分色10 s,然后在伊红中浸泡4 min。之后,将切片脱水、透明、中性香脂密封,并在显微镜(日本Olympus公司)下观察。
1.4 微阵列分析
分别取3只PPD模型小鼠和假手术小鼠用于RNA微阵列分析。收集海马组织,使用TRIzol试剂(美国Invitrogen公司)提取总RNA。然后,基于260、280和230 nm处的光密度,使用NanoDrop 2000C(Thermo Fisher)确定RNA纯度。取50 μg总RNA,使用miRNA Complete Labeling and Hyb Kit(美国Agilent公司)标记miRNA,然后在60 ℃下用杂交混合物和Hyb标记杂交处理20 h。将miRNA与Human miRNA Microarray Release(美国Agilent公司)进一步杂交,并使用SureScan Dx 微阵列扫描仪(美国Agilent公司)进行扫描。同样,进行lncRNA微阵列分析,其中使用50 μg RNA,并将lncRNA与小鼠LncRNA微阵列V6.0(上海SHBIO公司)杂交。获得的数据经过质量中心分析和标准化,以确定差异表达的miRNA和lncRNA。
1.5 逆转录定量聚合酶链反应(RT-PCR)
使用TRIzol试剂收集海马组织和细胞的总RNA,并使用PrimeScript Master Mix Kit(日本Takara公司)逆转录为cDNA。使用SYBR Premix Ex Taq Ⅱ试剂盒(日本Takara公司)确定相对基因表达,并在Mx3005P qPCR系统(美国Stratagene公司)上运行qPCR。使用2-ΔΔCT方法将目标基因的相对表达水平归一化为U6(对应于miR-330表达计算)和GAPDH(对应于MAGI2-AS3、GABAA表达计算)的相对表达水平。MAGI2-AS3引物(正向:5′-TCCTAAGGTCAAGAGAAGTGTCAG-3′;反向:5′-GTGGCGATGTGGCAGAGA A-3′);miR-330引物(正向:5′-TCGAATCTAGAGATCCGACGCCGC-3′;反向:5′-GACGTGT AAACATCCTACACTCAGCT-3′);GABAA引物(正向:5′-TATACAAGGGCAAGCTCUCTG T-3′;反向:5′-TGCGGGTGCTCGCTTCGGCAGC-3′);U6引物(正向:5′-CTCGCTTCGGCAG CACA-3′;反向:5′-AACGCTTCACGAATTTGCGT-3′)和GAPDH引物(正向:5′-GGGAGCCAAAAGGGTCATCA-3′;反向:5′-TGATGGCATGGACTGTGGTC-3′)由生工生物工程(上海)股份有限公司提供。
1.6 病毒注射
PPD模型建立后第1天,实验小鼠用1%戊巴比妥钠(60 mg·kg-1,i.p.)麻醉,头部固定在SR-5立体定向框架(日本Narishige公司)。硬脑膜暴露后,在无菌条件下用微量注射器(瑞典Dakumar Machinery公司)将2 μL慢病毒(sh-NC、sh-MAGI2-AS3、sh-GABAA)注入海马CA3区(AP-1.94 mm;ML±2.4 mm;DV-1.9 mm;相对于前囟)。注射后将注射器保持在原位10 min,以尽量减少液体回流。小鼠在(31±1)℃的温暖房间中恢复3 d。
1.7 细胞培养
大鼠肾上腺嗜铬细胞瘤细胞系PC12购自美国典型培养物保藏中心,并维持在含有5%胎牛血清(FBS)、10%马血清、100 U·mL-1青霉素和100 μg·mL-1链霉素(美国Gibco公司)的Dulbecco改良Eagle培养基(DMEM,美国Gibco公司)中培养。取指数生长期细胞,用PBS重悬至4×104细胞·mL-1,接种到24孔板上,然后加入100 ng·mL-1神经生长因子(美国Sigma公司)和10%FBS进行72 h的分化刺激。
1.8 细胞转染
将PC12细胞分为MAGI2-AS3 NC(NC为阴性对照,转染MAGI2-AS3空载体)组、MAGI2-AS3-OE组(OE过表达,转染MAGI2-AS3 RNA片段)、miR-330对照组(转染miR-330 control)、miR-330模拟物组(转染miR-330 mimic)、sh-NC组(转染空载体病毒)、sh-MAGI2-AS3组(转染sh-MAGI2-AS3病毒)和sh-GABAA组(转染sh-GABAA病毒)。RNA片段和慢病毒构建均由上海吉玛制药技术有限公司完成。在转染前24 h将细胞接种在6孔板上。当细胞汇合度达到约70%时,使用Lipofectamine 3000试剂(美国Thermo Fisher Scientific公司)进行转染。
1.9 5-Ethynyl-2′-deoxyuridine(EdU)标记
使用Cell-Light EdU Apollo567 In Vitro Kit(广东RiboBio公司)测定细胞的增殖活性。将50 μL细胞固定溶液加载到培养板上,在室温下进行30 min细胞孵育,用PBS洗涤细胞,用甘氨酸溶液孵育8 min,用含有0.5% Triton X-100的PBS洗涤。然后,将细胞用标记溶液在黑暗中反应30 min,用甲醇和PBS洗涤2次,在室温下用1×Hoechst溶液在黑暗中处理20 min。在CX23荧光显微镜(日本Olympus公司)下观察标记,其中涉及3个随机场。计数EdU标记的细胞数(增殖细胞)和Hoechst标记的细胞数(总细胞数),计算细胞增殖率:细胞增殖率=增殖细胞数/总细胞数×100%。进行了3个独立的实验。
1.10 荧光素酶测定
筛选出的lncRNA与miRNA的结合位点在StarBase(http://starbase.sysu.edu.cn/)上预测,miRNA与mRNA的结合位点在StarBase、TargetScan(http://www.targetscan .org/)和miRDB(http://www.mirdb.org/)上预测。将miR-330和MAGI2-AS3的3′UTR,或HIC2、GABAA、AFF4或ZUP1和miR-330的3′UTR插入pMIR-REPORT(Thermo Fisher)荧光素酶报告载体并共转染到HEK293T细胞中。24 h后裂解细胞,并使用双荧光素酶报告基因检测系统(美国Promega Corporation公司)测量相对荧光素酶活性。
1.11 统计学方法
使用SPSS22.0软件分析数据。通过Kolmogorov-Smirnov检验检查数据是否处于正态分布。测量数据显示为平均值±标准偏差。使用t检验评估2组之间的差异,并使用单向或双向方差分析(ANOVA)比较多组之间的差异,然后使用Tukey的多重比较检验。P<0.05为差异具有统计学意义。
2 结果
2.1 PPD模型小鼠表现出抑郁样行为
为了验证PPD模型的成功建立,通过SPT、FST和TST评估抑郁样行为。SPT开始时,PPD组和假手术组的蔗糖偏好无显著差异,而建模后PPD组蔗糖偏好率下降了(11.1±3.4)%(交互作用F(1,32)=5.423,P=0.026;模型F(1,32)=6.149,P=0.019;PPD F(1,32)=13.280,P=0.001)(图1A)。与假手术组相比,PPD组的FST不动时间增加了(65.47±9.65)s(t=6.786,P<0.001),TST不动时间增加了(70.06±5.09)s(t=13.76,P<0.001)(图1B—C)。HE染色结果表明,PPD组小鼠海马组织中的锥体细胞排列不规则,形状和边界不清,数量减少(图1D)。基于PPD小鼠和假手术组小鼠的海马组织进行lncRNA微阵列分析,发现在PPD小鼠中lncRNA MAGI2-AS3显著上调(图1E)。这一发现通过RT-qPCR得到验证,在PPD小鼠海马组织中MAGI2-AS3表达水平高于假手术组(图1F)。

A—C:PPD小鼠SPT蔗糖偏好率(A)、FST不动时间(B)、TST不动时间(C)的测定结果。D:HE染色观察PPD小鼠海马组织损伤。与假手术组相比,**P<0.01,***P<0.001;与第0天相比,#P<0.05。

E:微阵列分析测定的PPD小鼠和假手术小鼠海马组织间差异表达的lncRNAs。F:通过RT-qPCR测量小鼠海马组织中MAGI2-AS3表达。与假手术组相比,***P<0.001。
2.2 抑制MAGI2-AS3表达减轻神经元损伤
为了确定MAGI2-AS3在神经元恢复中的潜在作用,在PC12细胞中施用sh-MAGI2-AS3慢病毒,导致细胞中MAGI2-AS3表达降低(图2A)。EdU标记分析结果表明,MAGI2-AS3表达降低增加了PC12细胞的活力(图2B)。PPD小鼠海马注射sh-MAGI2-AS3慢病毒后,海马组织的锥体细胞排列紧密,细胞数量增加,边界清晰(图2C)。
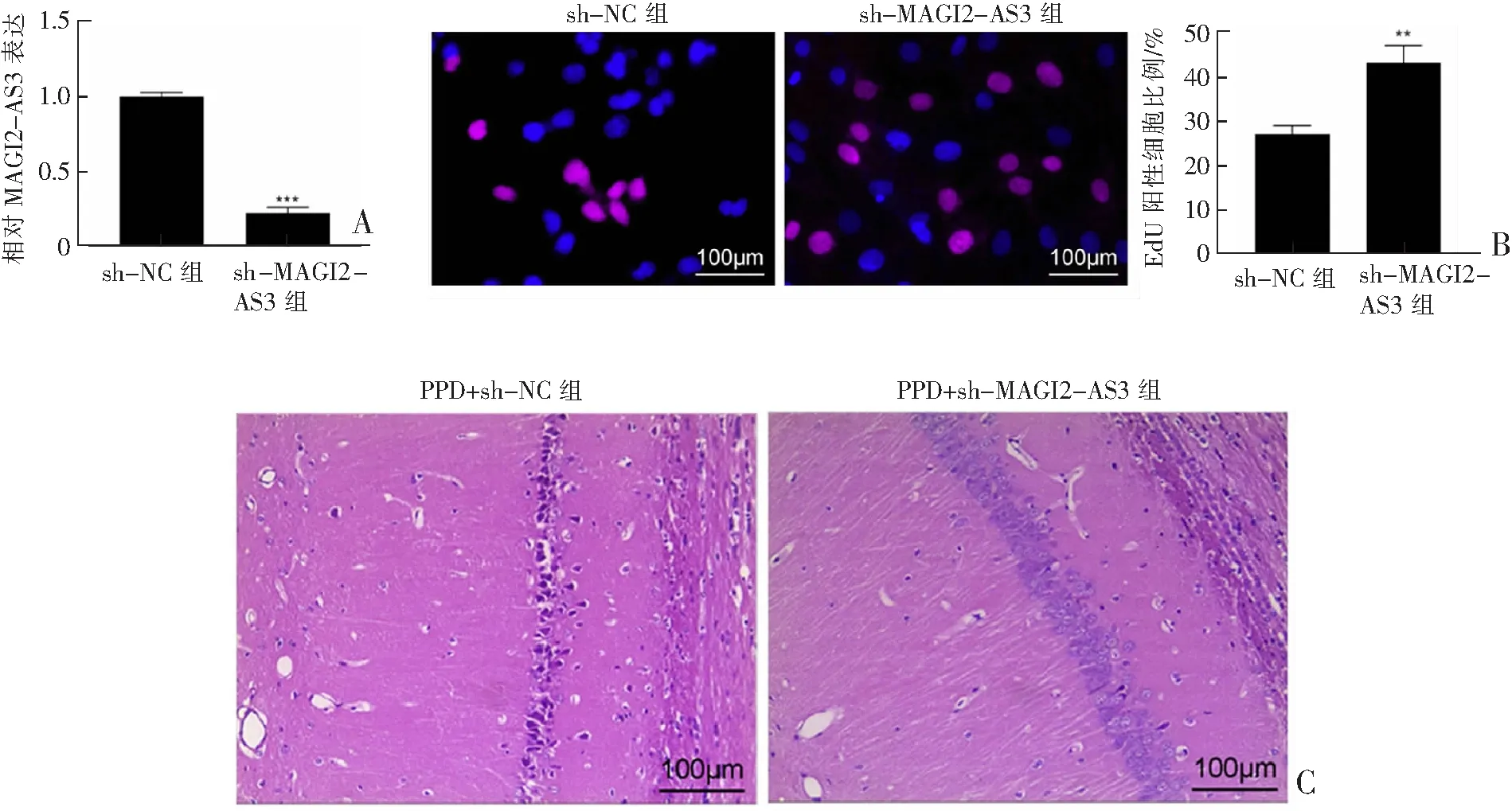
A:通过RT-qPCR确定sh-MAGI2-AS3慢病毒转染后PC12细胞中MAGI2-AS3表达。B:通过EdU标记分析确定的细胞活力(增殖活性)。C:HE染色观察sh-MAGI2-AS3慢病毒对PPD小鼠海马组织神经元损伤影响。与sh-NC组相比,**P<0.01,***P<0.001。
2.3 LncRNA MAGI2-AS3作为miR-330的海绵发挥作用
miRNA微阵列分析发现了20个异常低表达的miRNA(图3A)。将结果与StarBase上预测的MAGI2-AS3的目标miRNA进行比较,发现miR-330相交(图3B)。RT-qPCR发现PPD小鼠海马中miR-330表达相对于假手术小鼠的表达降低(图3C)。通过荧光素酶测定进一步验证MAGI2-AS3和miR-330之间的结合关系(图3D)。表明lncRNA MAGI2-AS3可能通过充当miR-330的海绵来上调GABAA表达,从而在PPD进展中发挥神经损伤作用。

A:通过微阵列分析确定的假手术和PPD小鼠之间差异表达的miRNA。B:在StarBase(http://starbase.sysu.edu.cn/)上预测的MAGI2-AS3的miRNA微阵列分析结果和目标miRNA的维恩图。C:通过RT-qPCR测定的小鼠海马组织中的miR-330表达。与假手术组相比,***P<0.001。D:通过双荧光素酶报告基因检测验证MAGI2-AS3和miR-330之间的靶标关系。与MAGI2-AS3+NC组相比,***P<0.001。
2.4 miR-330直接与GABAA结合
根据上述发现,进一步探测miR-330的下游分子。整合的在线预测确定了miR-330的4个靶mRNA:HIC2、GABAA、AFF4、ZUP1(图4A)。双荧光素酶报告基因分析确定仅GABAA野生型(WT)序列的共转染(图4B)。因此,GABAA被选为以下研究的对象,并发现GABAA在PPD小鼠海马组织中表达增加(图4C)。上调PC12细胞中MAGI2-AS3表达导致GABAA表达增加,但转染miR-330模拟物使细胞中GABAA表达降低(图4D)。

A:在StarBase上预测miR-330整合靶mRNA的Venn图。B:通过双荧光素酶报告基因分析(WT:野生型;MT:突变型);与miR-330 control相比,***P<0.001。C:RT-qPCR检测PPD小鼠和假手术小鼠海马组织中GABAA表达。与假手术组相比,***P<0.001。D:通过RT-qPCR测定MAGI2-AS3-OE和miR-330模拟转染PC12细胞后GABAA的表达。与MAGI2-AS3-NC组相比,***P<0.001;与miR-330 control组相比,###P<0.05。
2.5 抑制GABAA表达减轻神经元损伤
为了验证GABAA的确切作用,建立了GABAA表达降低的PC12细胞(图5A)。发现GABAA表达降低使PC12细胞增殖活性增加(图5B)。同样,HE染色结果表明敲低PPD小鼠海马组织中GABAA表达使神经元损伤减轻(图5C)。这些结果表明,GABAA表达降低可以增加神经元的活力,减少PPD小鼠神经元损伤。

A:通过RT-qPCR测定sh-GABAA转染后PC12细胞中GABAA表达。B:通过EdU标记试验测定细胞活力(增殖活性)。C:HE染色观察sh-GABAA慢病毒对PPD小鼠海马组织神经元损伤影响。与sh-NC组相比,*P<0.05,***P<0.001。
3 讨论
现代女性工作和生活压力很大,PPD的发病率也呈上升趋势[1]。PPD不仅严重损害女性的身心健康,而且对婴儿的健康成长、家庭和睦、社会稳定也带来有害影响[7]。基于基因疗法的非侵入特性,最近的研究集中在将其应用于神经系统疾病的控制中[8]。涉及lncRNA-miRNA-mRNA调控网络的ceRNA网络已在多种人类疾病中得到验证,并引起了人们对包括PPD在内的抑郁样行为治疗的日益关注[9]。本研究证明lncRNA MAGI2-AS3可能通过充当miR-330的海绵来上调GABAA表达,从而在PPD进展中发挥神经损伤作用。
本研究对PPD小鼠模型进行lncRNA微阵列分析,并确定MAGI2-AS3为PPD小鼠海马组织中表达显著升高的lncRNA。目前,越来越多lncRNA被鉴定为对抑郁样行为具有高度特异性或在PPD发病机制中发挥新兴作用[10]。例如,有研究[11]发现LncRNA Gm14205通过抑制催产素受体诱导星形胶质细胞NLRP3炎症小体激活对PPD具有保护作用。MAGI2-AS3已被确定为多种疾病中细胞活力的调节剂,并在卵巢癌和肝细胞癌中为miR-374b-5p的海绵体[12-13]。最近研究[14]报道了MAGI2-AS3过表达可以增强Aβ25-35对神经元活力和神经炎症的影响,并且MAGI2-AS3敲低可以减轻神经毒性和神经炎症,表明MAGI2-AS3在神经疾病进展和治疗中的潜在作用。此外,还有研究[15]证明了lncRNA MAGI2-AS3调控Fas/FasL通路抑制神经母细胞瘤生长。本研究发现抑制MAGI2-AS3表达增加了细胞活力,从而促进神经元恢复并抑制PPD诱导小鼠海马组织中的神经元损伤。这些结果表明MAGI2-AS3促进了PPD诱导的神经元丢失。
lncRNA通过与其他RNA分子的相互作用来实现其功能。本研究通过miRNA微阵列分析筛选出PPD小鼠海马中前20个下调的miRNA,并根据StarBase上的数据将结果与MAGI2-AS3的靶miRNA进行比较,进而确定miR-330为靶标。体内分析显示,miR-330在PPD小鼠海马组织中表达下调。此后,在3个数据库中预测了miR-330的靶标mRNA,确定了4个mRNA(HIC2、GABAA、AFF4和ZUP1)。荧光素酶报告基因检测验证了miR-330和GABAA之间的结合关系,但没有发现其与HIC1、AFF4和ZUP1之间的结合关系。GABAA表达在PPD模型小鼠海马组织中上调,这与之前的研究[16]一致,该研究[16]表明GABAA是GEO数据库中关于PPD的主要上调基因之一。有研究表明,敲除小鼠海马星形胶质细胞中的GABAA受体具有抗抑郁作用[17]。一项DNA甲基化研究[18]证实,GABAA受体甲基化与妊娠焦虑密切相关。此外,由Sage Therapeutics Biopharmaceutical公司开发的Zulresso(一种可同时作用于突触和突触外GABAA受体的变构调节剂)获得美国食品药品监督管理局(FDA)的批准用于治疗PPD[19],表明GABAA在PPD发展过程中的重要作用。本研究证实了GABAA在PPD小鼠海马组织中高表达,通过基因转染抑制GABAA表达促进了神经元恢复。
综上所述,本研究确定了一个涉及MAGI2-AS3/miR-330/GABAA的新型ceRNA网络,该网络可能涉及神经元损伤并增加PPD模型中的神经元丢失。

