H2S 对盐胁迫下黄瓜幼苗生长生理的影响
张文渊,张国斌,张帅磊,李嘉琪,吕剑,罗石磊
(甘肃农业大学园艺学院,甘肃 兰州 730070)
盐胁迫是影响作物养分吸收、生长和产量的常见环境胁迫之一。过高的盐浓度会对植物细胞产生许多负面影响,导致植物细胞内Na+、K+失衡,产生离子毒性、渗透胁迫,导致植物水分缺失、营养不良和氧化应激损伤[1]。研究表明,盐胁迫下植物生长量的减少发生在两个阶段:对外部渗透压增加的快速响应和叶片中Na+积累的较慢响应,表现为盐胁迫导致作物渗透失调从而抑制作物的幼叶生长,通过Na+的积累加速成熟叶片衰老[2]。同时,盐胁迫通过分解叶绿素、抑制Rubisco活性和降解光合器官中的膜蛋白,从而影响植物的光合效率。另外,盐胁迫会诱导植物体产生与积累活性氧,造成植物细胞膜系统与细胞器的氧化损伤[3]。
我国设施农业发展较快,化学肥料的大量施入以及不合理的灌溉措施导致土壤次生盐渍化严重,黄瓜(Cucumis sativusL.)作为我国设施栽培面积较大的蔬菜作物之一,其根系浅,根量少,在幼苗期对盐胁迫尤为敏感[4]。土壤含盐量过高会对黄瓜的生长过程产生严重影响,降低其产量和品质,极大地影响经济效益,因此增强黄瓜耐盐性尤为重要。
硫化氢(hydrogen sulfide,H2S)是继一氧化氮(nitric oxide,NO)、一氧化碳(carbon monoxide,CO)之后被发现的第三种气体信号分子[5],在植物体中可自由跨膜,极易透过质膜进入细胞,扩散到达细胞内隔间发挥作用[6]。已有研究表明,H2S 参与植物对盐胁迫的响应,陈明媛等[7]研究发现,H2S 可以增强盐胁迫下棉花幼苗光合效率,提高抗氧化酶活性,缓解盐胁迫诱导的生长抑制。刘建新等[8]研究发现,H2S 可提高裸燕麦幼苗叶片渗透调节物质的积累,缓解盐碱胁迫造成的渗透失衡。Shan 等[9]研究发现H2S 预处理可以通过提高玉米幼苗的抗氧化能力来缓解高盐伤害。除此之外,前人对于H2S 缓解黄瓜盐胁迫的研究已有报道,但多以根施[10]及预处理[11]的处理方法,研究H2S 对盐胁迫下黄瓜幼苗的影响,而以叶面持续喷施NaHS 的方式则鲜见报道。因此,本研究以新春四号黄瓜为试材,采用叶面喷施H2S 供体NaHS 和 H2S 合成抑制剂PAG 的方法,探讨外源施加H2S 以及抑制内源H2S 对盐胁迫下黄瓜幼苗渗调物质、叶绿素、最大光化学效率与抗氧化系统的影响,旨在探明H2S 提高黄瓜幼苗耐盐性的生理机制,为缓解黄瓜盐胁迫提供理论依据。
1 材料与方法
1.1 材料与植物生长条件
H2S 供体NaHS 购自MACKLIN 公司(中国上海),H2S内源合成抑制剂PAG(DL-炔丙基甘氨酸)购自源叶生物试剂公司(中国上海)。供试材料采用黄瓜品种新春四号(Cucumis sativusL.cv.Xinchun No.4),购自山东省新泰市科润种业有限公司,黄瓜幼苗栽培与处理于甘肃农业大学园艺学院人工气候箱中进行。
黄瓜种子于0.03%高锰酸钾溶液中消毒5 min,蒸馏水洗涤并浸泡5 h,播于铺2 层湿润滤纸的育苗盘中,25 ℃黑暗条件下保鲜膜覆盖以保持水分,待种子露白后调节培养温度为28 ℃/18 ℃、昼夜各12 h,光照度为20 000 lx。将7 d 龄黄瓜幼苗移至容量为1 L的黑色水培盒。营养液采用改良霍格兰营养液,幼苗在培养箱中培养,温度为28 ℃/18 ℃,光照度为30 000 lx,昼夜各12 h。
1.2 NaHS处理浓度筛选及处理时间优化
NaHS 浓度筛选:黄瓜幼苗苗龄20 d,长至两叶一心时,对黄瓜幼苗营养液中施加50 mmol/L 浓度的盐胁迫,盐浓度的选择参考武玥的研究[12],设置100、200、400、600、800 μmol/L等浓度NaHS溶液喷施叶面,以确定最适NaHS喷施浓度,叶片喷施以溶液雾化水珠均匀分布于叶片表面为度。连续处理7 d后取整株幼苗,烘干称取干质量。每个处理4盆,每盆3株,共12株,重复3次。
NaHS处理时间间隔筛选:以筛选出的NaHS浓度进行时间间隔的筛选,设置以下处理:T0(盐胁迫下喷施蒸馏水);T1(盐胁迫下200 μmol/L NaHS 溶液每天处理1 次);T2(盐胁迫下200 μmol/L NaHS溶液隔天处理);T3(盐胁迫下200 μmol/L NaHS 溶液隔2 d处理1次),处理7 d后,根据干质量确定最佳处理时间间隔,处理样本数与重复同上。
1.3 试验处理
挑选20 d 苗龄长势一致的黄瓜幼苗,进行试验处理,试验设计如表1所示,每个处理5盆,每盆3株,共15株,重复3次。处理7 d后,取黄瓜幼苗第2片真叶,剪碎混匀,将样品存于-80 ℃超低温冰箱中待测。

表1 试验处理Table 1 Experimental processing
1.4 测定指标与方法
1.4.1 黄瓜幼苗全株干质量的测定 幼苗全株干质量参考吕剑等[13]的方法测定。将处理7 d 的全株黄瓜幼苗于烘箱中105 ℃杀青,之后80 ℃烘至恒质量后用千分之一电子天平称其干质量。
1.4.2 光合色素含量及Fv/Fm的测定 叶绿素与类胡萝卜素含量采用95%乙醇法测定。Fv/Fm采用Handy PEA 仪 器 ( Plant Efficiency Analyser;Hansatech Instrument Ltd.,UK),将7 d 处理结束的幼苗第2 片真叶暗适应15 min 后进行测定,每个处理至少测量9次。
1.4.3 可溶性糖、脯氨酸、过氧化氢和丙二醛含量的测定 可溶性糖含量采用蒽酮法测定,脯氨酸含量采用磺基水杨酸法测定,丙二醛含量采用硫代巴比妥酸 (TBA)法测定,具体操作步骤参考陈刚等[14]的方法。过氧化氢含量测定采用过氧化氢含量检测试剂盒,购自索莱宝(Solarbio)试剂公司。上述指标的测定均设置3个重复。
1.4.4 抗氧化酶活性的测定 过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)等酶活性的测定,均参考陈刚等[14]的方法,使用UV-1800 紫外分光光度计测定,每个处理重复3次。
1.5 数据处理
采用Microsoft Office Excel 2010 进行数据整理,IBM SPSS Statistics 25 对所有数据进行单因素方差分析(ANOVA),显著性检验水平为P<0.05,用Origin 2018作图,数据用3个独立试验的±s。
2 结果与分析
2.1 NaHS喷施浓度与处理时间间隔筛选
如图1-A所示,与盐胁迫相比,随着NaHS浓度的增加,黄瓜幼苗干重分别增加16.64%、32.55%、15.94%和2.85%,浓度为800 μmol/L 时,幼苗全株干质量降低2.92%,幼苗生长受到抑制,200 μmol/L NaHS 处理显著高于其他浓度处理,表明200 μmol/L NaHS 缓解NaCl 胁迫诱导的生长抑制的效果最好。如图1-B所示,与T0相比,T1、T2与T3对盐胁迫下黄瓜幼苗生长抑制均有缓解作用,干质量分别显著增加11.47%、23.33%和11.61%,T2处理显著高于T1、T3,缓解效果最好,表明NaHS 持续处理会使细胞内H2S 过多积累而不利于植株生长。故后期试验处理采用200 μmol/L NaHS隔天喷施的处理方式。
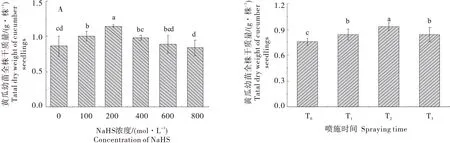
图1 度不同NaHS浓度及不同处理间隔对盐胁迫下黄瓜幼苗干重的影响Figure 1 Effects of different NaHS concentrations and treatment intervals on dry weight of cucumber seedlings under salt stress
2.2 H2S对盐胁迫下黄瓜幼苗生长的影响
在50 mmol/L NaCl 胁 迫 下,NaHS 与PAG 处理7 d,观察黄瓜幼苗形态,测定其地上部与地下部干质量(图2)。与CK 相比,NaCl 处理下黄瓜幼苗的生长出现明显的抑制效果(图2-A),地上干质量和地下干质量分别降低了24.78%和46.90%。与NaCl 处理相比,NaHS 处理缓解了NaCl 对黄瓜幼苗生长的抑制,地上干质量和地下干质量均显著增加29.12%和48.52%;PAG 处理加重了盐胁迫下的生长抑制,分别降低10.36% 和12.09%(图2-B~C)。
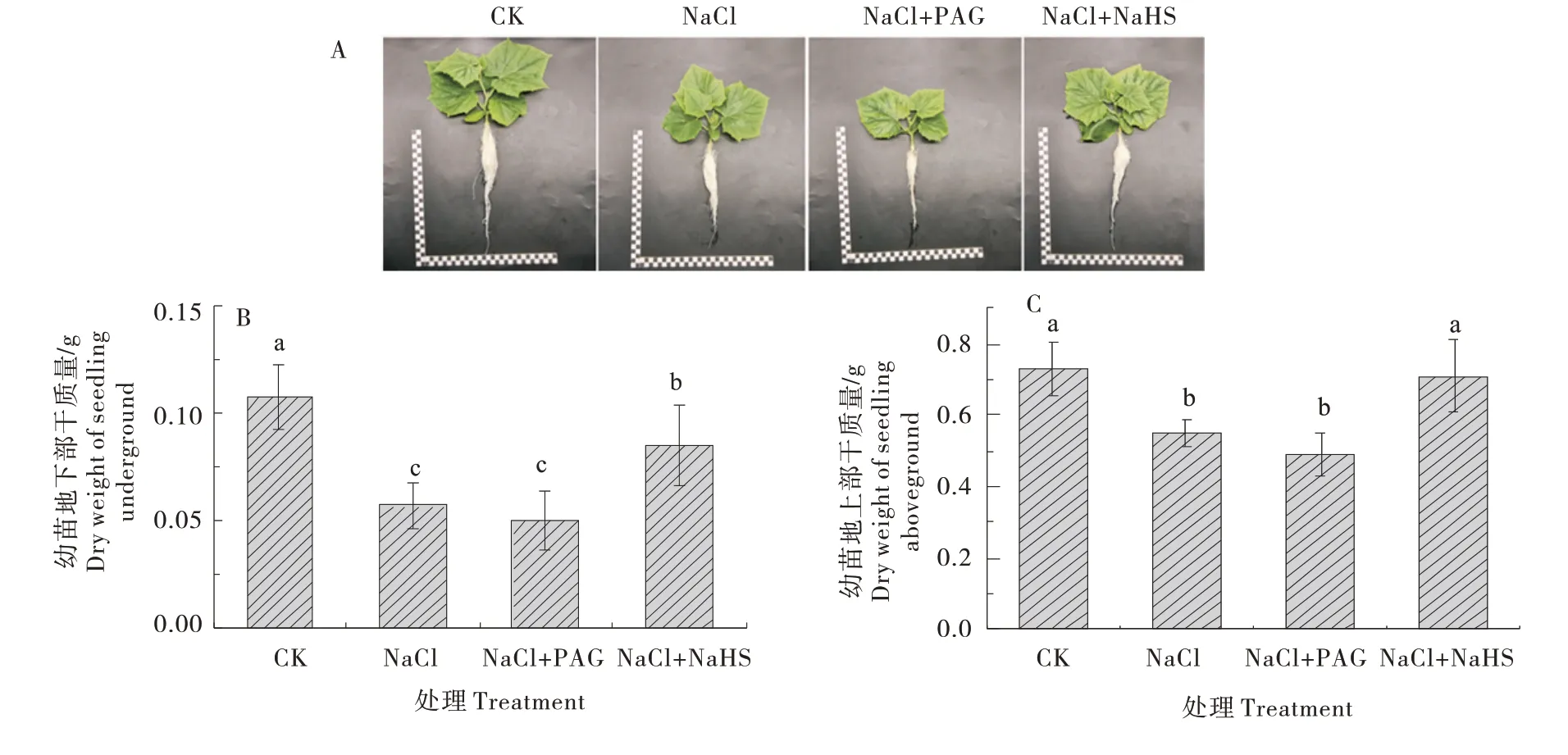
图2 H2S对盐胁迫下黄瓜幼苗生长的影响Figure 2 Effects of H2S on cucumber seedling growth under salt stress
2.3 H2S 对盐胁迫下黄瓜幼苗叶片光合色素含量的影响
与CK相比,NaCl胁迫使黄瓜幼苗叶片叶绿素 a(图3-A)、叶绿素 b(图3-B)和总叶绿素(图3-C)含量均显著降低,分别降低11.86%、6.38%和5.47%;NaCl+NaHS 处理减少了NaCl 诱导的黄瓜幼苗叶片各叶绿素组分含量的降低,与NaCl 处理相比,分别增加1.95%、2.69%和2.15%;NaCl+PAG 处理则加重了NaCl胁迫下叶绿素a和叶绿素b含量的降低。如图3-D所示,与CK相比,NaCl处理导致黄瓜叶片类胡萝卜素含量显著降低17.54%,NaCl+NaHS 处理下,叶片类胡萝卜素含量显著增加47.8%;而PAG 处理的黄瓜叶片类胡萝卜素含量降低到CK处理的1/5左右。
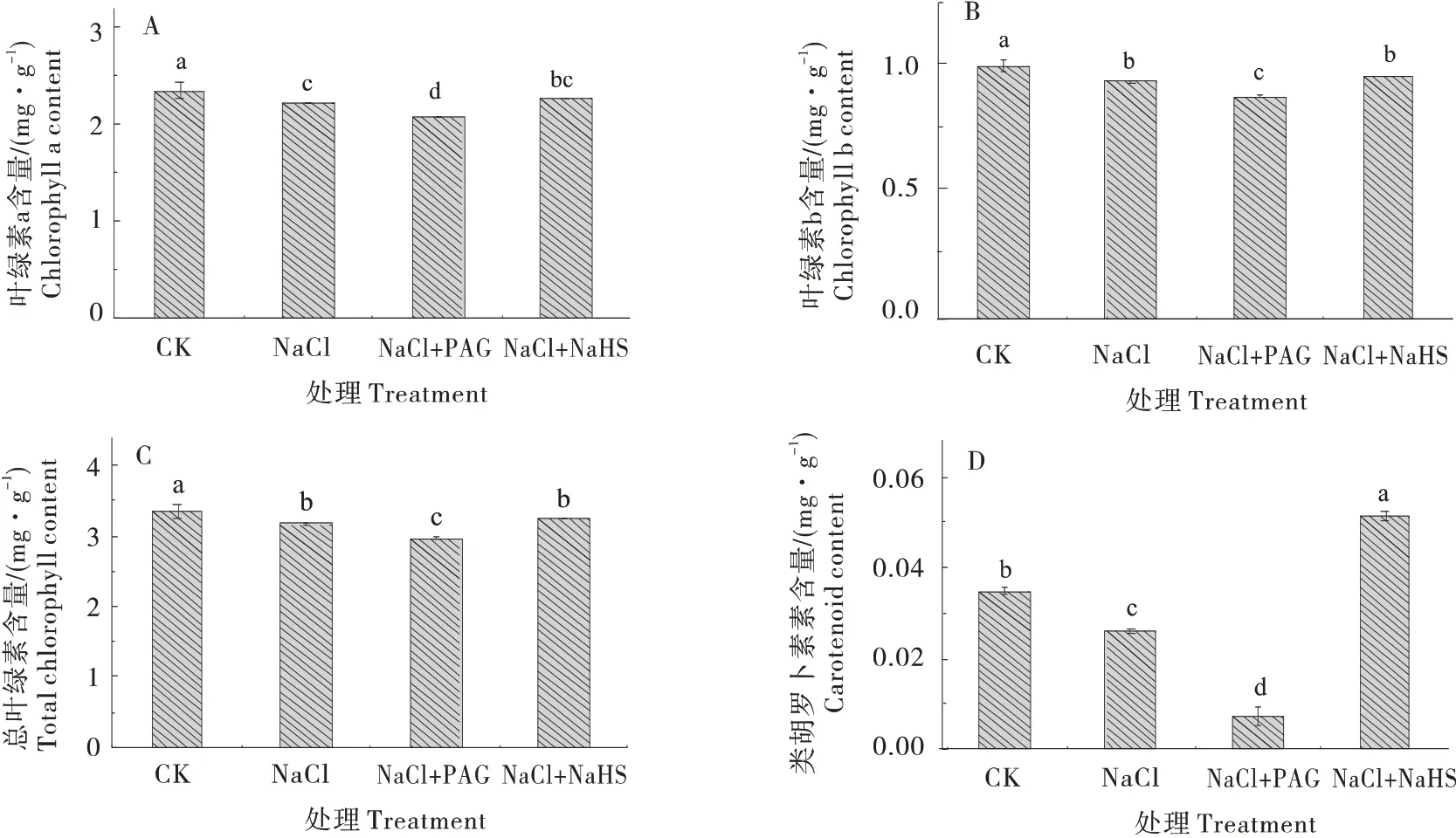
图3 H2S对盐胁迫下黄瓜幼苗光合色素含量的影响Figure 3 Effect of H2S on photosynthetic pigment content of cucumber seedlings under salt stress
2.4 H2S 对盐胁迫下黄瓜幼苗叶片叶绿素荧光参数Fv/Fm的影响
由图4 可知,盐胁迫处理的黄瓜幼苗Fv/Fm(PSII 最大光化学效率)比值显著降低,而H2S 供体NaHS喷施处理使黄瓜幼苗在盐胁迫下PSII维持较高的量子效率。此外,NaCl+PAG处理下,Fv/Fm比值较NaCl处理有所降低,但不显著。
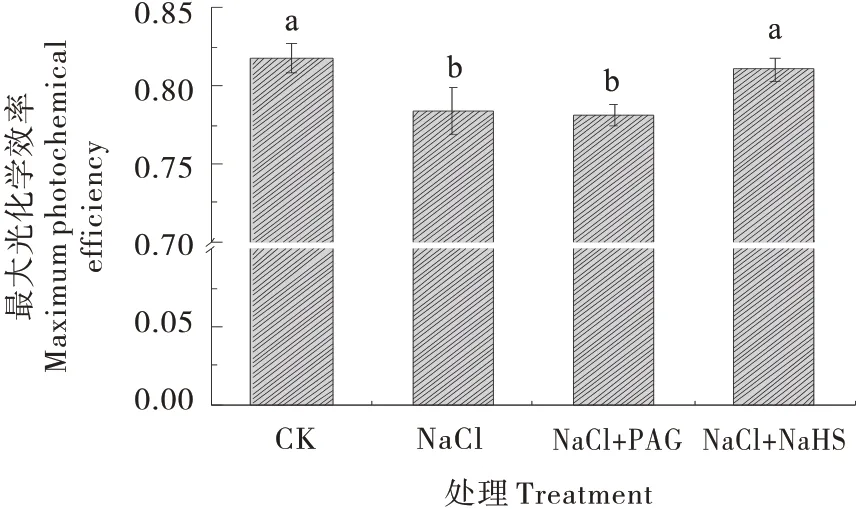
图4 H2S对盐胁迫下黄瓜叶片Fv/Fm的影响Figure 4 Effects of H2S on Fv/Fm of cucumber leaves under salt stress
2.5 H2S 对盐胁迫下黄瓜幼苗渗调物质含量的影响
由图5可知,与CK 相比,NaCl处理下黄瓜叶片中可溶性糖和脯氨酸的含量显著提高,分别提高2.94 倍和50.74%。与NaCl 处理相比,NaCl+PAG处理降低可溶性糖含量和脯氨酸的含量的积累,分别降低29.89%和19.92%,NaCl+NaHS 处理则较NaCl 处理显著提高,分别升高53.99%和22.21%。说明H2S 促进黄瓜幼苗可溶性糖与脯氨酸的积累,提高耐盐性。
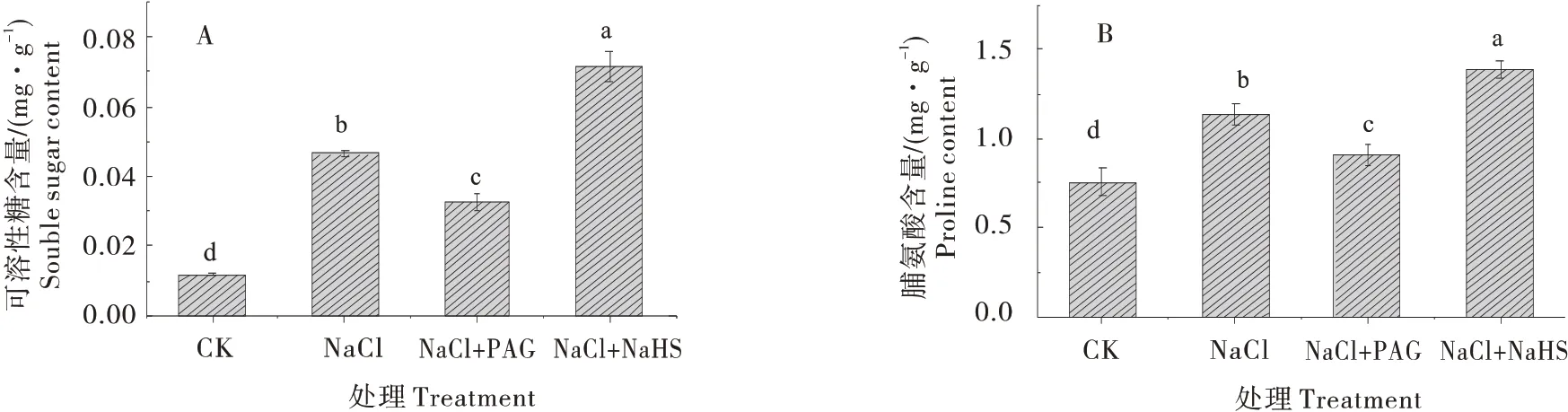
图5 H2S对盐胁迫下黄瓜幼苗渗透调节物质含量的影响Figure 5 Effects of H2S on osmotic substances in cucumber seedlings under salt stress
2.6 H2S 对盐胁迫下黄瓜幼苗丙二醛与过氧化氢含量的影响
如图6所示,与CK 相比,NaCl处理下黄瓜幼苗叶片H2O2增加 2.98 倍,MDA 含量增加29.89%,NaCl+NaHS 处理的黄瓜幼苗叶片H2O2含量和MDA 含量较NaCl 处理显著降低了37.79% 和24.27%;而NaCl+PAG处理下,黄瓜幼苗叶片H2O2含量和MDA含量较NaCl升高14.59%和9.65%。
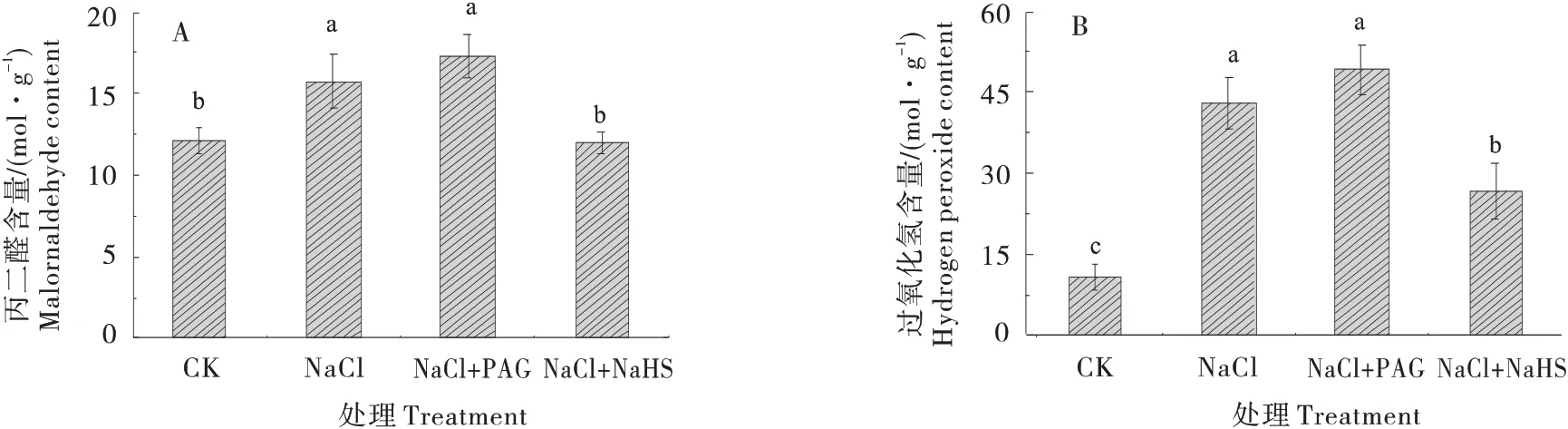
图6 H2S对盐胁迫下黄瓜幼苗丙二醛与过氧化氢含量的影响Figure 6 Effect of H2S on malondialdehyde and hydrogen peroxide contents in cucumber seedlings under salt stress
2.7 H2S 对盐胁迫下黄瓜幼苗抗氧化酶活性的影响
为进一步阐明NaHS在缓解盐胁迫下黄瓜幼苗氧化应激中的作用,测定了不同处理下黄瓜幼苗叶片抗氧化酶的活性,如图7,与CK相比,NaCl处理显著增加了叶片中POD、CAT、SOD 和APX 的活性,分别增加了66.16%、7.14%、212.50%和73.03%。NaHS 的施用逆转了NaCl处理引起的酶活变化,较NaCl 处理分别降低了43.95%、2.13%、20.80%和32.68%,使其接近CK水平。而NaCl+PAG处理下活性POD、CAT 和APX 较NaCl 处理显著升高,SOD略有降低,但不显著。
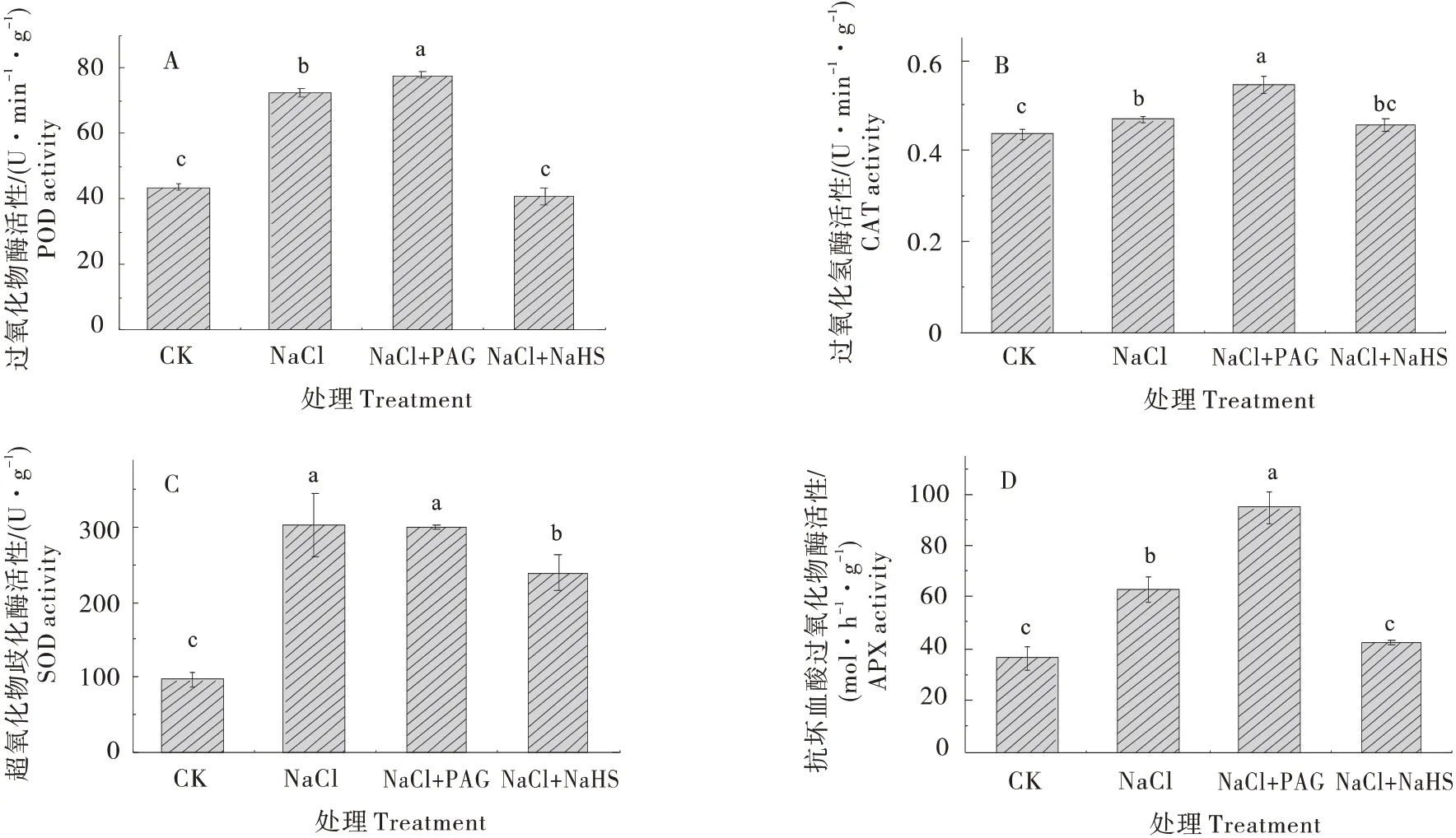
图7 H2S对盐胁迫下黄瓜幼苗抗氧化酶活性的影响Figure 7 Effects of H2S on antioxidant enzyme activities of cucumber seedlings under salt stress
3 讨论
大量研究表明,H2S 参与植物对多种胁迫的适应反应,在促进植物对环境胁迫的耐受性和减轻其对植物的有害影响方面发挥着重要作用[15-16],包括缓解重金属离子对植物的毒害[17-18]、提高植物抗旱能力[19]、增强植物的耐热性[20]等。此外,H2S对提高植物的耐盐性方面有重要的作用,研究表明H2S 通过维持矿物质稳态和氧化代谢调节水稻的耐盐性[21],维持拟南芥较低的Na+/K+比值以抵御盐胁迫[22]。
当植物遭受胁迫时,植物细胞内会产生过量活性氧对植物细胞造成氧化损伤,损坏叶绿体结构,抑制叶绿素合成,而叶绿素含量与Fv/Fm密切相关[23]。植物叶片暗适应下Fv/Fm被认为是反映胁迫下植株光抑制的良好指标[24]。H2S作为一种重要的内源气体信号分子,在促进叶绿体的生物合成方面表现出重要作用[25]。研究表明,H2S 缓解了NaCl胁迫下黄瓜幼苗光合特性和叶绿素荧光的降低,改善NaCl诱导的生长抑制[10]。本试验发现H2S显著缓解盐胁迫下叶绿素含量的降低,促进了叶绿素的生物合成,同时,H2S可以使黄瓜叶片在盐胁迫下可以维持较高的PSII最大光化学效率Fv/Fm。这与Chen等[25]的研究结果一致。类胡萝卜素在光合作用中与叶绿素共同参与光合成与光保护,可清除过剩光能防止光氧化损伤[26]。在非光合器官中,类胡萝卜素充当光抗氧化剂,光保护剂以及脱落酸、胡萝卜内酯等植物激素的合成前体,可提高植物抗逆性,调节植物生长[27-28]。本试验发现,NaCl 胁迫显著抑制了叶片类胡萝卜素的积累,PAG处理加重了抑制效果,NaHS处理则有助于叶片类胡萝卜素的积累,但具体调控机制还有待进一步研究。
植物在逆境下,通过渗透调节增加胞内溶质浓度降低渗透势,从而保持细胞吸水能力,维持正常代谢活动[29]。研究表明H2S 可诱导内源脯氨酸积累,提高玉米的耐热性[30]。此外,H2S 提高香蕉果实脯氨酸含量,从而抵御冷害[31]。本试验结果表明,黄瓜幼苗在盐胁迫下自身积累渗透调节物质以维持渗透压,缓解渗透胁迫。H2S增强黄瓜幼苗渗透调节物质的积累,相反,内源抑制H2S合成则阻碍了黄瓜幼苗渗调物质的积累。此结果表明,H2S参与黄瓜幼苗渗透调节物质的产生与积累,说明外源H2S 可在黄瓜幼苗自身响应盐胁迫的基础上进一步增强黄瓜叶片中可溶性糖和脯氨酸的产生,以增强黄瓜幼苗的耐盐性[32]。这与刘建新等[33]和王红艳等[34]的研究结果一致。
MDA和H2O2均被认为是反映植物细胞氧化应激的指标。研究表明;外源H2S可降低活性氧积累,减少氧化应激,增强棉花幼苗耐盐性[34]。H2S 通过调节抗氧化系统,降低活性氧与MDA 的积累,从而减轻了NaCl 诱导的黄瓜幼苗氧化应激反应[10]。本试验结果表明,NaHS 的外源加入,降低了黄瓜幼苗叶片MDA 和H2O2的积累,缓解了盐胁迫下氧化应激。这与前人的研究结果一致。PAG的加入,使得H2O2和MDA 含量增加,表明了内源H2S 在盐胁迫下减少黄瓜幼苗过量活性氧产生与防止脂质过氧化方面发挥了作用。
抗氧化酶作为植物体抗氧化物质的重要组分,对于外源添加NaHS 后的处于各类胁迫中的植物,其细胞内抗氧化酶活性大多都会有明显的提升。外源NaHS 提高了硝酸盐胁迫下黄瓜幼苗抗氧化酶SOD、 CAT、POD 和APX 的活性[35],增强了抗氧化酶的活性以缓解盐胁迫诱导的黄瓜下胚轴和胚根的氧化损伤[36]。同样,NaHS处理提高镉胁迫下紫花苜蓿抗氧化酶的活性[37],说明H2S 可激活植物抗氧化酶活性以应对外界胁迫。但由于植物体内还存在各种抗氧化系统及抗氧化剂,若其可以充分消除细胞内积累的过量活性氧时,植物为高效利用能量则不再启用酶活[38],例如,H2S 减少镉诱导的青稞叶片MDA 和H2O2含量的增加,且减少镉胁迫下的抗氧化酶活性的升高[38]。本试验发现外源H2S使盐胁迫下黄瓜幼苗抗氧化酶活性降低,同时H2O2与MDA含量降低,这与Jiang 等[10]和赵艳等[38]的结果类似。导致这一结果主要原因可能取决于胁迫的严重程度,极端的胁迫会抑制抗氧化酶的活性,植物会增强各种抗氧化系统与促进抗氧化剂的产生来全力保护植物[39],而处于中度或轻度的胁迫下,植物可以自行激活抗氧化酶系统,酶活性得到增强,此时加入外源保护物质,可通过增强其他保护系统,会出现抗氧化酶活性较单独胁迫降低的情况[40]。
4 结论
本试验筛选了50 mmol/L NaCl 胁迫下黄瓜幼苗最适宜的NaHS浓度为200 μmol/L以及叶面喷施时间间隔为2 d,证实了H2S对黄瓜幼苗耐盐性的调控作用。H2S 通过调控黄瓜幼苗抗氧化系统,减少H2O2和MDA的积累,增加叶绿素、类胡萝卜素和渗透调节物质的含量,维持PSII最大光化学效率,从而减少盐胁迫对黄瓜幼苗的损伤。

