甘肃部分地区动物源肠球菌的分离鉴定及耐药性研究
白亚彤,阚威,刘沛,杨孝朴
(1. 甘肃农业大学动物医学院,甘肃 兰州 730070;2. 青海省动物疫病预防控制中心,青海 西宁 810000;3. 临洮县八里铺镇畜牧兽医站,甘肃 临洮 730519)
肠球菌是一种革兰氏阳性菌,广泛存在于土壤、水源及人和动物消化道等多种环境中,属内共46个种,常见的有粪肠球菌(Enterococcus faecalis)、屎肠球菌(Enterococcus faecium)、鸟肠球菌(Enterococ⁃cus aveum)和铅黄肠球菌(Enterococcus casselifla⁃vus)等[1]。肠球菌曾被认为是对人和动物无害的肠道共栖菌,具有生长速度快、抗逆性(耐酸碱、高温和高盐等)和粘附力强,容易在消化道迅速定植形成优势菌群,并且能产生乳酸、细菌素、类细菌素和过氧化氢等活性物质抑制有害菌的增殖,调节肠道微生态平衡,促进畜禽生长等优点,而被广泛用作微生态制剂[2]。但越来越多的研究表明肠球菌是条件性致病菌,可在机体受到创伤、免疫力低下或大量使用抗生素导致菌群失调后引起感染发病[3],导致人尿路感染、心内膜炎、腹腔感染、败血症、脑膜炎甚至死亡,引起的院内感染率仅次于葡萄球菌[3];感染动物会造成禽败血症、犊牛腹泻、仔猪关节炎和羔羊脑炎等疾病[4]。近年来,随着肠球菌引起的感染率不断上升,加之其强大的天然耐药和获得性耐药,肠球菌已对很多临床常见抗生素如头孢菌素、克林霉素、磺胺类、氨基糖苷类和部分β-内酰胺类等产生耐药性,且多重耐药现象严重[5],致使其引起感染的治疗要比其他病原菌更加困难。
万古霉素被称作治疗多重耐药菌感染的“最后一道防线”,一般被列为“三级抗生素”,用来治疗对所有抗生素均无效的超级细菌感染,包括多重耐药性肠球菌和耐甲氧西林的金黄色葡萄球菌等引起的感染。万古霉素的抗菌作用方式是通过结合到革兰氏阳性菌的非交联脂质Ⅱ的末端D-Ala-D-Ala 部分,阻碍了青霉素结合蛋白(PBPs)将脂质Ⅱ交联成为成熟肽聚糖,从而干扰肽聚糖层的成熟,破坏细胞膜的完整性,导致细胞渗透压的改变和菌体破裂,使细菌死亡[6]。近年来,由于抗生素的滥用,已出现了对万古霉素耐药的肠球菌(vancomycin resistanceEnterococcus,VRE)[7],由于VRE几乎都是多重耐药菌,不仅感染后死亡率高,治疗困难,还能通过质粒、噬菌体或转座子等水平转移元件将耐药基因传递给金黄色葡萄球菌和链球菌等很多病原菌[5,8]。
鉴于肠球菌作为一种条件性致病菌,不仅多重耐药现象严重,还充当耐药基因转移的供体菌,对我国养殖业和公共卫生安全带来巨大威胁。本研究在甘肃不同地区采集了300份牛、羊和猪粪便样品,调查了肠球菌的分布特点和耐药情况,并对万古霉素耐药基因的传播风险进行了评估,希望能为甘肃省动物肠球菌病的防治及抗生素的合理使用提供一定的理论依据与数据支持。
1 材料与方法
1.1 材料
1.1.1 主要仪器 超净工作台(SW-CJ-2ED,苏净),高压灭菌锅(LDZX4011,上海申安),恒温培养箱(DNP-9162,上海精宏),普通 PCR 扩增仪(C1000,Bio-Rad),凝胶成像系统(Gel Doc XR,Bio-Rad),多用途电泳仪(DYY-7C,北京六一)。
1.1.2 主要试剂 叠氮钠-结晶紫-七叶苷培养基和THB(Todd Hewitt broth)培养基均购自青岛海博生物技术有限公司,细菌基因组DNA提取试剂盒购自天根生化科技有限公司);12种抗生素的药敏纸片购自杭州滨和微生物试剂有限公司,包括苯唑西林(1 μg/片)、青霉素(10 μg/片)、红霉素(15 μg/片)、大观霉素(100 μg/片)、氟苯尼考 (30 μg/片)、万古霉素 (30 μg/片)、克 林 霉 素(2 μg/片)、四 环 素(30 μg/片)、米 诺 环 素(30 μg/片)、环 丙 沙 星(5 μg/片)、复 方 新 诺 明(23.75 μg/片,SMZ+1.25 μg/片TMP)和庆大霉素(10 μg/片)。
1.1.3 试验样品 自2020 年10 月至2021 年6 月,从甘肃省6个地区的养殖场采集猪、牛和羊肛门拭子共300份,样品详情见表1。
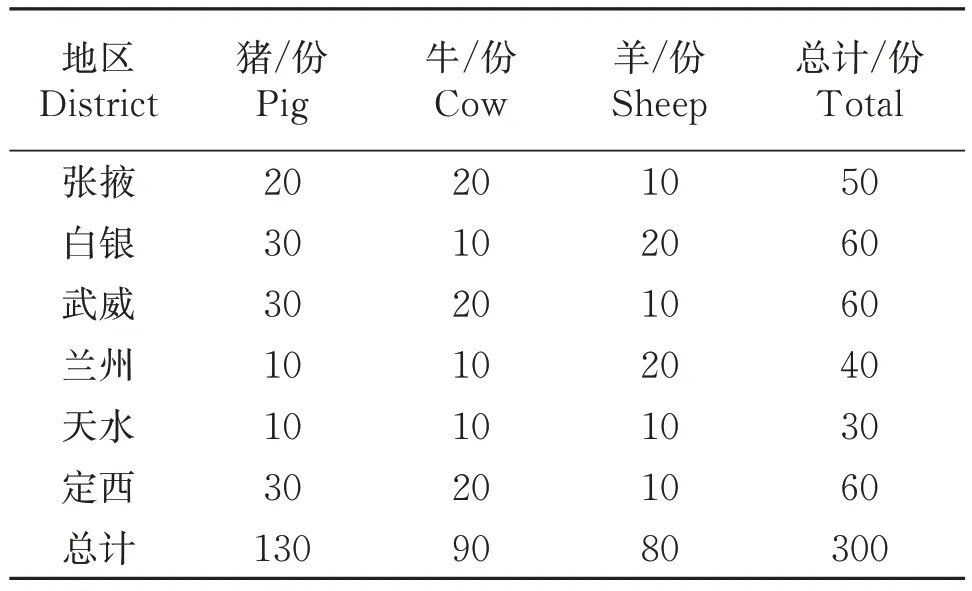
表1 样品统计Table 1 The statistics of sample
1.2 方法
1.2.1 肠球菌的分离鉴定 将采集的样品划线接种在叠氮钠-结晶紫-七叶苷平板上,于恒温培养箱中37 ℃培养18~24 h,挑选棕褐色光滑的圆形菌落,进行革兰氏染色镜检,镜检结果为单个或成双存在的革兰氏阳性球菌作为初筛菌株;初筛菌株在THB平板上划线纯化3次,再转接在THB液体培养基中,在恒温摇床中37 ℃、180 r/min过夜培养。
用细菌基因组DNA 提取试剂盒提取已纯化的肠球菌的基因组DNA,用细菌16S rDNA 序列的通用引物27F/1492R(F:AGAGTTTGATCCTGGC TCAG;R:CTACGGCTACCTTGTTACGA)进行PCR扩增;扩增条件为:95 ℃预变性5 min,94 ℃变形45 s,58 ℃退火45 s,72 ℃延伸2 min,30循环,72 ℃延伸10 min;扩增产物用1.5%琼脂糖凝胶进行电泳检测,符合预期的扩增产物送至擎科(西安)生物科技有限公司进行测序,测序结果在NCBI 网站上进行BLAST比对以确定菌株的种属。
1.2.2 耐药性检测 按照美国临床实验室标准委员会(CLSI 2018)的推荐标准,采用纸片扩散法(KB 法)进行12 种抗生素的药敏试验,具体操作如下:取100 μL菌液接种于10 mL的THB液体培养基中,在恒温摇床中于37 ℃、180 r/min培养至菌液浓度达到0.5个麦氏比浊度;用无菌棉签沾取菌液均匀涂布于THB平板,室温干燥5 min,无菌镊子夹取药敏纸片轻轻粘贴于平板上,纸片距培养皿边缘的距离不少于15 mm,两纸片中心距离不少于24 mm,将贴好药敏纸片的平板置于恒温培养箱,37 ℃培养16~18 h,试验平行重复3次,次日测量记录抑菌圈直径,取3 次测量的平均值,结果根据参考标准判定为耐药、中介或敏感;受试菌株对3种以上抗生素耐药定为多重耐药菌。
1.2.3 万古霉素最小抑菌浓度(MIC)测定 采用微量肉汤稀释法测定万古霉素的MIC,具体操作如下:将万古霉素用THB 液体培养基稀释成11 个浓度,分 别 为256、128、64、32、16、8、4、2、1、0.5、0.25 µg/mL,依次加入到96 孔聚苯乙烯细胞培养板,每孔100 μL;用THB 液体培养基将待测菌液浓度稀释至1.0×105CFU/mL,在上述各孔中加入5 μL;并设置阴性和阳性对照孔,阴性对照孔中加入等量THB液体培养基,阳性对照孔中加入5 μL稀释菌液和100 μL的THB液体培养基;将细胞培养板放入恒温培养箱37 ℃培养18~24 h,以金黄色葡萄球菌ATCC25923 作为质控菌株,试验平行重复3 次;次日用酶标仪测得各孔培养液OD600值,确定测试菌株的万古霉素MIC。
1.2.4 万古霉素耐药基因检测 万古霉素耐药基因的引物序列(表2)参照文献[9],由上海生工生物工程有限公司合成,以提取的肠球菌基因组为模板,进行PCR 扩增;扩增条件为:95 ℃预变性5 min,94 ℃变形45 s,Tm退火45 s,2 ℃延伸2 min,35 个循环,72 ℃再延伸10 min;扩增产物用1.5%琼脂糖凝胶进行电泳检测。

表2 万古霉素耐药基因引物Table 2 The primer of vancomycin resistance genes
1.3 数据统计与分析
试验数据用SPSS 25.0 软件进行统计分析,卡方检验进行差异性分析(若频数T<5 或样本数n<40,则用Fisher’s检验),显著性水平α=0.05。
2 结果与分析
2.1 肠球菌的分离鉴定结果
300 份粪样中共分离出肠球菌246 株,其中猪、牛和羊源肠球菌分别为125、76 和45 株,分离率为96.15%、84.44%和56.25%;肠球菌包括粪肠球菌、海氏肠球菌、鹑鸡肠球菌、铅黄肠球菌、屎肠球菌、坚韧肠球菌和蒙氏肠球菌,分离率为30.49%、25.61%、14.63%、10.98%、9.76%、7.32%和1.22%;猪、牛和羊源肠球菌中分离率最高的分别是海氏肠球菌(29.6%)、粪肠球菌(33.33%)和海氏肠球菌(33.33%),蒙氏肠球菌仅在牛粪样中分离出(图1)。
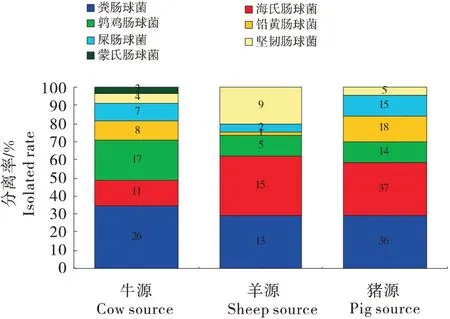
图1 不同动物源性肠球菌的分离情况Figure 1 The number of isolates of Enterococcus from different animal
2.2 肠球菌的耐药情况
肠球菌的整体耐药率如图2所示:耐药率最高的3 种抗生素分别是苯唑西林、复方新诺明和克林霉素,耐药率最低的3种抗生素是万古霉素、庆大霉素和青霉素G;此外,多重耐药性菌占比82.11%。

图2 肠球菌耐药率Figure 2 The antibiotic resistance rate of Enterococcus
不同动物源肠球菌的耐药特点见表3。猪、牛和羊源肠球菌分别对8种、3种和1种抗生素的耐药率超过50%;多重耐药菌在猪、牛和羊源肠球菌中占比为94.4%、73.68%和62.22%;除庆大霉素外,牛、羊和猪源肠球菌对其他11种抗生素的耐药性差异显著(P<0.05)。
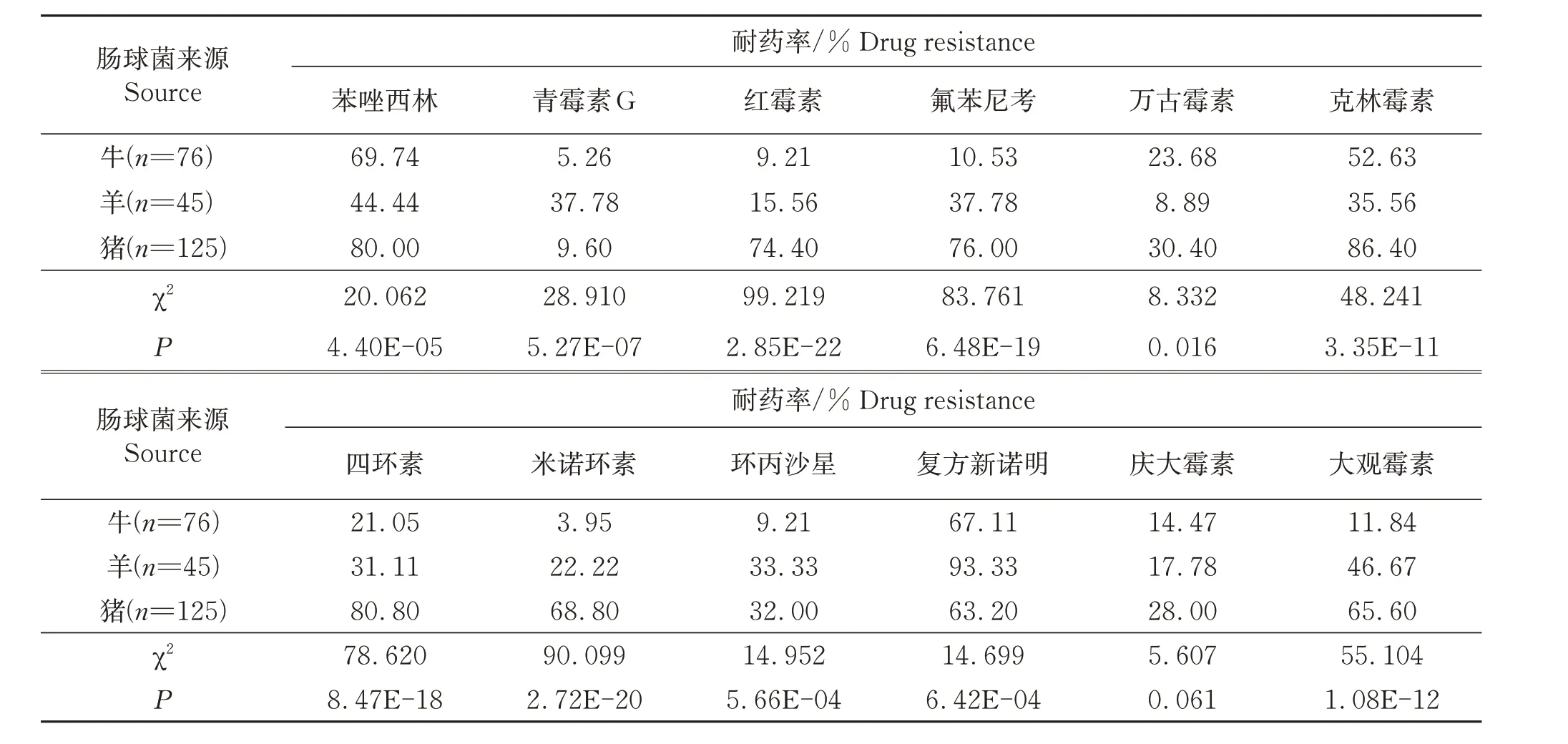
表3 不同动物源性肠球菌的耐药性比较Table 3 The comparison of drug resistance of Enterococcus from different animal
不同肠球菌的耐药特点见表4。粪肠球菌、海氏肠球菌、鹑鸡肠球菌、铅黄肠球菌、屎肠球菌和坚韧肠球菌分别对3种、7种、4种、2种、6种和2种抗生素的耐药率超过50%;多重耐药菌在粪肠球菌、海氏肠球菌、鹑鸡肠球菌、铅黄肠球菌、屎肠球菌和坚韧肠球菌中占比分别为90.67%、96.83%、63.88%、55.56%、100%和61.11%;除米诺环素外,6 种肠球菌对11种抗生素的耐药性差异显著(P<0.05)。
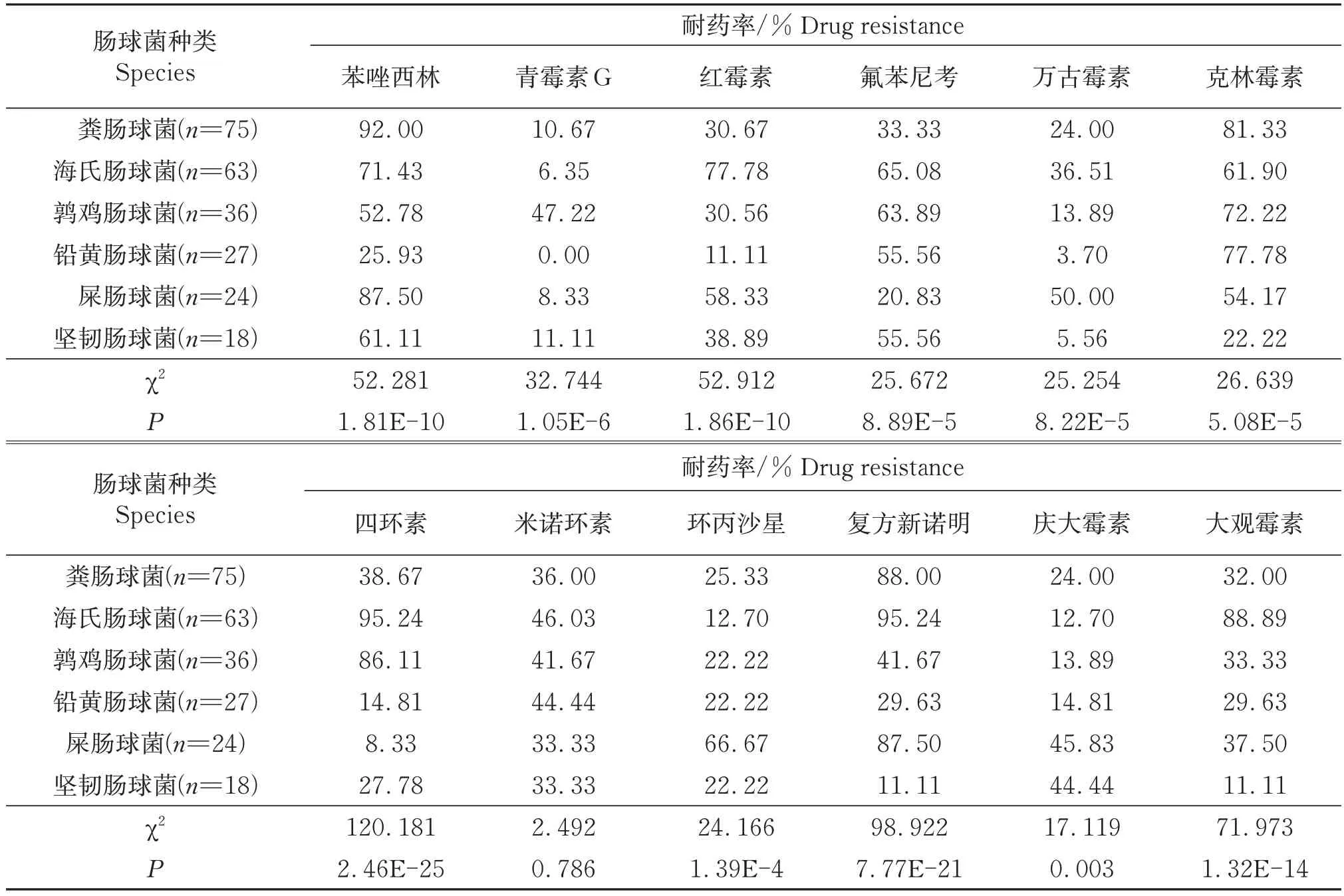
表4 不同肠球菌的耐药性比较Table 4 The comparison of drug resistance of different Enterococcus species
2.3 万古霉素的MIC测定结果
对万古霉素耐药的60 株肠球菌进行万古霉素MIC的测定发现:猪、牛和羊源肠球菌中万古霉素耐药菌占比分别为30.4%、23.68%和16.0%,MIC无明显差别,均表现为中低水平的万古霉素耐药(表5);屎肠球菌中万古霉素耐药菌占比最高(50.0%)且表现为中等水平的万古霉素耐药,其他肠球菌的万古霉素MIC无明显差别,表现为中低水平的万古霉素耐药(表6)。

表5 不同动物源性肠球菌的MICTable 5 The MIC of Enterococcus from different livestock

表6 不同肠球菌的MICTable 6 The MIC of different Enterococcus species
2.4 万古霉素耐药基因检测结果
对60 株VRE 的万古霉素耐药基因检测结果表明:VRE 携带的万古霉素耐药基因为van C1和/或van C2/3(图3);其中,13 株检测到van C1,40 株检测到van C2/3,3株同时检测到van C1和van C2/3,4 株未检测到万古霉素耐药基因;在246 株肠球菌中,van C1和van C2/3的检出率分别为6.5%和17.48%;猪源、牛源和羊源肠球菌中万古霉素耐药基因的检出率分别为30.4%、22.37%和8.89%,猪、牛和羊源肠球菌中均检测到van C2/3,而仅在猪源肠球菌中检测到van C1(图4);此外,屎肠球菌中万古霉素耐药基因的检出率最高(50.0%),除铅黄肠球菌外,其他肠球菌van C2/3的检出率最高(图5)。
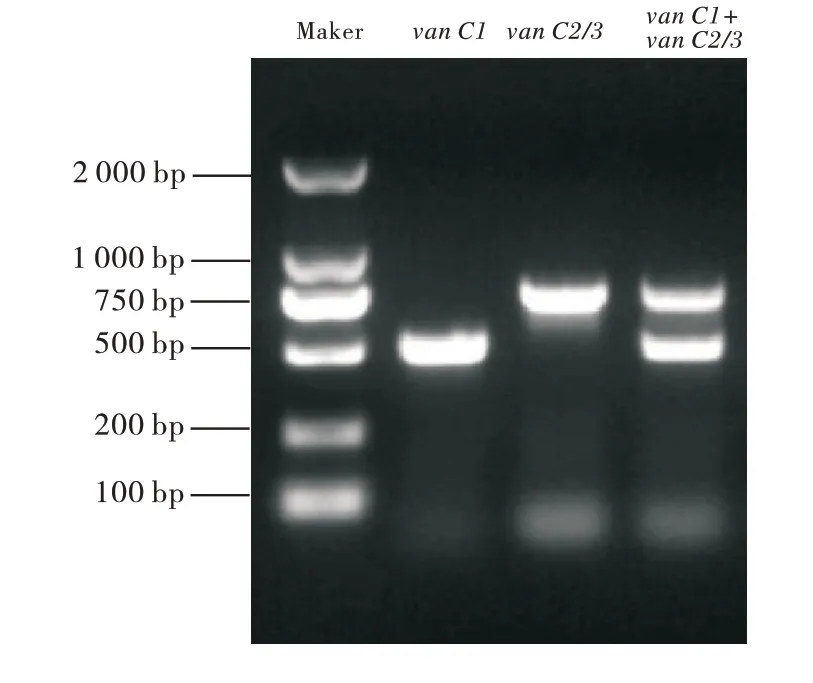
图3 肠球菌的万古霉素抗药基因扩增产物电泳图Figure 3 The electrophoretogram of van C1 and van C2/3 gene
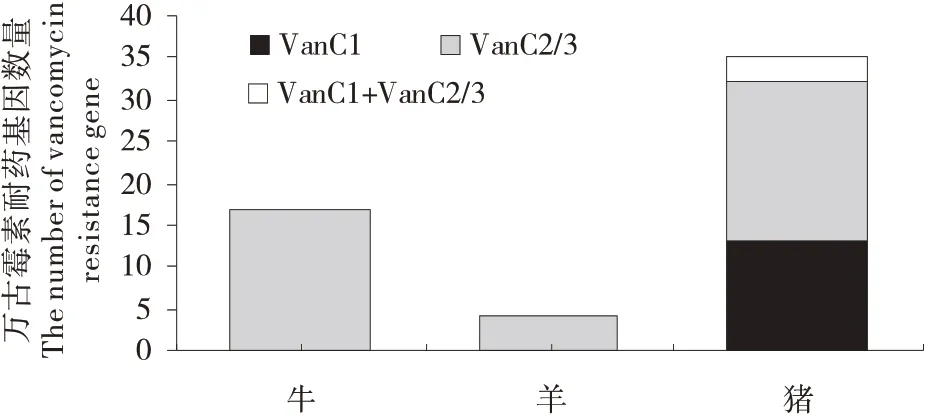
图4 不同动物源肠球菌万古霉素耐药基因数量Figure 4 The number of the vancomycin resistance gene carried by Enterococcus from different animal
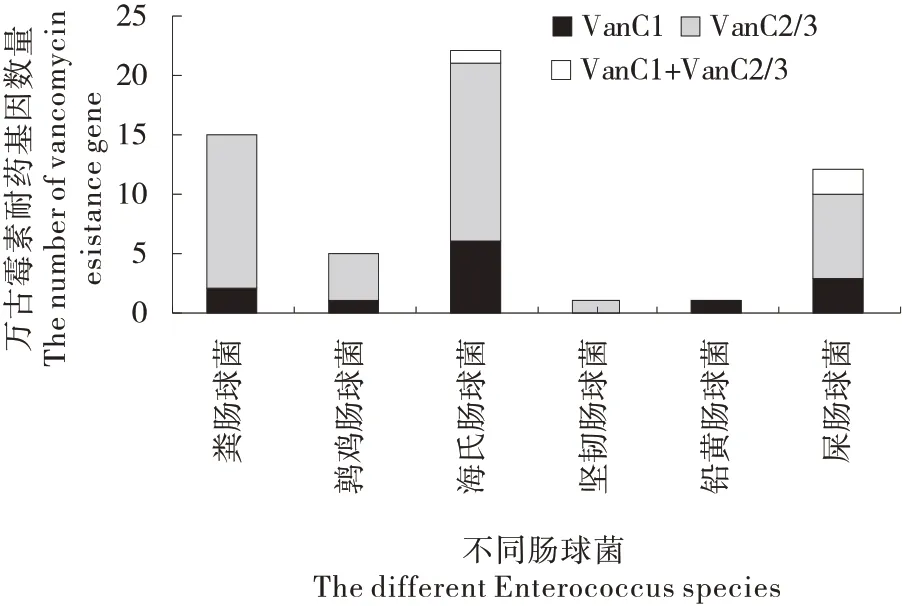
图5 不同肠球菌万古霉素抗药基因扩增结Figure 5 The number of the vancomycin resistance gene carried by different Enterococcus species
3 讨论
不同来源的样品中肠球菌的分离情况存在明显差异,如临床病料样品中分离的致病性肠球菌主要为粪肠球菌和屎肠球菌[10],而动物粪便样品分离的肠球菌则更具多样性[11-12];此外,不同地域和动物,肠球菌的分离率也不同,本研究中猪、牛和羊源粪肠球菌的分离率分别为27.7%、33.3%和16.25%,低于朱雷等[13]在河南规模化场中鸡源粪肠球菌的分离率(55.6%),低于幸文定等[14]江西的猪源性粪肠球菌的分离率(64.8%),低于高懿等[20]江苏的猪源粪肠球菌的分离率76.7%,与李岱霞[15]在湖南猪、鸡源粪肠球菌的分离率(分别为28.3%和35.8%)接近。推测造成这种差异的原因除初筛挑选菌株的随机性,还可能与采样地点、采样时间、动物种类和养殖条件等因素有关。
多重耐药性肠球菌是从70 多年前的动物源性肠球菌分化而来,与临床应用抗生素的时间一致[16],随后肠球菌的多重耐药现象日益加重。本研究发现肠球菌对苯唑西林、克林霉素、复方新诺明和大观霉素的耐药率很高,而对青霉素G、环丙沙星和庆大霉素的耐药率较低,与国内外其他研究结果一致[12,17-19];此外猪源肠球菌对红霉素、氟苯尼考、四环素和米诺环素的耐药率高于牛、羊源肠球菌,与诸多文献[11-12,18-21]研究结果一致;但本省牛源肠球菌对红霉素、四环素和庆大霉素耐药率低于宁夏地区(9.21%vs65.88%,21.05%vs65.49%,14.47%vs54.51%)[17];羊源肠球菌的耐药率与新疆地区接近[23],都比较低(四环素31.11%vs52.3%,红霉素15.54%vs33.6%,庆大霉素17.78%vs6.50%);此外,粪肠球菌、屎肠球菌和海氏肠球菌多重耐药率很高,与李鹏[12]和高懿等[20]的研究结果一致。本省猪源肠球菌的耐药性明显高于牛羊源肠球菌,主要原因是猪场集约化程度高,抗生素使用更普遍,而本地牛羊多为半放养,抗生素使用较少。
国内多地已出现万古霉素耐药的动物源肠球菌的分离报道[18,21],目前肠球菌共有9种基因型介导了对万古霉素的耐药性[25],van A和van B是最常见的,位于IS1251或转座子Tn1546上,耐药性易转移,介导高水平的万古霉素耐药(MIC=64~512 µg/mL)[26];van C1和van C2/3介导了中低水平的万古霉素耐药(MIC=2~32 µg/mL),van Cl位于染色体上的转座子和整合子等可移动区域,耐药性也可水平转移[27];本研究分离的肠球菌对万古霉素的耐药率远低于医院临床病料中分离的肠球菌[10](24.39% vs 62.30%),携带的耐药基因为van C1和van C2/3,而从医院临床病料分离的万古霉素耐药肠球菌携带van A基因[24],但VRE 在养殖动物中出现和van Cl的潜在传播风险不容忽视。
4 结论
甘肃省部分地区动物源肠球菌的耐药特点表现为耐药率高且多重耐药现象严重,VRE菌株已在养殖动物中出现,虽表现为中低水平的万古霉素耐药,但存在万古霉素耐药性转移的潜在风险。综上所述,应对动物源肠球菌的耐药性进行长期监测,并规范兽药的合理使用,以减少耐药菌株的出现和耐药性的传播。

