P38MAPK信号传导通路在大鼠缺血再灌注中对MMP-9蛋白表达的影响
陈慧慧 黄丽丽
新生儿缺氧缺血性脑病在临床上较为高发,极易引起新生儿智能发育障碍、癫痫、脑性瘫痪甚至死亡,严重危害其中枢神经系统发育和生命健康安全[1]。基质金属蛋白酶-9(matrix metalloprotein-9,MMP-9)是人体常见的一种金属蛋白酶,可对脑血管外基膜相关主要成分、降解细胞外基质成分进行攻击,进而损害血脑屏障的完整性,导致血脑屏障通透性增加,而使用P38 丝裂原活化蛋白激酶(P38 mitogen activated protein kinase,P38 MAPK)特异抑制剂可明显减轻脑组织含水量[2-3]。P38MAPK信号传导主要参与脑部缺氧缺血后的炎症反应、脑细胞的增殖与分化、氧化应激等过程。阻断P38MAPK信号在大脑缺血再灌注中的过度激活,下调MMP-9过表达,可减轻急性脑梗死脑水肿症状[4]。本研究旨在观察P38MAPK 信号传导通路在大鼠缺血再灌注中对MMP-9蛋白表达的影响,现报道如下。
1 资料与方法
1.1 动物及试剂 清洁级雄性SD大鼠90只,体质量200~250(228.17±14.22)g,购自北京动物实验研究中心,动物使用许可证号:SYXK(京)2018-0013,于本院生物研究实验中心进行实验,在自然光照、相对湿度(64%±4%)、(21±4)℃室温下进食3天。免疫组化试剂盒购自上海容晖生物科技有限公司,兔抗大鼠P38MAPK多克隆抗体、P-P38多克隆抗体及MMP-9抗体均购自上海西唐生物科技有限公司,P38特异抑制剂购自北京伊塔生物科技有限公司,ELISA试剂盒、BCA试剂盒等购自上海美迪西生物医药股份有限公司,线栓(直径:0.26 mm)购自广州佳灵生物技术有限公司。
1.2 实验方法 (1)线栓制备:线栓切为3 cm小段,于5、10、15、20 mm处进行标记,便于实验中观察;取砂布打磨线成圆头形状,置于石蜡中融化,将打磨好约5 mm长度的鱼线插入石蜡中,3 s内取出,待晾干后备用。(2)建模及分组:采用10%的水合氯醛腹腔注射麻醉后,大鼠取仰卧位,常规备皮消毒,于大鼠颈部中央位置切开,钝性游离左颈总动脉、颈内动脉、颈外动脉,结扎颈部动脉的远端分支,沿着手术线对大鼠颈内动脉的颅外分支翼进行结扎,暂时夹闭左侧颈总动脉血管,并在其颈外动脉结扎位置近端行约0.2 mm的切口,之后导入制备好的线栓;沿着颈外动脉分叉部位的动脉血管轻轻推进线栓,直至线栓抵达标注的20 mm位置,遇到阻力即停止推进;一旦线栓到达颈外动脉的起始位置,便结扎其颈外动脉近心端动脉血管,松开颈内动脉血管夹,将多余的线栓剪除,其余线栓埋于大鼠皮下;最后,缝合切口并消毒。在大鼠动脉血管阻塞2 h后抽出线栓,将动脉血管阻塞端退出至分叉处,再次形成灌注后处死大鼠,取出大鼠脑部组织。根据大鼠大脑动脉阻断的不同模型分为对照组、缺血再灌注组和P38抑制剂组,每组各30例。其中,缺血再灌注组在制备SD大鼠脑动脉缺血再灌注模型前15 min,通过舌下静脉注射二甲基亚砜(南通英瑞达生物科技有限公司)400μg/kg;P38抑制剂组在制备SD大鼠脑动脉缺血再灌注模型前15 min,舌下静脉注射P38抑制剂(上海润诺生物科技有限公司)400μg/kg;对照组,切开大鼠皮肤,游离至大鼠动脉分叉处,未做插线处理,即刻缝合切口。三组均于手术24 h处死大鼠,取出脑部组织备用。(3)大鼠脑组织含水量测定:采用干湿质量法检测各组脑动脉缺血再灌注大鼠的脑组织含水量,脑组织含水量=(脑湿重-脑干重)/脑湿重×100%[5]。(4)脑梗死体积测定:采用2,3,5-氯化三苯基四氮唑染色法,切取大鼠冠状脑片(间距2 mm),置于1% 2,3,5-氯化三苯基四氮唑磷酸盐缓冲液,避光染色30 min,之后置于多聚甲醛PBS溶液中固定保存;观察三组大鼠脑组织的染色情况,红色为正常脑组织,白色为梗死脑组织,拍照并计算脑梗死面积。(5)P38MAPK、MMP-9蛋白表达检测:采用免疫组织化学染色法,严格按照试剂盒说明要求操作,显微镜下观察细胞内P38MAPK、MMP-9蛋白的阳性表达情况。P38MAPK阳性,棕、黄褐色颗粒状;MMP-9阳性,棕黄色颗粒状;正常细胞染色为绿色[6]。
1.3 观察指标 三组大鼠的脑组织含水量、梗死体积及P38MAPK、MMP-9蛋白表达。
1.4 统计学方法 采用SPSS20.0统计软件。计数资料以[n(%)]表示,组间比较采用χ2检验;计量资料以(±s)表示,组间比较采用t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组大鼠的脑组织含水量及梗死体积比较 缺血再灌注组大鼠的脑组织含水量及梗死体积均明显高于P38抑制剂组、对照组(P<0.05),P38抑制剂组高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 三组大鼠的脑组织含水量及梗死体积比较[n=30,(±s)]

表1 三组大鼠的脑组织含水量及梗死体积比较[n=30,(±s)]
组别 脑组织含水量(%) 梗死体积(mm3)对照组 0 0缺血再灌注组 87.91±0.08 68.23±8.25 P38抑制剂组 68.59±0.13 39.69±6.30
2.2 三组大鼠的P38MAPK、MMP-9蛋白表达情况比较 缺血再灌注组大鼠的P38MAPK、MMP-9蛋白表达均明显高于P38抑制剂组、对照组,且P38抑制剂组P38MAPK、MMP-9蛋白表达高于对照组,差异有统计学意义(P<0.05)。见表2和图1-2。
表2 三组大鼠的P38MAPK、MMP-9蛋白表达情况比较[n=30,(±s)]

表2 三组大鼠的P38MAPK、MMP-9蛋白表达情况比较[n=30,(±s)]
组别 P38MAPK MMP-9对照组 2.72±0.73 18.83±5.91缺血再灌注组 10.45±2.76 59.05±6.59 P38抑制剂组 7.85±1.61 31.78±7.46
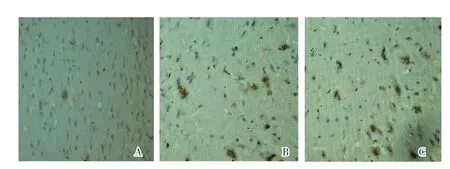
图1 缺血再灌注大鼠脑组织P38MAPK的表达(免疫组化法×400)

图2 缺血再灌注大鼠脑组织皮层区MMP-9的表达(免疫组化法×400)
3 讨论
大脑一旦发生缺氧缺血,脑部神经细胞会快速凋亡,导致神经元功能和结构出现异常,诱发缺血缺氧性脑损伤[7]。新生儿缺血缺氧性脑损伤受多种因素共同影响,会造成大脑组织后期神经系统发育障碍,甚至导致死亡[8]。临床上尚无针对缺氧缺血性脑损伤的有效干预措施,需要积极关注并预防。缺血再灌注时,通常会伴随大量黏附分子的过表达,特别是基质金属蛋白酶MMP-9的代谢产物,严重破坏脑毛细血管基底层,导致大鼠血脑屏障通透性遭到直接破坏[7-10]。脑组织中MMP-9属于明胶酶的一种类型,主要由血管内皮细胞、星形胶质细胞、海马神经元及小胶质细胞等分泌,在缺血缺氧性脑损伤病理情况下表达增高,细胞基质成分降解后极易破坏血脑屏障的完整性及通透性,引发并加重脑水肿症状[11]。P38MAPK是MAPK家族控制炎症反应最重要的成员,该信号通路会诱导大鼠血脑屏障通透性及脑含水量降低,大鼠缺血周边区脑组织MMP-9的表达明显下调[12-13]。
本研究结果显示,缺血再灌注组大鼠脑组织含水量、梗死体积均明显高于P38抑制剂组和对照组,且P38抑制剂组高于对照组,提示P38MAPK信号通路会加重SD大鼠缺血再灌注后脑水肿的发生风险,阻断P38MAPK通路能够明显降低脑动脉缺血再灌注大鼠血脑屏障破坏、创伤性脑水肿以及脑梗死体积,提高脑缺血再灌注损伤的临床疗效[14]。究其原因,发现P38MAPK参与了大鼠脑缺血再灌注后脑水肿的形成,机制可能为大鼠缺血再灌注后激活P38MAPK使缺血周边区脑组织MMP-9的表达上调,破坏血脑屏障通透性,进而导致了脑动脉缺血再灌注大鼠脑水肿症状的发生[15-16]。本研究结果显示,缺血再灌注组P38MAPK蛋白、MMP-9蛋白表达均明显高于P38抑制剂组和对照组,且P38抑制剂组P38MAPK蛋白、MMP-9蛋白表达高于对照组,说明抑制P38MAPK信号通路会明显降低脑动脉缺血再灌注大鼠P38MAPK蛋白、MMP-9蛋白水平,将因缺血再灌注所造成的血脑屏障损伤降低到最低限度,抑制缺血中心区神经元的兴奋性,通过对缺血缺氧性SD大鼠相关神经小胶质细胞的活性进行调节,缓解脑白质损伤,改善大鼠血脑屏障的通透性[17]。同时,抑制P38MAPK信号通路可对脑部黄嘌呤氧化酶、次黄嘌呤氧化酶相关活性通路进行抑制,减少脑部氧自由基含量,确保血脑屏障完整性稳定,进一步缓解脑水肿,保护大鼠脑神经细胞[18]。
综上所述,P38MAPK信号通路通过MMP-9的表达致使血脑屏障损伤,进而加重SD大鼠缺血再灌注后脑水肿的发生风险,阻断P38MAPK通路可下调大鼠创伤后MMP-9高表达,减轻血脑屏障破坏及创伤性脑水肿。

