填料塔同时吸收高浓度SO2和NO2生成亚硝酰硫酸的研究
倪凯文, 荆国华, 吴孝敏, 陈子逸
填料塔同时吸收高浓度SO2和NO2生成亚硝酰硫酸的研究
倪凯文, 荆国华, 吴孝敏, 陈子逸
(华侨大学 化工学院, 福建 厦门 361021)
为了解决染料行业生产过程中磺化和硝化产生的高浓度硫氧化物(主要为SO2)和氮氧化物(主要为NO2)废气所造成的大气污染,采用填料塔反应器同时吸收SO2和NO2,并生成亚硝酰硫酸的工艺,并对优化的工艺条件进行深入的分析。主要考察了吸收液的构成(浓硫酸和浓硝酸)与浓度、气体流速、污染物浓度和吸收时间等参数对吸收效率和体积传质系数G的影响。实验结果表明,SO2与NO2的G随着吸收液中硝酸体积分数的变化呈抛物线、随气液流速的增大而降低、随污染物浓度变化而变化、随填料物的接触面积的变小而变大。在实验中,采用填料塔同时吸收SO2(质量浓度为11 779 mg×m-3)和NO2(质量浓度为2 822 mg×m-3)的最佳工艺条件:气体流速为1.32 m×s-1,液体流速为0.55 m×s-1,硝酸体积分数为20%的浓硫酸和浓硝酸混合吸收液。
NO2;SO2;亚硝酰硫酸;填料塔;传质系数
1 前 言
工业生产过程中废气的大量排放导致大气中的污染物增加,其中硫氧化物(SO)和氮氧化物(NO)作为主要排放物,严重影响人们的健康和我们赖以生存的环境[1-2]。其中,染料的生产过程(尤其是在磺化和硝化等工序)排放了大量高浓度的SO(此处为SO2)和NO(此处为NO2)废气,是一种典型的高浓度SO和NO污染行业[3-4]。在当前越来越重视环保的大背景下,对于染料行业的政策也由原来的宽松管理转向严格管理。根据GB 16297-1996《大气污染物综合排放标准》对SO2和NO2的最高允许排放质量浓度,SO2为1 200、NO2为420 mg×m-3。高于该浓度会造成严重的肺损伤甚至死亡,因此高于该限度时可称为高浓度污染物。目前,针对高浓度的SO2和NO2排放废气,其直接处理或排放都将会造成极大的资源浪费。若采取有效措施回收,可增加经济效益,实现废物的综合利用。处理染料行业生产过程中排放的含有高浓度SO2和NO2最广泛的方法是碱液吸收法[5-6]。常用的吸收液有氢氧化钠、氢氧化钙和氨水等[7]。然而,氢氧化钙吸收SO2生成的石膏已经严重过剩;氨水吸收易与NO2反应生成气溶胶颗粒物形成二次污染,并且吸收液中的亚硝酸铵不稳定,有一定危险性[8]。基于上述碱液吸收法存在的诸多问题,近年来,一种采用浓硫酸/硝酸来吸收高浓度SO2和NO2生成具有极高应用价值的亚硝酰硫酸(或称为亚硝基硫酸)中间体成为研究的热点[9-10]。典型的处理流程是采用分级吸收的方法[11-12]。具体地,采用硫酸溶液吸收NO2废气,得到的吸收液再用于吸收SO2废气,得到亚硝酰硫酸产品。过量的NO2或SO2经过碱吸收,最终回收亚硝酸钠或者亚硫酸钠。该法虽然针对含硝尾气和含硫尾气进行吸收研究,得到的硝酸可回用,但该法采用分级吸收,吸收流程复杂冗长,经济价值不高[13-14]。如果能够开发设计一套装置同时处理SO2与NO2尾气,实现经济高效的硫硝资源化,则极具市场应用前景。此工艺不仅可以同时脱除烟气中废气SO2和NO2,而且还可以生成染料行业所需中间体亚硝酰基硫酸,实现废物的资源化利用。但同时吸收SO2和NO2并生成亚硝酰硫酸的工艺在吸收效率、动力学参数和传质性能方面还有待于深入研究[15]。
本研究采用一种新型的、经济高效的填料塔反应器同时吸收SO2和NO2并生成亚硝酰硫酸的工艺。优化硫酸/硝酸构成的吸收液体系在同时吸收SO2和NO2的工艺条件,包括吸收液的构成(浓硫酸和浓硝酸)与浓度、气体流速、污染物浓度和吸收时间对吸收效率和传质系数的影响。深入分析了该硫酸/硝酸体系吸收SO2和NO2并生成亚硝酰硫酸工艺的吸收效率、动力学参数和传质性能。最终,可为该工艺的工业化放大提供理论依据和数据支撑。
2 理论分析
2.1 浓硫酸吸收反应机理
在同时吸收SO2和NO2并生成亚硝酰硫酸的工艺中,SO2可使NO2还原成NO。因此,同时吸收SO2和NO2的过程十分复杂,存在大约40个平衡方程式,且与溶解度、温度和吸收液的构成等有较大关系,因素的改变会导致吸收效率的改变[16-17]。浓硫酸可以吸收单一组分NO2,也可同时吸收SO2和NO2。当浓硫酸吸收NO(= 1或2)时生成亚硝酰硫酸、水,其中主要方程式如下所示[18]:
NO+ NO2+ 2H2SO4→ 2NOHSO4+ H2O (1)
当浓硫酸同时吸收SO2和NO2时,直接生成2个亚硝酰硫酸:
2NO2+ SO2+ H2SO4→ 2NOHSO4(2)
2.2 混酸吸收反应机理
由于NO在硝酸中的溶解度远比水大。表1为25 ℃时,NO在硝酸中的溶解系数和硝酸体积分数的关系[7]。由表可知,随着硝酸体积分数的增加,溶解系数也随之增大。因此,吸收液中添加浓硝酸构成的混合吸收体系,使大量的NO溶解于吸收液中,吸收反应比硫酸体系更加迅速彻底。这就使得硫酸和硝酸的混酸体系,同时吸收SO2和NO2反应生成亚硝酰硫酸,成为更有吸引力的一个方向。而且吸收液中添加硝酸后,吸收的反应方程式也发生了变化。硫酸和硝酸同时与SO2和NO2反应生成亚硝酰硫酸。反应方程式如(2)、(3)所示:

表1 NO在不同浓度硝酸中的溶解度
is the volume of NO dissolved per cubic meter of HNO3
SO2+ HNO3→ SO3+ HNO2→ NOHSO4(3)
SO2将硝酸还原成亚硝酸后与氧化后的SO3生成亚硝基硫酸,同时SO2和NO2直接与硫酸生成2个亚硝基硫酸产物。对比以单一的硫酸为吸收液,混酸的吸收效率会更高。
2.3 吸收率的计算
SO和NO的吸收率可以表示为
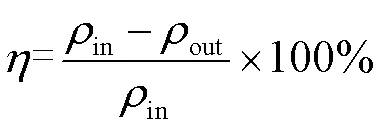
式中:in和out分别为填料塔进出口中SO和NO的质量浓度(mg×m-3)。
3 实验部分
3.1 实验装置
实验装置如图1所示,其子系统由填料塔反应系统、储存系统、物料输送系统和尾气检测系统4部分组成。其中,填料塔主体设备由内径为100 mm的316L材质不锈钢圆筒组成,内部填充料为陶瓷拉西环(6 mm×6 mm×1.6 mm)。在填料塔下部有一个5 L的储存釜用于储存吸收液,二者通过连接管连通。储存釜底部开有单独进出料口,容器外侧设置一个视窗,用于判断容器内物料的高度和形态。实验设有冷凝器用以保证吸收过程中的温度始终保持70 ℃以下。酸吸收液由蠕动泵加压,从储存釜中经流量计输送至填料塔上部喷淋进入塔顶,最后由塔底流出进入储存釜完成吸收液的循环。模拟烟气由N2、SO2(体积分数为5%)和NO2(体积分数为1%)组成。气体从填料塔底部进入,与来自自上而下的喷淋吸收液接触反应,达到同时脱硫脱硝的目的并实现废物的资源化利用。吸收后的气体进入尾气检测处理系统,利用碱液对尾气中残存污染物进行处理以达标排放,同时检测气体中的污染物组成和浓度。
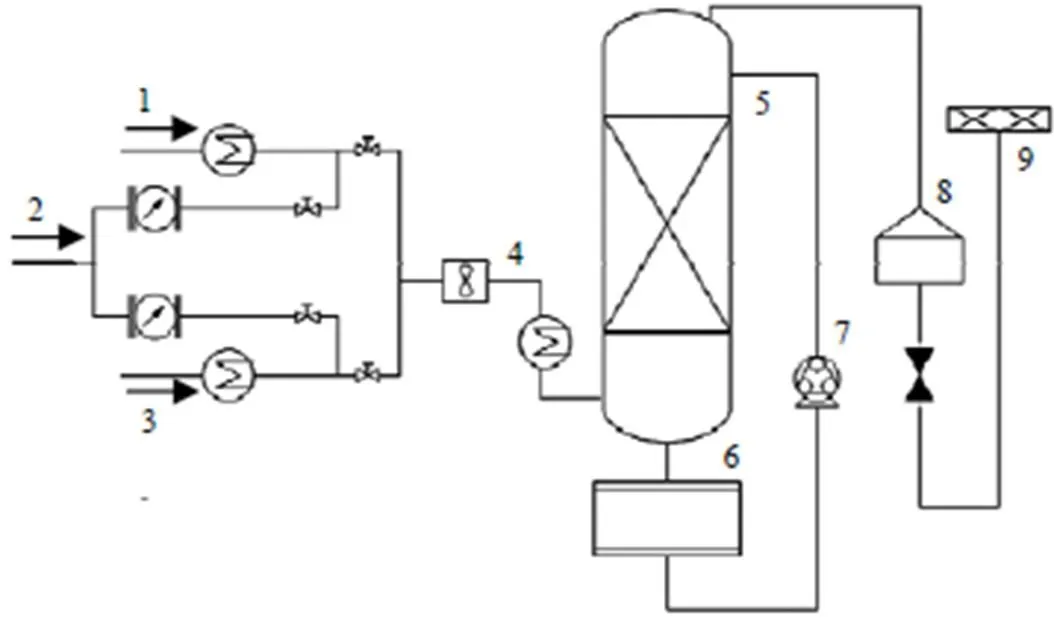
图1 实验反应器装置图
1. SO22. N23. NO24. condenser 5. packed column 6. storage tank 7. peristaltic pump 8. testo-350 9. exhaust gas absorption device
3.2 实验方法
实验中,模拟烟气(N2,NO2,SO2)通过流量计从喷淋塔下部进入腔体内,待检测系统显示烟气中NO2、SO2示数稳定后,再将吸收液由填料塔塔顶喷淋而出与气体逆流接触后循环吸收。经过吸收液吸收后的尾气通入检测系统(testo350,测量分辨度在1´10-6,精度为±5´10-6)进行实时测量。吸收液中的产品亚硝酰硫酸采用KMnO4氧化还原滴定来确定浓度,测得其中亚硝酰硫酸的体积分数≥40%后,结束吸收。
3.3 亚硝酰硫酸分析方法
称取定量的吸收液,利用0.1 mol×L-1的高锰酸钾溶液和0.1 mol×L-1的草酸溶液,将溶液加热到60~70 ℃时进行滴定测试,当溶液呈微红色即为终点,其反应方程式如下所示[19]:
2KMnO4+ 5NOHSO4+ 2H2O= K2SO4+ 2MnSO4+ 5HNO3+ 2H2SO4(5)
计算亚硝酰硫酸的质量为
0.063×(KMnO4KMnO4-Na2C2O4Na2C2O4) (6)
式中:为溶液的体积,mL;为溶液的浓度,mol×L-1;为亚硝酰硫酸的质量,g。
3.4 传质系数的测定
吸收液吸收SO2和NO2均为气液两相反应过程,可采用双膜理论进行分析解释,G为气相总传质系数,mol×Pa-1×cm-2×s-1,其倒数表示相应的传质阻力[20-21]。气相传质系数也反映了在一定传质推动力下气液传质通量的大小,如式(7)所示:

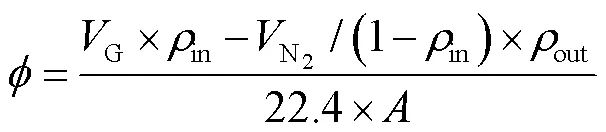
式中:G为进入反应器的气体体积,L;22.4为标准状况下1 mol理想气体体积,L;是反应器中的反应面积,cm2;b为气相主体中的分压,Pa;p为平衡分压,Pa。
本实验中SO2和NO2的分压力b,采用对数平均计算的形式。
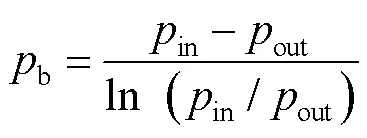
式中:in、out分别为反应器入口、出口的平衡分压,Pa。总传质推动力采用了吸收气体的气相主体压力与平衡压力的差值表示。为研究吸收的选择性,采用SO2和NO2的总传质系数的比值来表示吸收液吸收2种气体的选择性吸收因子,即
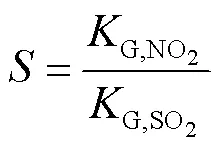
根据计算得出的选择性吸收因子和传质系数G对液相传质系数和实验的动力学进行探究分析。
4 实验结果与讨论
4.1 吸收液组成的影响
在SO2和NO2联合吸收之前,本实验先考察吸收液分别对单一组分的SO2和NO2吸收影响,结果如图2所示。
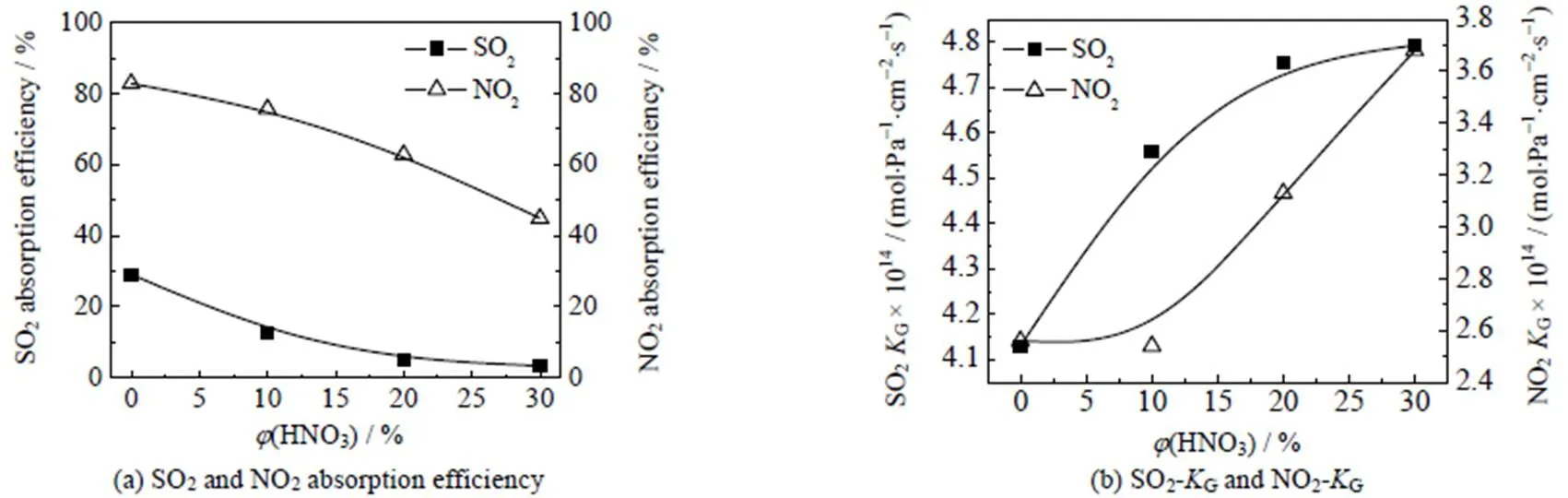
图2 单一污染物对吸收效率与传质系数的影响
Temperature = 30 ℃,(SO2) = 12 038 mg×m-3,(NO2) = 2 988 mg×m-3, liquid flow rate = 0.55 m×s-1, gas flow rate = 1.32 m×s-1, absorption area = 6 280 cm2
由图2所示,在同一吸收条件下改变吸收液体积分数,分别针对SO2和NO2单独吸收进行考察。结果显示,随着吸收液中的硝酸体积分数(HNO3)增加,对SO2和NO2的吸收效率均呈现下降趋势,传质系数G则呈现增加。吸收过程中,由于单一组分吸收导致气相中的NO2与SO2间不存在氧化还原循环,因此也不具有协同效应。此时,吸收液对SO2基本不具有吸收能力,而NO2的吸收效率由于吸收液中硫酸的下降,导致吸收效率随之下降。G随(HNO3)增大而增加,主要因为硝酸的加入使整体化学反应速率大幅增加,最终导致气体传质系数大幅增加,反应更快达到平衡。本实验还考察了吸收液的组成成分对SO2和NO2联合吸收的影响,结果如图3所示。当吸收液只含有浓硫酸时,吸收液对污染物吸收效率最低。随着(HNO3)的增加,对SO2与NO2污染物的联合吸收效率呈现先增加后减少的趋势。当吸收液中(HNO3)为10% 与20% 时,硫酸和硝酸的体积比为对SO2与NO2污染物联合的最佳反应吸收效率。形成混酸体系后对SO2和NO2的吸收能力显著增强。当(HNO3)达到30% 时,SO2与NO2的G均开始略微下降,用(HNO3)为40%的硝酸时淋洗时,形成大量酸雾导致对SO2与NO2吸收效率和G大幅下降。在混酸体系中,对比单一组分吸收液对SO2和NO2的吸收效率明显提升,特别是对SO2的吸收能力有了明显的改变,主要原因是SO2与NO2发生氧化还原反应,生成NO和SO3,并达到动态平衡,使SO2和NO2之间存在协同吸收。同时,硝酸参与吸收反应并促进吸收平衡向产物的方向移动,同样印证了NO(= 1或2)极易溶于硝酸,与SO2反应形成硫酸,对消耗硫酸进行补充。此时选择性因子大于1,根据可以得到,气相的SO2和NO2经过气液界面进入液相时,迅速与吸收液发生反应完成吸收过程,在最佳效率时吸收液优先吸收NO2,SO2的吸收则被抑制,需要采取措施保证或改善其吸收性能。综上可知,混酸作为吸收液可以使反应的平衡向产物方向移动,稳定存在的亚硝基硫酸的含量比单一吸收液的亚硝基硫酸含量更高,当吸收液中(HNO3)大于20%时,硫酸的体积分数减少,从而降低对NO2的吸收效率,使整体吸收效率和传质系数G大幅降低。
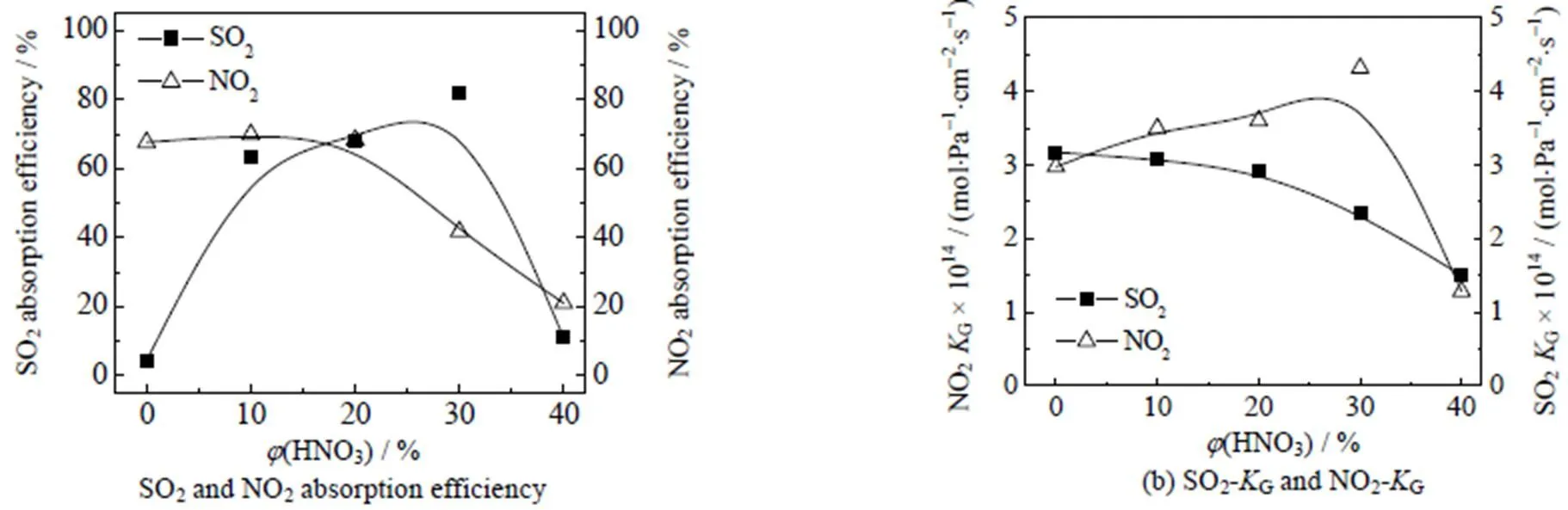
图3 吸收液中硝酸含量对吸收效率和传质系数的影响
Temperature = 30 ℃,(SO2) = 12 038 mg×m-3,(NO2) = 2 988 mg×m-3, liquid flow rate = 0.55 m×s-1, gas flow rate = 1.32 m×s-1,absorption area = 6 280 cm2
4.2 气体流速的影响
在吸收过程中,气体的流速是影响吸收效率和传质系数G的一个重要参数。因此,本实验考察了气体流速对SO2和NO2吸收生成亚硝酰硫酸的影响,结果如图4所示。
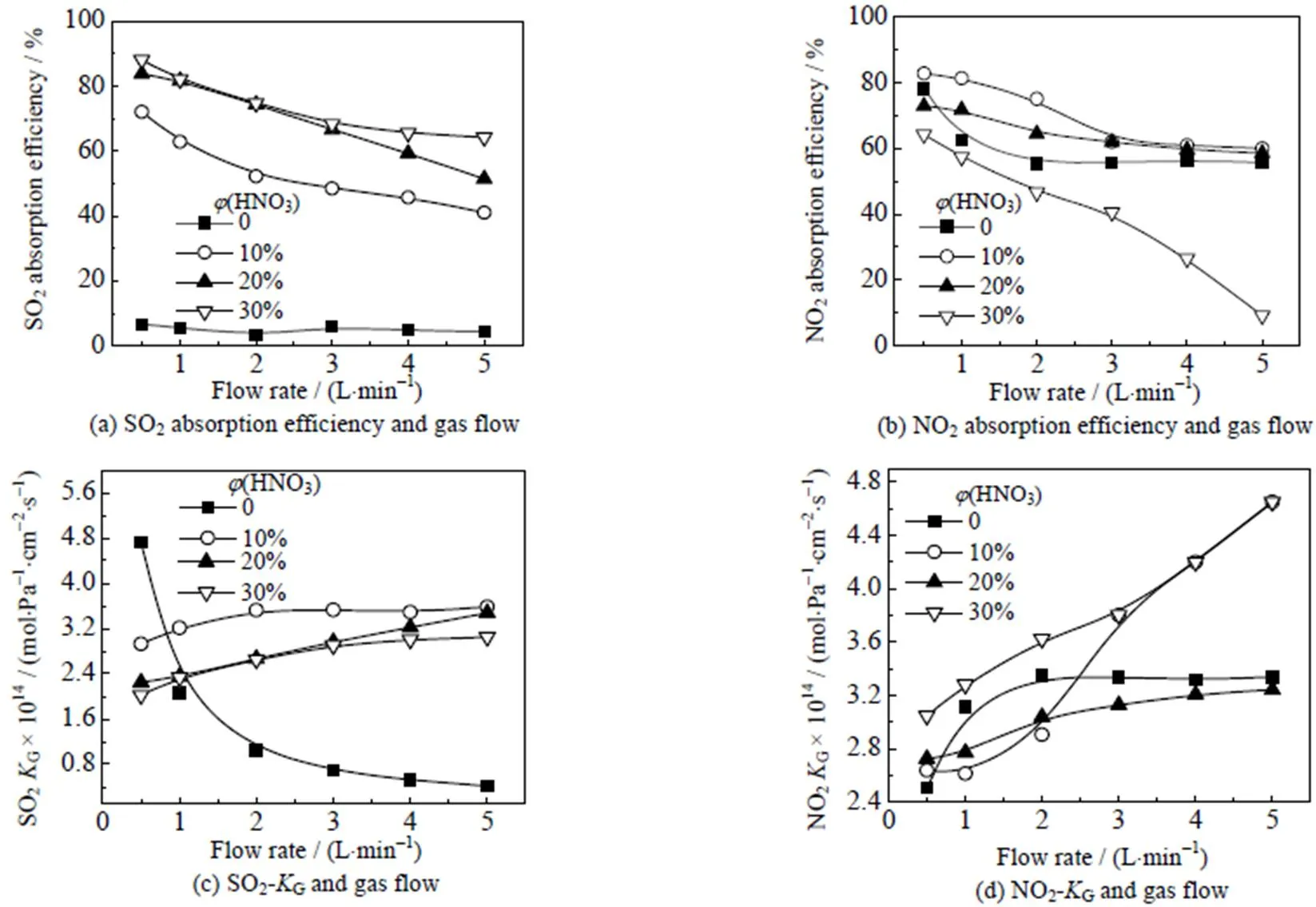
图4 气体流速对吸收效率和传质系数KG影响
Temperature = 30 ℃,(SO2)= 12 038 mg×m-3,(NO2)= 2 988 mg×m-3, liquid flow rate = 0.55 m×s-1, absorption area = 6 280 cm2
在相同吸收液下,当气体的进气流速分别为1 L×min-1(1.32 m×s-1)、2 L×min-1(2.7 m×s-1)、3 L×min-1(3.9 m×s-1)、4 L×min-1(5.3 m×s-1)和5 L×min-1(6.3 m×s-1)时,进行吸收反应测试。由图4可知,吸收效率随进气量增加而降低,而G则随着进气量增大而增大。由公式(9)可知,产生这种现象的原因可能是增大进气量后,会增加气体与液体之间的湍流程度,气液间接触时间变短。气体流速较高时,气体传质通量增加,气体传质阻力随增加而增加,因此G同步增加。气体流速较低时虽对应着吸收效率的增加,却因过低的流速使得总体吸收速率过低。而过大的气体流速导致尾气中污染物浓度过高,增加尾气处理的成本。因此,选择合适的气体流速对优化反应至关重要,综合可知进气流速为1 L×min-1(1.32 m×s-1)是最佳吸收条件。
4.3 污染物浓度的影响
在工业吸收中,污染物浓度同样是一个重要参数。本实验中由于SO2和NO2之间存在协同作用,同时存在氧化还原的动态平衡,因此两者的比例也至关重要。
如图5、6所示,随着污染物负载量增加,吸收效率均随之增加。而G呈现下降。吸收效率增加的原因主要是随着污染物负载量的增加,气液的接触通量增加,同时两者之间存在协同吸收效应,也能促进吸收反应进行。其中,NO2浓度增加对SO2的吸收效率提升显著,当污染物中NO2的体积分数增大时,SO2的吸收效率和传质系数均增大,当NO2与SO2的体积比接近2:7时,吸收液对污染物的吸收效率达到最大。而随着污染物的负载量增加,SO2和NO2的液相传质系数G降低,其主要原因是溶液中的液相阻力比例增大,气相阻力所占比例降低,因此导致吸收速率呈现下降趋势。综上所述,SO2与NO2的浓度为11 779与3 010mg×m-3时,吸收效率最佳。
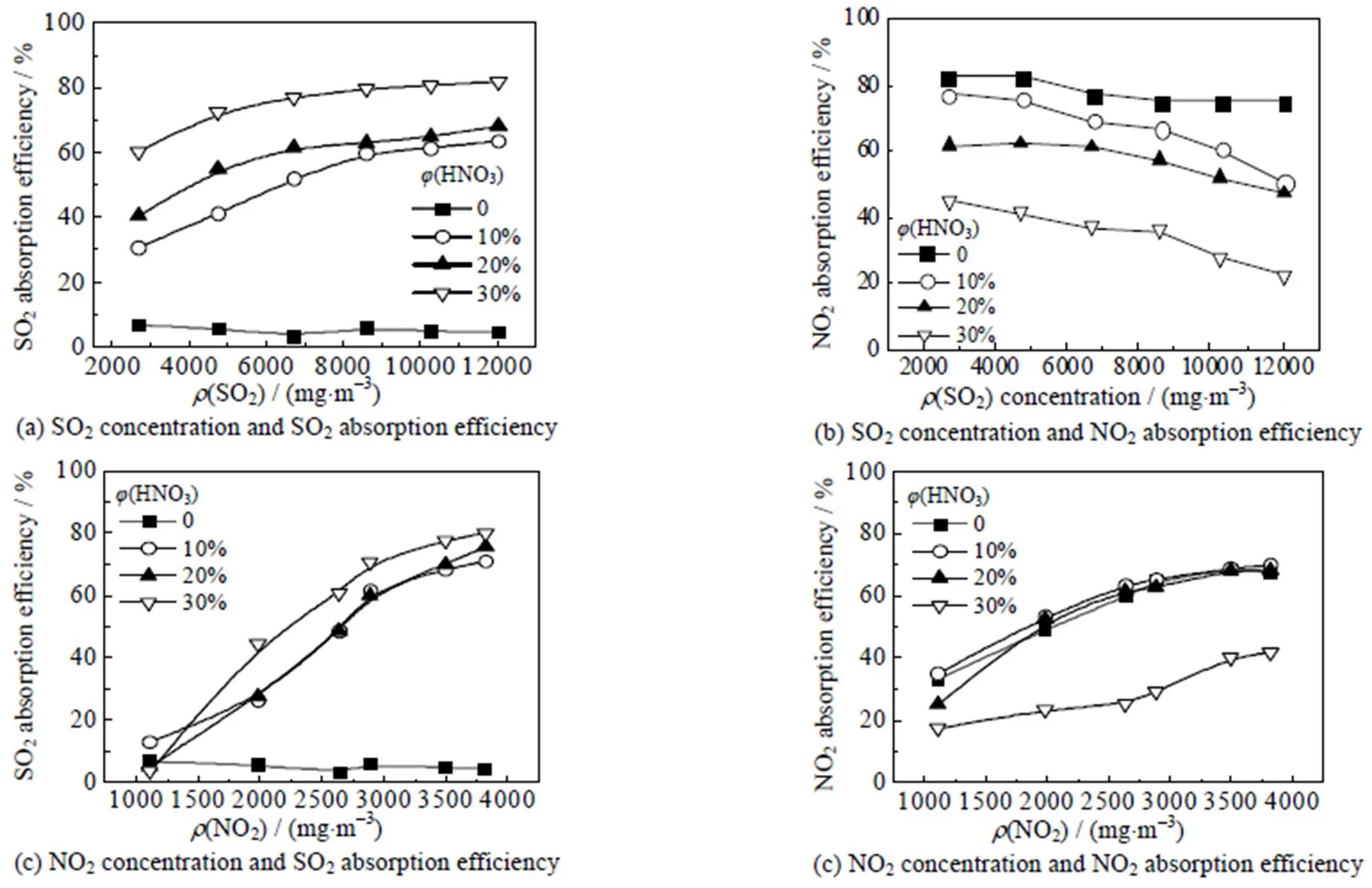
图5 吸收效率与污染物负载量变化的关系
Temperature = 30 ℃, liquid flow rate = 0.55 m×s-1, absorption area = 6 280 cm2
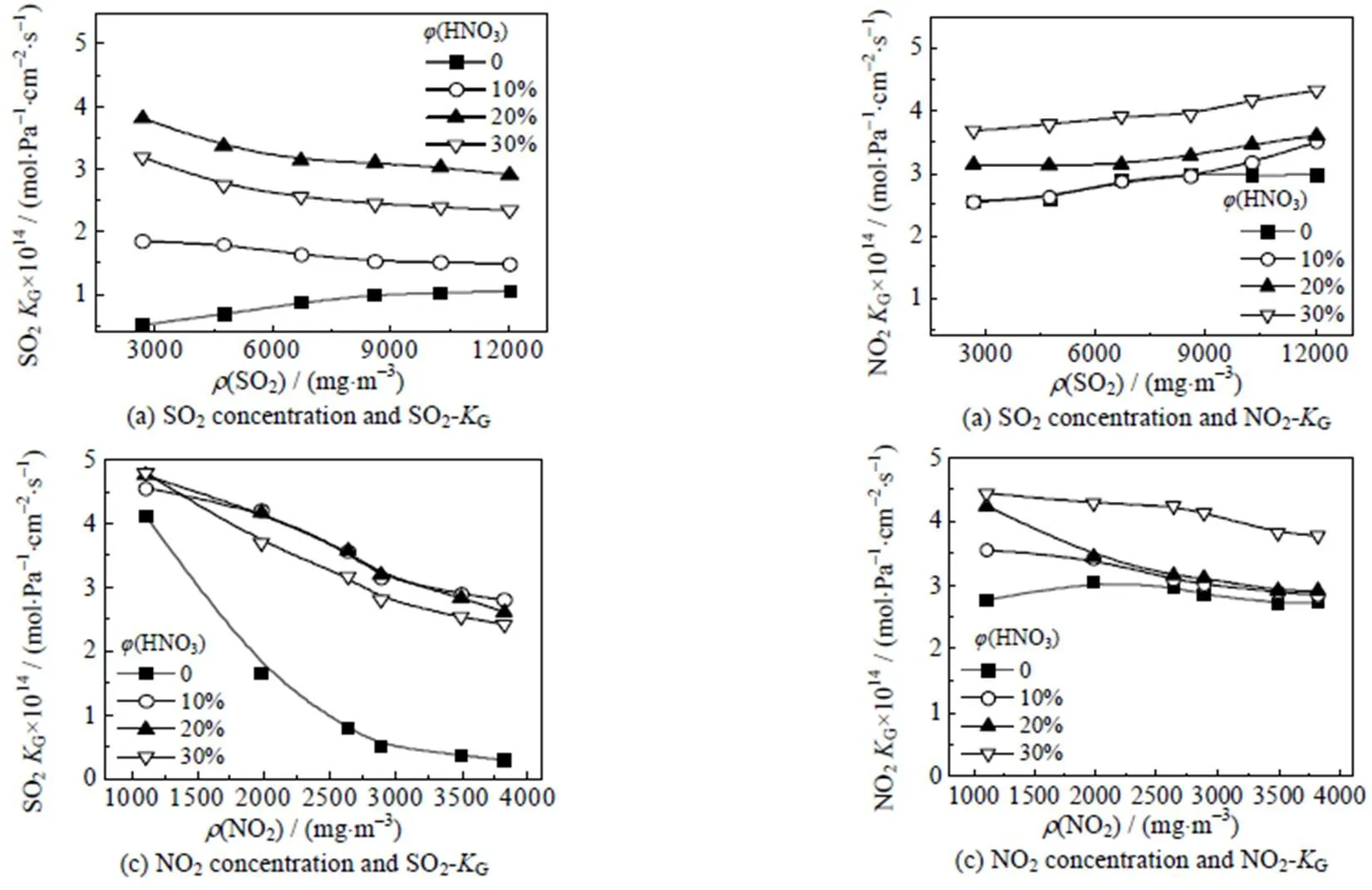
图6 传质系数KG与污染物负载量变化的关系
Temperature = 30 ℃, liquid flow rate = 0.55 m·s-1, absorption area = 6 280 cm2
4.4 吸收时长对传质系数的影响
在吸收过程中,吸收时长也是影响吸收效率和G的一个重要参数。因此,本实验考察了吸收时长对SO2和NO2吸收生成亚硝酰硫酸的影响,结果如图7所示,反应随着吸收时间的延长,吸收效率和G均呈现下降。吸收时间对G和吸收效率的影响主要是由于吸收液浓度的变化。吸收过程中,吸收液持续消耗并生成产物,导致吸收液浓度降低。根据吸收机理,气液浓度越低,吸收效率越低,G越小,反应速率越慢。当70 h后产物亚硝酰硫酸的体积分数达到50.36% 时,反应基本停止。主要是由于吸收反应导致吸收液中的浓硫酸和浓硝酸体积分数降低。
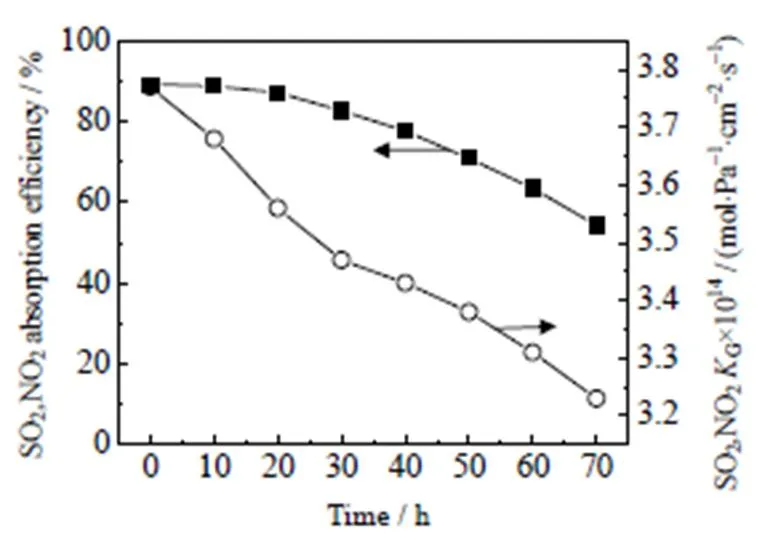
图7 吸收液吸收时间与吸收效率和传质系数KG的变化关系
Temperature = 30 ℃,(SO2)= 12 038 mg×m-3,(NO2)= 2 988 mg×m-3, liquid flow rate = 0.55 m×s-1, absorption area = 6 280 cm2
4.5 亚硝酰硫酸产物核磁共振测定
利用核磁共振仪对亚硝酰硫酸的结构进行表征,其1H谱和14N谱结果如图8所示。氮谱中唯一的峰对应着亚硝酰硫酸中唯一的氮。由于样品溶解于硫酸中,氢谱出峰位置受到pH值影响,其中11.02的最强峰对应硫酸中的氢,其余的4.70和2.34分别对应水和亚硝酰硫酸中的氢。
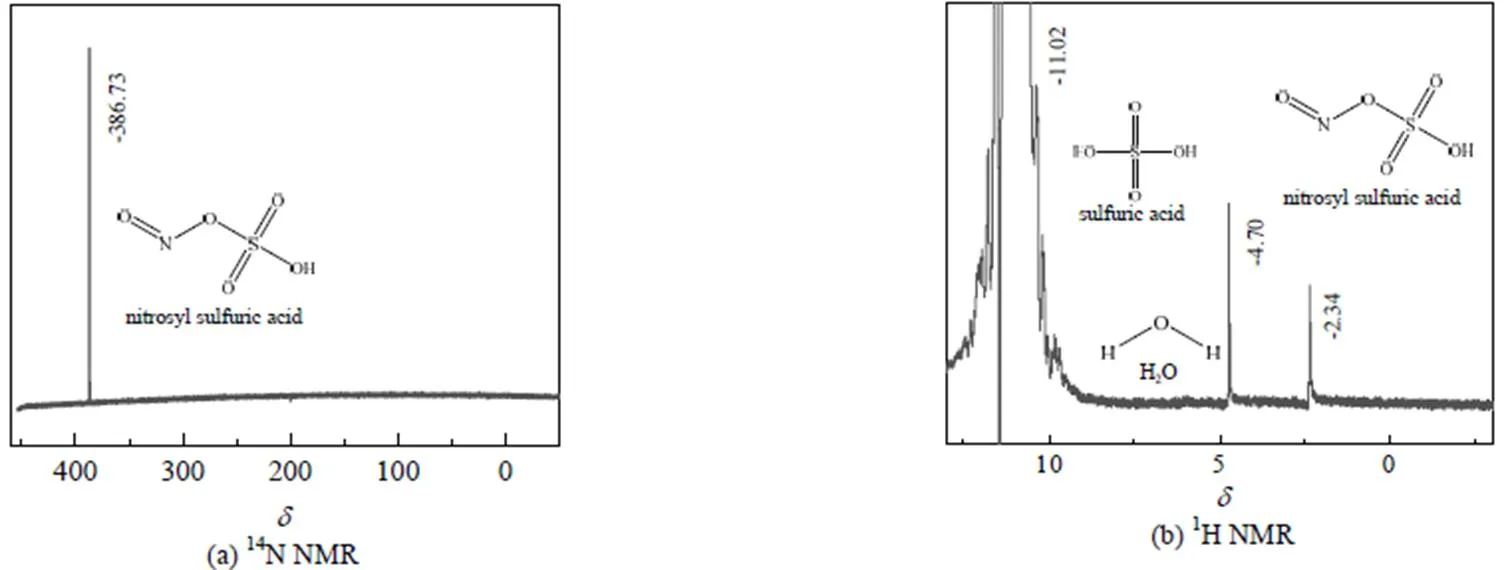
图8 亚硝酰硫酸核磁图
5 结 论
实验采用填料塔的形式,以浓硫酸/硝酸构成的吸收液体系同时吸收高浓度的SO2和NO2,并生成亚硝酰硫酸,实现废物的资源化利用。对吸收反应过程的动力学参数和传质性能进行了研究,并优化了该工艺的参数和吸收效率,得到以下结论:
(1) 吸收液组分对吸收实验有较大影响,硝酸和硫酸形成的混酸体系效果比单一硫酸的吸收效率更高,在体积分数为20% 时达到最佳吸收体系。
(2) 气体流速影响实验显示,当提高气体流速后,吸收体系的吸收效率和总体传质系数下降。在本实验中,气体流速为1.32 m×s-1时,具有最佳的吸收效率。
(3) 污染物负载量实验结果显示,当污染物浓度越高,吸收效率和传质系数也呈现正相关,随着污染物浓度的增大而增大。
(4) 吸收效率随着吸收时间的延长而降低。在本实验中,当反应吸收时间为70 h时,亚硝酰硫酸产物体积分数约为53%,吸收反应结束。
[1] GHOLAMI F, TOMAS M, GHOLAMI Z,. Technologies for the nitrogen oxides reduction from flue gas: A review [J]. Science of the Total Environment, 2020, 714: 136712.1-136712.26.
[2] CORDOBA P, LIEBERMAN N R, IZQUIERDO M,. Understanding the impact of FGD technologies on the emissions of key pollutants in a Co-firing power plant [J]. Journal of the Energy Institute, 2020, 93(2): 518-532.
[3] 秦赢. 冶炼烟气制酸过程中氮氧化物的脱除 [J]. 世界有色金属, 2014(5): 60-63.
QIN Y. Removal of nitrogen oxides during smelting flue gas sulphuric acid production [J]. World Nonferrous Metals, 2014(5): 60-63.
[4] 王军, 曾庆福, 陈磊, 等. 间歇式高浓度氮氧化物废气的治理技术 [J]. 武汉科技学院学报, 2003, 16(5): 26-31.
WANG J, ZENG Q F, CHEN L,The intermittent and high concentration NOexhaust gas disposal technology [J]. Journal of Wuhan Textile University, 2003, 16(5): 26-31.
[5] 周锦晖. 烟气中二氧化硫和氮氧化物的氧化及脱除实验研究 [D]. 北京: 华北电力大学, 2013.
ZHOU J H. Experimental investigation on oxidation and removal of SO2and NOin flue gas [D]. Beijing: North China Electric Power University, 2013.
[6] 刘华彦. NO的常温催化氧化及碱液吸收脱除NO过程研究 [D]. 杭州: 浙江大学, 2011.
LIU H Y. Studies on NOremoval by NO catalytic oxidation and alkali solution absorption at ambient temperature [D]. Hangzhou: Zhejiang University, 2011.
[7] SUCHAK N J, JETHANI K R, JOSHI J B. Modeling and simulation of NO, absorption in pilot-scale packed columns [J]. AIChE Journal, 1991, 37(3): 323-339.
[8] 王文生. 亚硝基硫酸装置工艺爆炸危险性分析与控制措施 [J]. 煤炭与化工, 2007, 30(8): 70-71.
WANG W S. Analysis and control measures of process explosion hazard of nitrosulphuric acid plant [J]. Coal and Chemical Industry, 2007, 30(8): 70-71.
[9] BONDARENKO O B, GARAEV Z M, KOMAROV A I,. Nitrosylsulfuric acid in the synthesis of 5-chloroisoxazoles from 1,1-dichlorocyclopropanes [J]. Mendeleev Communications, 2019, 29(4): 419-420.
[10] 许峻岭, 尚惠平. 亚硝基硫酸装置的发展 [J]. 煤炭与化工, 2007, 30(1): 28-29.
XU J L, SHANG H P. Development of nitrosulphuric acid plant [J]. Coal and Chemical Industry, 2007, 30(1): 28-29.
[11] 尹新, 杨江宇, 缪永奕, 等. 一种亚硝基硫酸的生产方法及应用: CN, 106379875A [P]. 2017-02-08.
YIN X, YANG J Y, MIAO Y Y,. A production method and application of nitroso sulfuric acid: CN, 106379875A [P]. 2017-02-08.
[12] 尹新, 吴然, 谢倩, 等. 一种亚硝基硫酸的制备及工业废酸中硫酸与磷酸的分离方法: CN, 105417509A [P]. 2016-03-23.
YIN X, WU R, XIE Q,. Method for preparing nitrosyl sulfuric acid and separating sulfuric acid and phosphoric acid in industrial waste acid: CN, 105417509A [P]. 2016-03-23.
[13] 谭应龙, 徐雷金, 文庆, 等. 一种H酸生产尾气的资源化处理方法及处理系统: CN, 105536478A [P]. 2016-05-04.
TAN Y L, XU L J, WEN Q,. Resourceful treatment method and treatment system of H acid production tail gas: CN, 105536478A [P]. 2016-05-04.
[14] 张云报, 毛兵, 王培城, 等. 一种H酸生产尾气的资源化处理系统: CN, 205340497U [P]. 2016-06-29.
ZHANG Y B, MAO B, WANG P C,A resource treatment system for H acid production tail gas: CN, 205340497U [P]. 2016-06-29.
[15] LIU J Z, WANG S J, QI G J. Kinetics and mass transfer of carbon dioxide absorption into aqueous ammonia [J]. Energy Procedia, 2011, 4: 525-532.
[16] 乔军师. NO空气氧化与液相吸收实验研究 [D]. 天津:天津大学, 2005.
QIAO J S. Experimental research on the air oxidation and absorption of NOwith solutions [D]. Tianjin: Tianjin University, 2005.
[17] 刘杨先, 潘剑锋, 刘勇. UV/H2O2氧化联合CaO吸收脱除NO的传质-反应动力学 [J]. 化工学报, 2013, 64(3): 1062-1068.
LIU Y X, PAN J F, LIU Y. Mass transfer-reaction kinetics for NO removal by combination process of UV/H2O2oxidation and CaO absorption [J]. CIESC Journal, 2013, 64(3): 1062-1068.
[18] 何昆. 一种燃煤锅炉烟气NO-SO2联合脱除新工艺的研究 [D]. 北京: 北京交通大学, 2013.
HE K. Experimental study on simultaneous removal of NOand SO2form flue gas [D]. Beijing: Beijing Jiaotong University, 2013.
[19] 谭凤姣. 无盐亚硝酰硫酸合成工艺研究 [J]. 湘潭师范学院学报(自然科学版), 2004, 26(2): 30-31.
TAN F J. Study on the synthesis process of salt-free nitrosyl sulfuric acid [J]. Journal of Xiangtan Normal University(Natural Science Edition), 2004, 26(2): 30-31.
[20] JING G, ZHOU L, ZHOU Z. Characterization and kinetics of carbon dioxide absorption into aqueous tetramethylammonium glycinate solution [J]. Chemical Engineering Journal, 2012, 181: 85-92.
[21] 魏凤玉, 何园, 童晨. 填料塔中哌嗪二胺吸收低浓度SO2的传质性能 [J]. 化学工程, 2012, 40(8): 37-41.
WEI F Y, HE Y, TONG C. Mass transfer performance of piperazine diamine absorbing low concentration SO2in a packed tower [J]. Chemical Engineering(China), 2012, 40(8): 37-41.
[22] 齐国杰. 氨水溶液联合脱除二氧化碳和二氧化硫的研究 [D]. 北京:清华大学, 2013.
QI G J. Study on combined capture of CO2and SO2in aqueous ammonia [D]. Beijing: Tsinghua University, 2013.
Simultaneous absorption of high concentration SO2and NO2in packed tower for nitrosyl sulfuric acid synthesis
NI Kai-wen, JING Guo-hua, WU Xiao-min, CHEN Zi-yi
(College of Chemical Engineering, Huaqiao University, Xiamen 361021, China)
In order to solve atmospheric pollution caused by high concentration of SOand NOproduced by sulfonation and nitrification in dye industry, absorption of SO2and NO2in packed tower reactor to produce nitrosyl sulfuric acid was studied and the process conditions were optimized. Effects of composition (H2SO4and HNO3) and concentration, gas flow rate, pollutant concentration and absorption time on absorption efficiency and volumetric mass transfer coefficientGwere investigated. The results show that theGof SO2and NO2exhibits a parabolic trend with the change of nitric acid concentration in absorption solution, and it decreases with the increase of gas-liquid flow rate. It also varies with pollutant concentration and decreases with the decrease of filler contact area. The optimal absorption condition for simultaneously SO2(concentration of 11 779 mg×m-3) and NO2(concentration of 2 822 mg×m-3) adsorption was found as: gas flow rate 1.32 m×s-1, liquid flow rate 0.55 m×s-1and 20% HNO3(volume fraction).
NO2; SO2; nitrosyl sulfuric acid; packed tower; mass transfer coefficient
TQ610.9
A
10.3969/j.issn.1003-9015.2022.01.017
1003-9015(2022)01-0135-08
2021-01-19;
2021-04-28。
国家重点研发计划“重点专项 (2018YFC0214103,2019YFC0214302);国家自然科学基金(22006043,21806045,21476207,91534113);福建省科技计划基金(2020H6013)。
倪凯文(1996-),男,福建厦门人,华侨大学硕士生。
荆国华,E-mail:zhoujing@hqu.edu.cn
倪凯文, 荆国华, 吴孝敏, 陈子逸. 填料塔同时吸收高浓度SO2和NO2生成亚硝酰硫酸的研究[J]. 高校化学工程学报, 2022, 36(1): 135-142.
:NI Kai-wen, JING Guo-hua, WU Xiao-min, CHEN Zi-yi.Simultaneous absorption of high concentration SO2and NO2in packed tower for nitrosyl sulfuric acid synthesis [J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(1): 135-142.

