基于新型酶电极的微生物发酵多组分在线检测流路控制系统
乔文杰, 薄翠梅, 蒋书波, 王轶卿,, 李 俊, 储震宇, 金万勤
基于新型酶电极的微生物发酵多组分在线检测流路控制系统
乔文杰1, 薄翠梅1, 蒋书波1, 王轶卿1,2, 李 俊1, 储震宇2, 金万勤2
(1. 南京工业大学 电气工程与控制科学学院, 江苏 南京 211816;2. 南京工业大学 材料化学工程国家重点实验室, 江苏 南京 211816)
针对微生物发酵过程中多组分原位在线监测问题,基于普鲁士蓝(PB)纳米材料制备的新型酶生物传感电极,研究一种原位在线多通道检测流路控制系统。根据酶生物传感电极微电流响应特性,创新设计一种多通道泵阀协同作用流路控制系统,可有效降低交叉污染,提高设备可靠性。根据流路检测逻辑时序要求,研制多组分检测过程移液针精准定位、微量精确进样、定标检测等软件程序模块。采用细分驱动电路控制步进电机,结合梯形加减速算法实现移液针的精准定位和微量精确进样,通过自主调节进样量和定标检测模块,实现多组分、宽范围、快速精确检测。实验结果表明该系统可实现葡萄糖、赖氨酸和乳酸等多组分浓度的宽范围检测,检测精度在2% 以内,能够较好地满足微生物发酵多组分在线检测需求。
酶生物传感电极;多组分在线检测;流路控制系统;加减速算法;微量精确进样
1 引 言
发酵过程中关键组分浓度实时监测分析对提高发酵生产效率极为重要[1-2],通过在线分析关键组分的浓度如发酵底物、中间代谢物产物等可以实时反映细胞生理状态,揭示细胞生长代谢规律及阶段特性[3-4],从而指导微生物发酵过程的实时调控,充分利用发酵中底物,提高产物合成效率[5]。目前最先进的生物传感器是直接与电极发生氧化还原反应的电化学酶电极[6]。酶生物传感电极作为电化学法检测葡萄糖的核心部件[7],其材料和制备工艺直接影响传感电极性能。油墨作为传统的丝网印刷电极材料,具有易聚集和难稳定等缺点,导致电催化性和导电性低,影响生物传感器的检测性能[8];金属纳米粒子和碳纳米管等电极修饰材料,存在生物相容性差和低电子转移性等缺点,导致检测精度低、范围窄[9-10]。普鲁士蓝(Prussian Blue,PB)作为一种优良的电子介体,对过氧化氢(H2O2)具有很高的电催化活性,被称为“人工过氧化物酶”[11]。课题组前期结合PB和金属纳米材料,研发了一种新型酶生物传感电极,其特殊的纳米结构不仅增强了生物相容性、电催化性和导电性,而且具有宽范围线性化特性[12-13]。
现有检测仪器对微生物发酵中组分浓度检测范围较窄,大多需要对发酵液进行离心稀释,很难满足发酵过程中原位检测要求[14]。例如,发酵行业的葡萄糖检测需求在0~200 g×L-1,大部分集中在50~100 g×L-1[15]。德国BioPAT®Trace测量仪的检测范围在0.01~40 g×L-1,美国YSI-2950生化分析仪的检测范围在0.05~25 g×L-1,国产山东省科学院生物研究所SBA-40E型生物传感分析仪的检测范围在0~1 g×L-1,深圳西尔曼公司M-online生化分析仪的检测范围在0.3~9 g×L-1。
本研究基于自主研发的新型PB酶传感电极,创新研究一种在线原位多通道检测流路控制系统。基于自制新型酶生物传感电极微电流响应特性,创新设计一种多通道泵阀协同作用流路控制系统,可有效降低交叉污染,提高设备可靠性。根据流路检测逻辑时序要求,采用细分驱动电路控制步进电机,结合梯形加减速算法实现移液针的精准定位和微量精确进样,通过自主调节进样量和精确定标检测模块,实现多组分宽范围快速高精确检测。
2 酶生物传感电极的制备
2.1 酶生物传感电极检测原理
H2O2是大多数氧化酶反应的产物之一,普鲁士蓝由于对H2O2具有高灵敏度、强选择性和电催化作用,可作为电极材料用于酶生物传感电极的构建。通过负载不同酶元件制备成不同的传感电极芯片,用以下反应式可说明酶生物传感电极的反应原理:
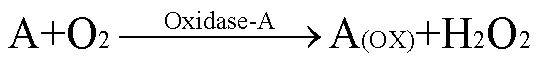
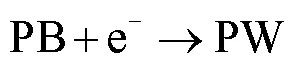
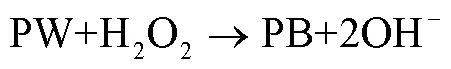
其中A代表待测组分,包括葡萄糖、乳酸和赖氨酸等;Oxidase-A代表对应的氧化酶;A(ox)代表A的氧化物质;PW为普鲁士白。
根据3个反应式可知:葡萄糖等物质氧化后生成氧化物质和H2O2,PB得到电子组成高还原活性PW,然后H2O2通过PW还原为OH-,同时PW再次被氧化成PB。PB具有可逆的电化学氧化还原能力,在整个电化学过程中作为可再生催化剂。该氧化还原过程会在电极表面产生电子的转移,进而产生电流信号。
2.2 新型酶传感电极的制备
普通的三电极电化学传感系统体积较大,难以应用在微型化检测系统中,本研究采用丝网印刷技术制备新型酶生物传感电极芯片,结构如图1所示。该技术将PB工作电极(work electrode,WE)、AgCl参
比电极(reference electrode,RE)和碳浆料对电极(counter electrode,CE)微型化集成在聚对苯二甲酸乙二醇酯(polyethylene terephthalate,PET) 基板上,各电极与对应的引线相连,形成参比层、工作层和导电层。绝缘层覆盖在导电层上,形成完整的电流回路,防止漏电流的产生,保证三电极体系的正常工作。通过戊二醛交联法将酶元件固定在传感芯片的工作层上,制备出新型酶生物传感电极。
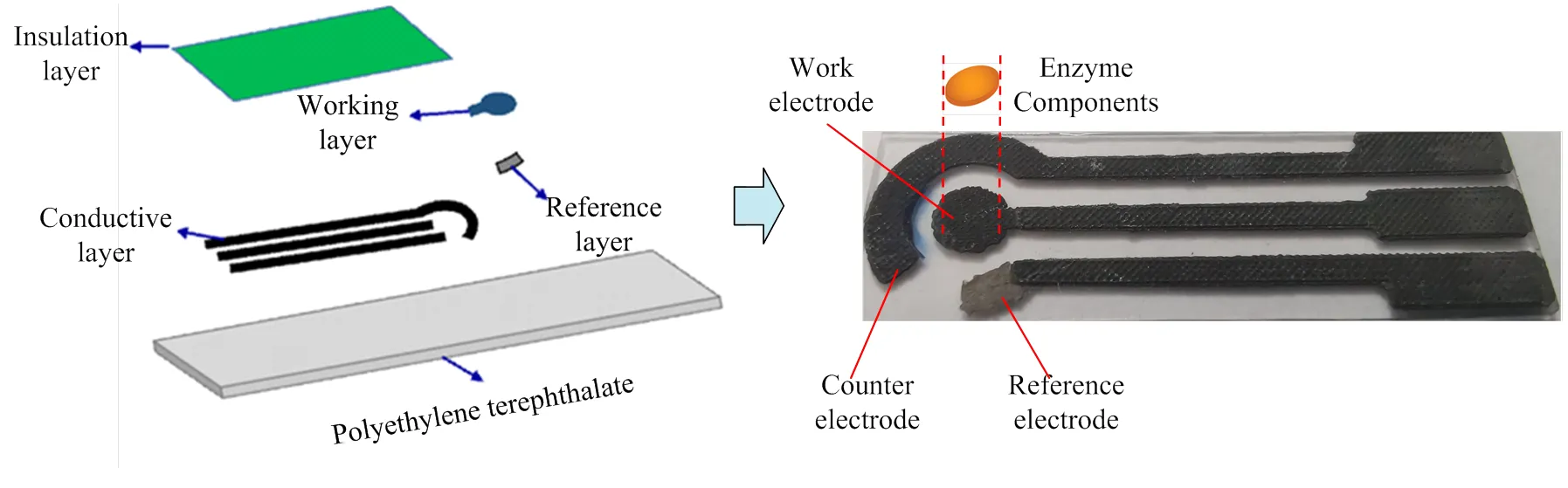
图1 PB纳米材料酶生物传感电极的制作过程
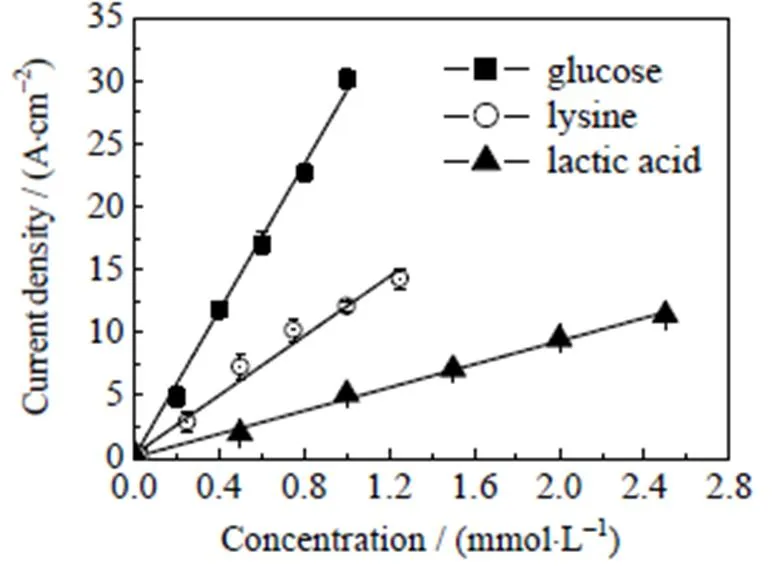
图2 不同氧化酶电极性能表征
2.3 电极性能表征
在含有电解液的检测池中,待测组分在酶生物传感电极的催化放大作用下产生电流。通过电化学检测方法(-法)探究各组分和电流的关系。将制备的电极芯片放在缓冲溶液中每隔一定时间加入相同浓度、相同体积的各组分物质,检测其电流信号的变化,结果如图2所示[13]。酶生物传感电极在反应过程中产生的nA级电流响应信号与待测组分浓度都存在宽范围线性关系,但对于不同组分响应特性不同,图中葡萄糖响应特性最强,更易于实现在线监测。
3 多组分在线检测流路控制系统
3.1 多组分检测流路结构设计
基于自制新型酶生物传感电极微电流响应特性,创新设计一种多通道泵阀协同作用流路控制系统,如图3所示。本流路系统分别包含发酵液流路、缓冲液流路、废液流路和防溢出流路,各流路间通过多路阀与汇流块相对隔离,可有效降低交叉污染,提高设备可靠性,减少设备维护成本。从图中可以看出,流路系统包括原位取样器、机械摇臂、移液针、检测池、标样池、取样池、清洗池等,通过膜片式液泵、HaloFIx-EA系列精密柱塞泵、HaloArm一体化RZ型加样摇臂、KCS plus系列蠕动泵、系列双通电磁阀等泵阀高精度协同控制系统,完成微生物组分自动清洗、自动移液、自动取样等功能。
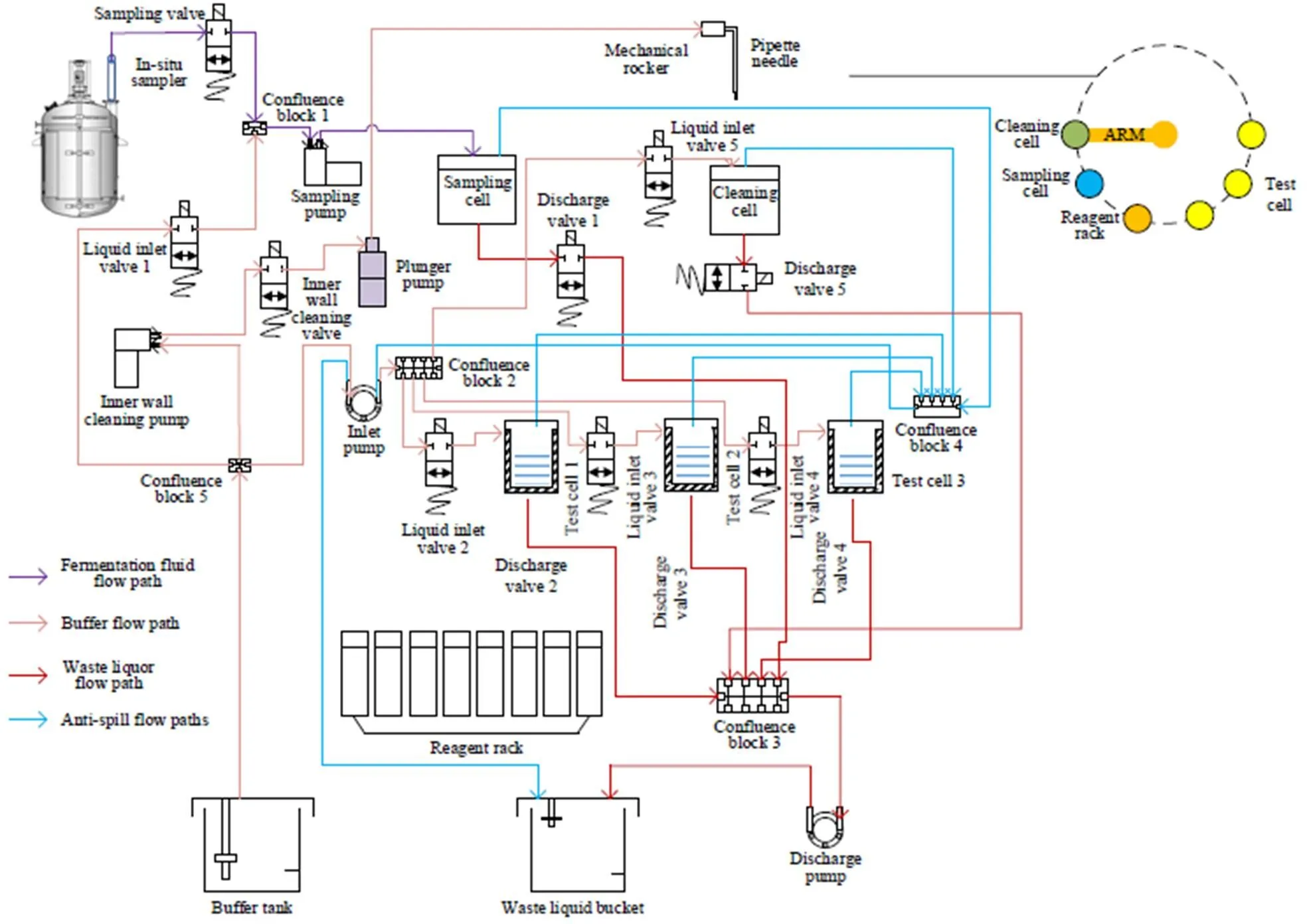
图3 多组分在线检测流路
针对发酵过程对密闭反应、防污染、高温灭菌的要求,本流路系统采用陶瓷膜研制了膜取样器,通过取样口直接插入密闭发酵罐,可有效拦截发酵液中的生物大分子,避免微生物污染流路、影响仪器的可靠性与稳定性。取样器与分析仪器之间采用即插即拔的链接方式,在灭菌时断开在线检测仪器,将发酵罐与取样器进行高温灭菌。微生物发酵组分在线检测仪流路结构设计可对管路进行反复清洗,使用缓冲液清洗管路和各池子,可有效避免污染。
3.2 微量移液针的结构设计
流路系统中机械摇臂、进样针和精密柱塞泵构成移液装置,通过控制机械摇臂垂直、水平运动实现移液针定位,通过控制柱塞泵动作实现移液针的抽取、排出液体,如图4所示。移液针精准定位和微量加样,主要依赖机械摇臂和柱塞泵的精度和控制方法。流路系统中柱塞泵和机械臂驱动电机皆是步进电机,作为一种将脉冲信号转换成响应角位移或线位移的电动机,步进电机的角位移或线位移与接收到的脉冲控制信号严格成正比,具有很好的控制特性和运动精度。
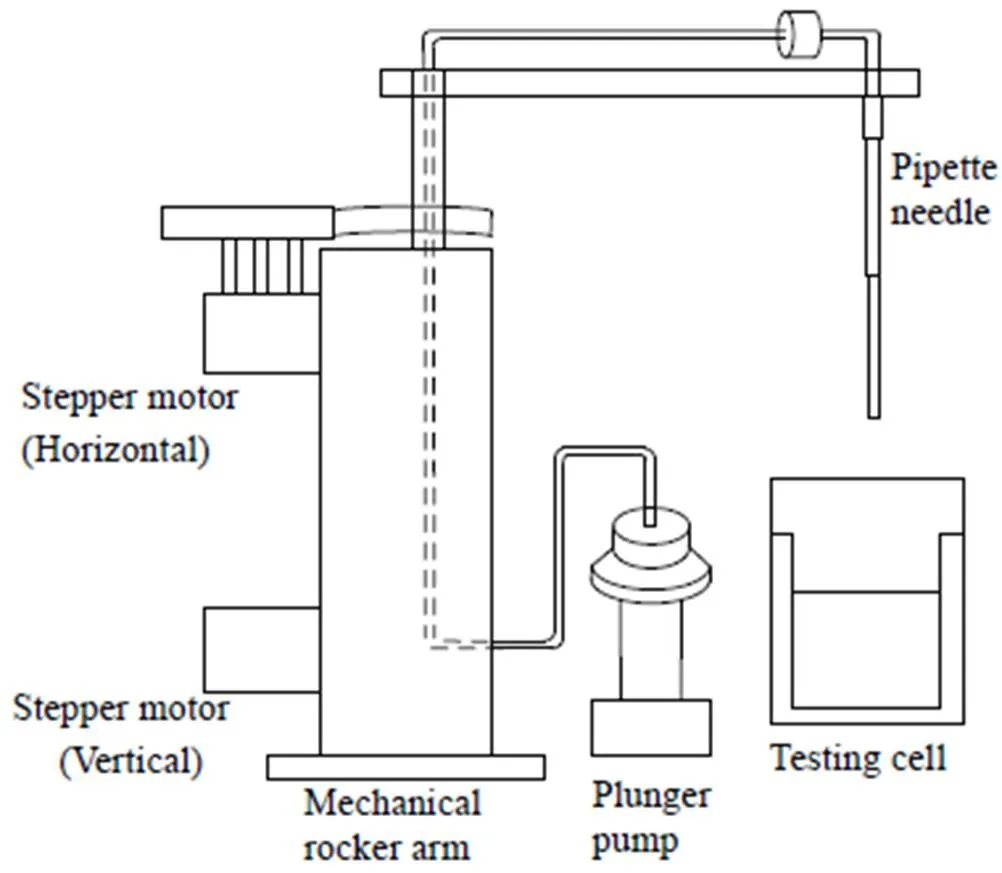
图4 微量移液针结构示意图
3.3 流路驱动高精度控制系统
控制系统硬件电路结构如图5所示,采用STM32F407为系统主芯片。通过光耦将主芯片控制电路与阀和直流电机的功率电路隔离,避免相互干扰。主芯片通过控制继电器的开关实现直流电机的启停,由2个三极管组成的达林顿电路增大驱动电流,满足继电器驱动需求。主芯片通过PEN、PCW和PCLK引脚分别控制步进电机的启停、方向以及转速。为了实现流路驱动高精度控制,提高步进电机的精确度,本节设计多细分驱动技术,对步进电机进行控制,其工作原理是将步进电机各相绕组中的电流细分为原来的1/(为电机驱动细分数),步距角也变为原来的1/,提高步进电机的位移精度和稳定性。选用THB6128为驱动芯片实现步进电机驱动,通过细分调节器(M1、M2、M3)输入不同电平组合可实现最高128细分。
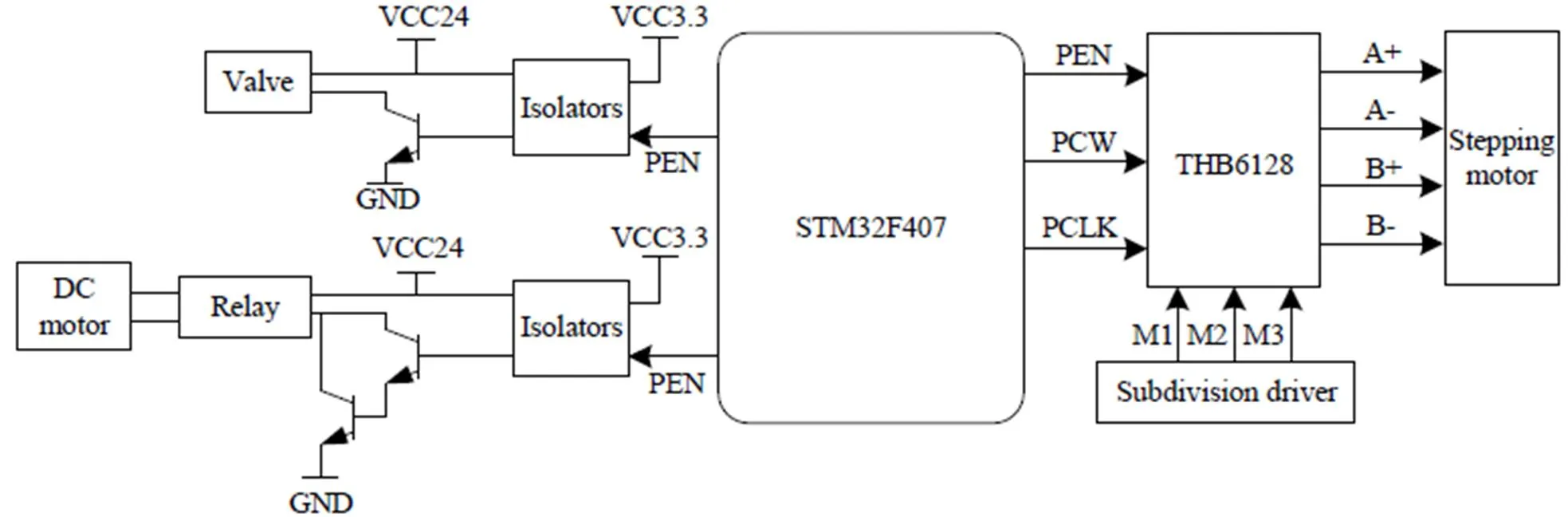
图5 控制系统硬件电路结构图
步进电机很难直接启动至高速,起步速度过快会发生堵转、失步现象,而快速停止会因为惯性造成过冲现象,本研究设计梯形加减速算法实现步进电机精准快速驱动控制,解决堵转和惯性过冲问题。梯形加减速的关键是对速度控制,通过改变加速度的大小使电机速度变化呈梯形状,电机速度的大小由脉冲时间间隔决定,如式(4):

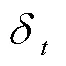
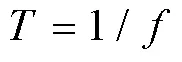
而步进电机关于步距角s(rad)、位置(rad)和角速度(rad×s-1)的关系为
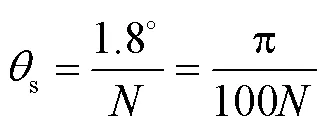
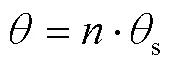

式中:为细分数,为脉冲数。
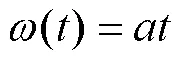
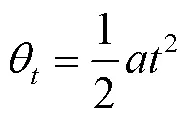
由式(7)、(9)、(10)得出
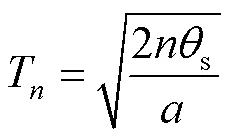
又因为
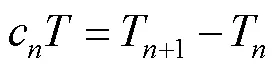
式中:c为进行了个脉冲之后的定时器计数的值,T、T+1分别为进行了、+1个脉冲之后的定时器计数周期。
由式(11)、(12)得
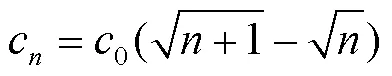
式中:0为定时器计数的初始值。
利用麦克劳林公式,将式(13)化简为
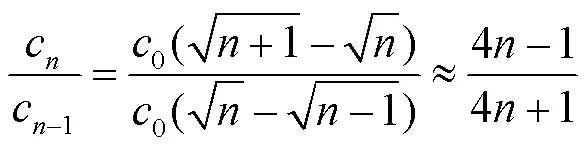
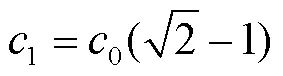
由式(7)、(9)、(10)消除T计算出加速到设定速度所需步数与加速度的关系为
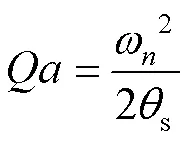
式中:为进行了个脉冲之后的电机转速,rad×s-1。
根据以上理论计算,为实现加减速控制,需要通过程序人为设定4个参数,匀速角速度speed(rad×s-1)、加加速度accel(rad×s-1)、加减速度decel(rad×s-1)和要走的步数,式中和s可认为是常数。根据以上公式和参数,加减速过程如下:
当=speed时,对应最小的定时器计数值min:
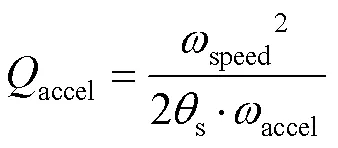

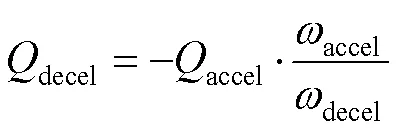
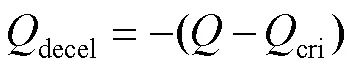
算法流程如图6所示,在设定参数后,首先进行步数判断:若步数不为0和1,根据式(19)、(20)计算加速步数和临界步数;若步数为0,直接结束;若为1,设置减速步数为1。然后判断是否有匀速过程,若加速步数不大于临界步数,根据式(21)计算减速步数,匀速步数为总步数减去加速和减速步数;否则根据式(22)只计算减速步数。最后根据式(13)将所计算步数转化为定时器比较值。
电机的速度状态切换在中断中实现,共有加速、匀速、减速、停止4种状态。在计数周期不变的情况下,电机的转速由脉冲之间的时间间隔决定,脉冲时间的间隔越短,脉冲频率越快,而定时器计数值则是本次梯形设计中决定脉冲频率的最重要的因素,为提高步进电机计算精度,起始计数值0在经过麦克劳林变化后需要与理论中的0进行差值补偿,来满足流路控制过程中精密移液和精确定位的需求。
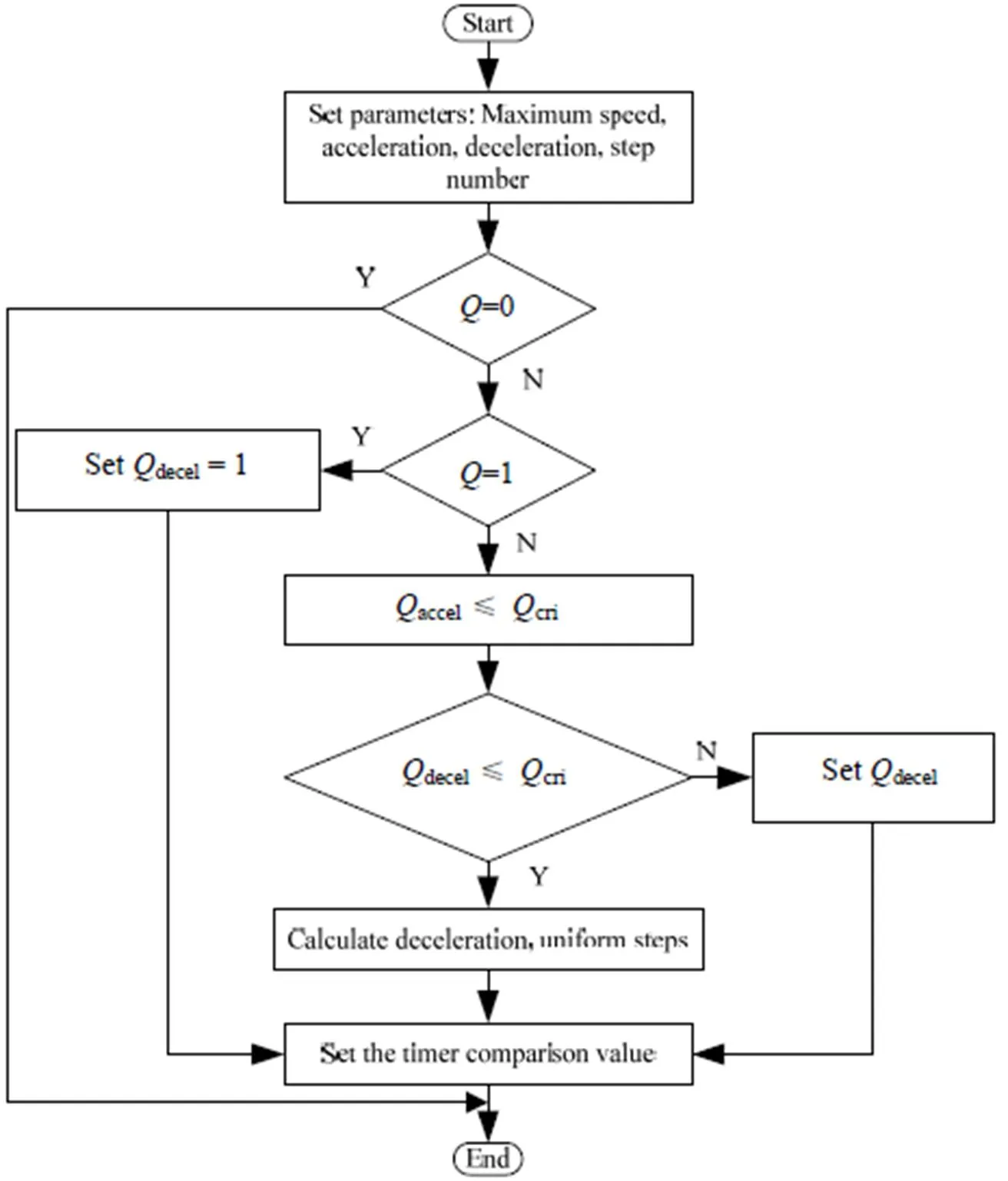
图6 梯形加减速算法流程图
4 多组分在线检测软件系统
4.1 多组分在线检测时序
传统多组分检测时序采用对同一样品的多种分析物进行检测时,一个分析物的检测完成后才能进行下一个分析物的检测,优点是直截了当、便于实现,缺点是检测多种组分耗时长,致使后续组分检测出现一定的滞后,不能准确反映发酵罐组分的实时浓度。仅适用于容量小、进料量小的实验室发酵装置。针对传统检测时序的缺点,设计了3个检测池同时检测的时序,如图7所示。
首先,3个检测池依次清洗,然后3个检测池按照移液针移取标准液的顺序进行定标。若3个定标全部通过,3个检测池同时检测,若3个定标都不通过,则系统对3个检测池同时重新定标。若任意单一检测池定标不通过,则对其余2个检测池进行检测,不通过的检测池重新进行定标、检测。若3个中任意2个定标不通过,则对通过的1个进行检测,对其余2个进行重新定标、检测。
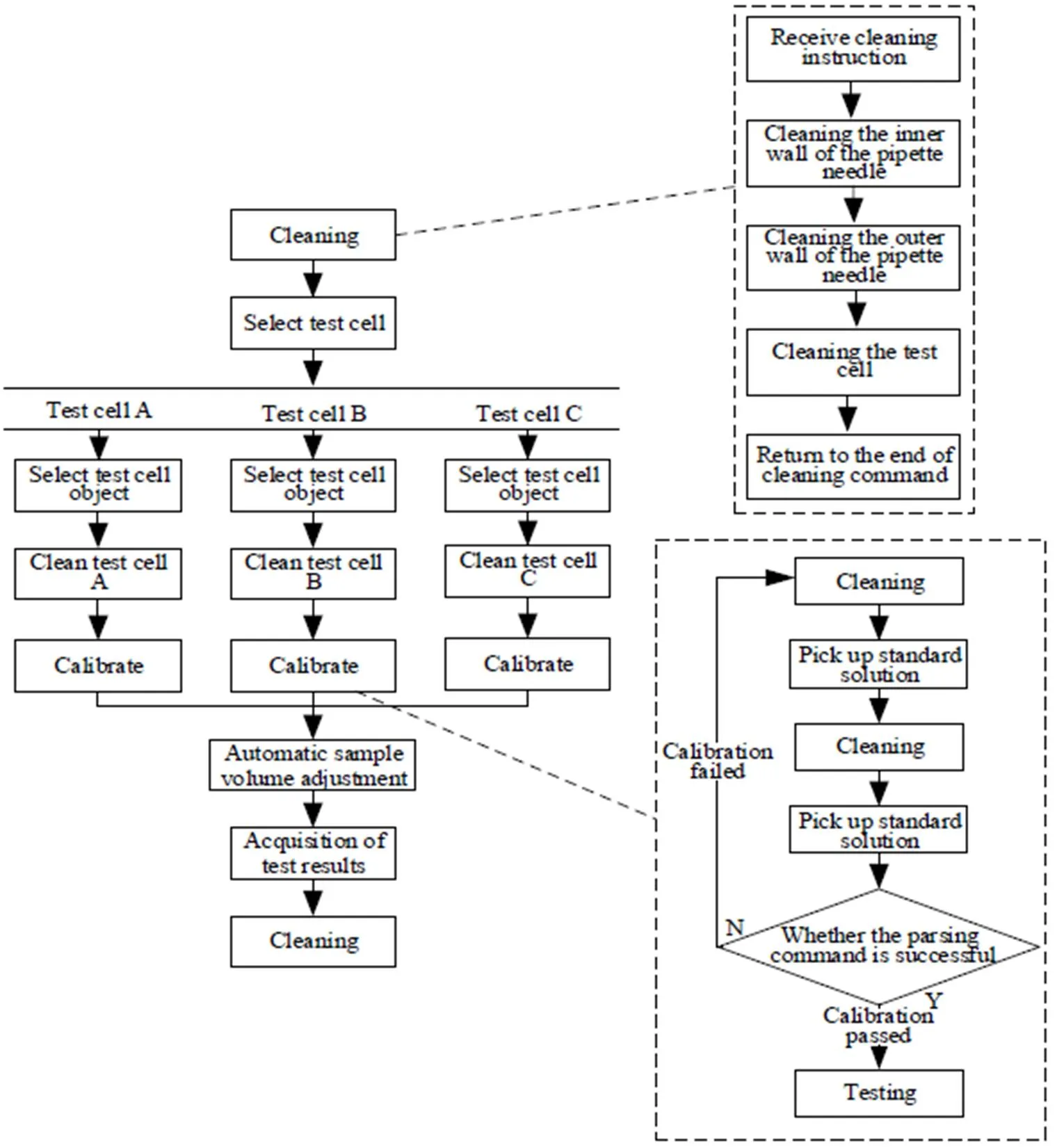
图7 多组分检测时序逻辑
4.2 模块化程序设计
根据检测时序,采用模块化编程思想,将程序分为复位、清洗、移液、取样和通信模块,如图8所示。复位模块用于机械摇臂和柱塞泵复位,消除电机累积误差;清洗模块用于清洗监控仪中留有的残液,使其可重复使用;移液模块用于移取标准液和发酵液到选定的检测池中,供电极芯片检测;取样模块用于从发酵罐抽取发酵液到取样池内,实现监控仪原位检测;通信模块用于数据解密、数据加密和数据发送。
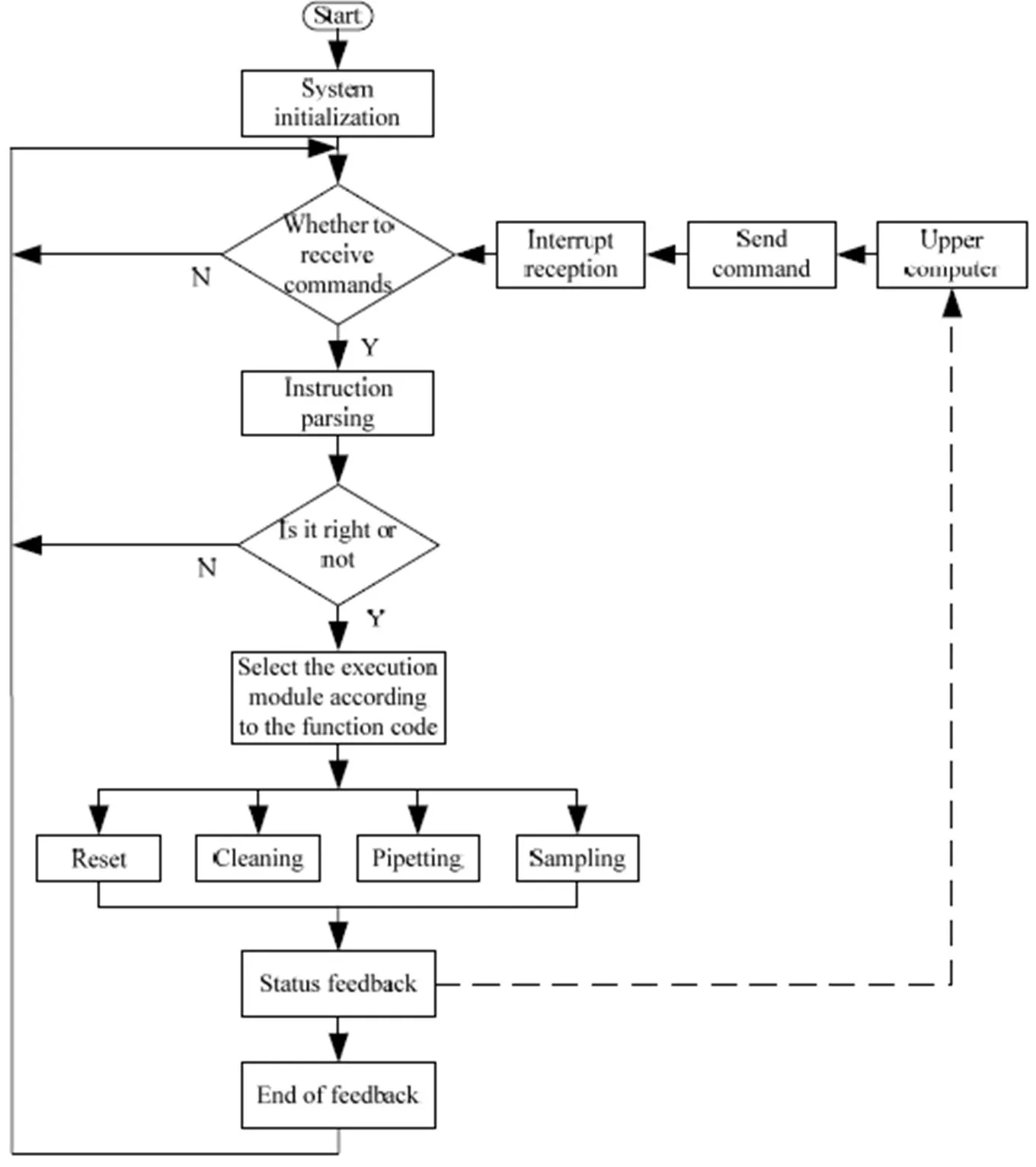
图8 程序模块化设计
4.3 定标检测模块系统
各组分定标检测流程设计如图9所示,实验均在室温下进行。首先清洗检测池,采集仅有缓冲液时的电流,响应值为ADV0;然后,移取体积为0(mL)、质量浓度为0(g×L-1)的葡萄糖标准溶液,此时信号响应值为ADV1,采集结束后对检测池进行清洗;清洗后再移取体积、0浓度为0的葡萄糖标准溶液,此时信号响应值为ADV2,结束后同样对检测池进行清洗。
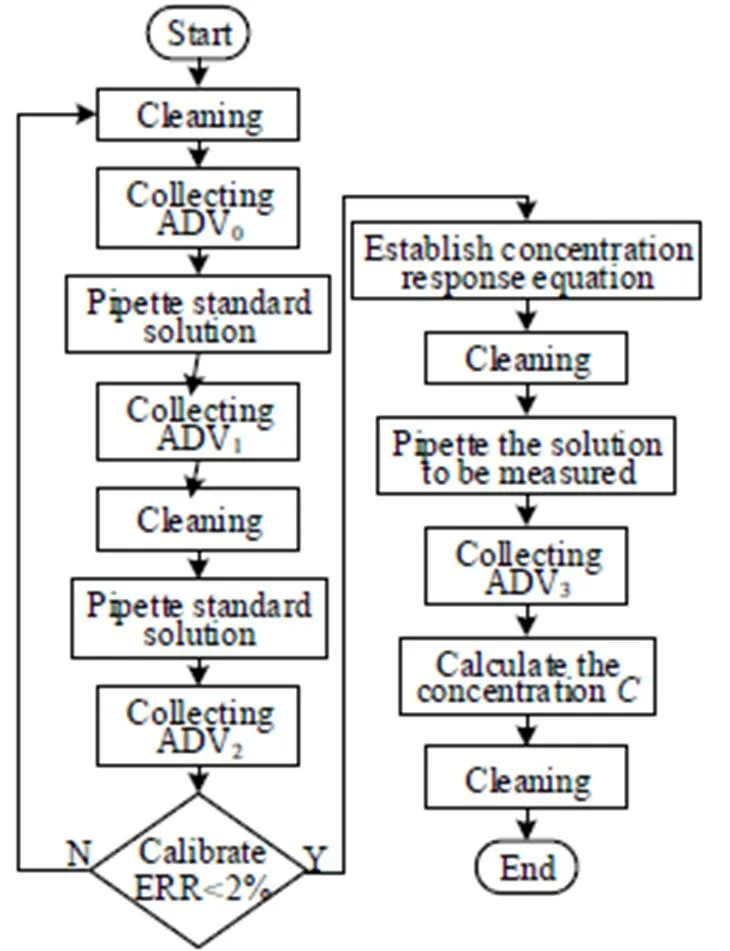
图9 定标检测流程
在不同环境和时间节点下芯片的性能有所不同,为提高检测精度,需要在检测之前进行定标处理。根据ADV0,ADV1,ADV2计算定标误差ERR,如式(23):
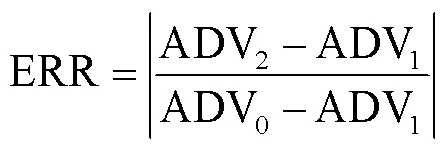
当定标误差ERR在2% 以内时定标通过,防止定标存在偶然误差,采用ADV1,ADV2的平均值建立浓度响应方程,进一步减小误差,如式(24):
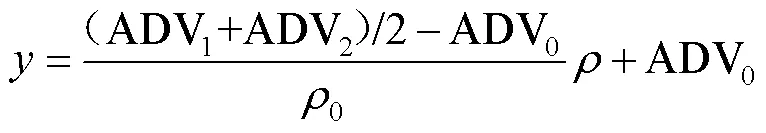
式中:为信号响应AD值,为待测物质量浓度,g×L-1。建立浓度响应方程之后,移取体积为1、浓度未知的待测溶液,此时的信号响应值为ADV3。将ADV3代入式(24)中,可得浓度为
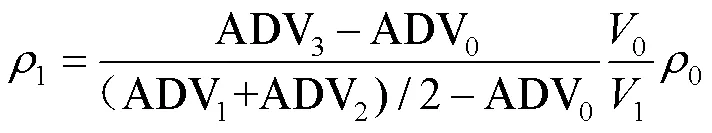
式中:1为待测溶液质量浓度,g×L-1;1为待测溶液的体积,μL。
4.4 自主调节进样系统
为提高酶生物传感电极检测范围,设计自适应调整进样量算法,实现超宽范围组分浓度原位检测,避免离心稀释繁琐过程。较低或较高浓度都会使传感芯片的检测精度下降,自动调整进样量使检测池中的浓度保持在电极芯片最佳检测范围内,根据检测体积比,求出待测液的质量浓度,从而增加检测范围。例如葡萄糖,在9~36 g×L-1,进样量25 μL;低于9 g×L-1时,提高进样量至50 μL;高于36 g×L-1时,降低进样量至5 μL,从而提高在线监控仪的检测范围。其他组分类似于葡萄糖检测,改变算法中的检测下限和上限以及对应进样量,扩展相应组分的检测范围。
5 仪器测试结果
5.1 在线监控仪的研制
根据以上设计,研制了发酵多组分浓度在线监控仪,如图10所示。该仪器可实现自动清洗、自动移液、自动定标和检测等功能,可自动完成多组分在线原位检测。仪器设计3个检测池,可完成同一组分的3种不同浓度或多种组分同时在线自动检测。

图10 多组分在线监控仪主机
5.2 多组分浓度在线测试分析
针对同一组分葡萄糖,3种质量浓度6、15、60 g×L-1在3个检测池下同时检测,实验结果如表1所示,表中检测结果单位均为g×L-1。从表1可知,相对标准偏差RSD分别为0.48%、0.61%、0.66%,表明多检测池检测的稳定性和重复性较好。并且电极响应在40 s内达到平稳状态,单一组分的检测周期控制在300 s以内,检测时不用离心稀释等操作,大大减少了检测周期。
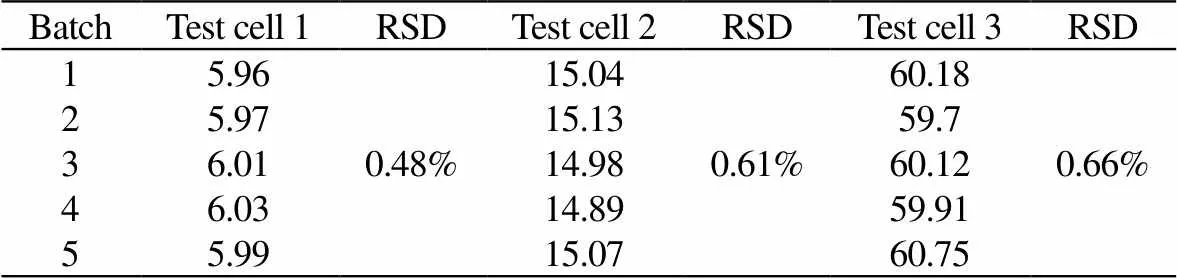
表1 多检测池实验结果
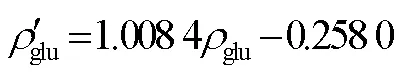
图11 多组分浓度自动测试对比分析
Fig.11 Comparative analysis of multi-component concentration automatic tests
6 结 语
本研究基于新型酶生物传感电极,创新设计一种可应用于微生物发酵在线原位检测的流路控制系统。采用模块化编程实现多组分检测过程中清洗、标定、检测等,控制系统自动进样、精确采样、组件清洗和标准液标定。设计步进电机梯形加减速控制算法和自动调整进样量算法,通过定标判断系统建立浓度响应方程,从而实现多组分、宽范围、快速精确检测。
[1] BAGHAYERI M I, AMIRI A. Non-enzymatic voltammetric glucose sensor made of ternary NiO/Fe3O4-SH/para-amino hippuric acid nanocomposite [J]. Journal of Electroanalytical Chemistry, 2018, 810(1): 69-77.
[2] MEARS L, STOCKS S M, GURKAN S,. A review of control strategies for manipulating the feed rate in fed-batch fermentation processes [J]. Journal of Biotechnology, 2017, 245(1): 34-46.
[3] LIU Q, LIU Y, WU F,. Highly sensitive and wearable In2O3nanoribbon transistor biosensors with integrated on-chip gate for glucose monitoring in body fluids [J]. ACS Nano, 2018, 12(2): 1170-1178.
[4] YANG B X, XIE C Y, XIA Z Y,. The effect of xylose reductase genes on xylitol production by industrial saccharomyces cerevisiae in fermentation of glucose and xylose [J]. Process Biochemistry, 2020, 95(5): 122-130.
[5] 高学金, 刘广生, 程丽, 等. 发酵过程葡萄糖在线检测系统的研制 [J]. 分析化学, 2012, 40(12): 1945-1949.
GAO X J, LIU G S, CHENG L,. Development of glucose on-line detection system for fermentation process [J]. Journal of Analytical Chemistry, 2012, 40(12): 1945-1949.
[6] UPDIKE S J, HICKS G P. The enzyme electrode [J]. Nature, 1967, 214(6): 986-988.
[7] YANG P Q, PANG J, HU F H,. An ultrasensitive biosensing flexible chip using a novel silver@Prussian blue core-shell nanocube composite [J]. Sensors and Actuators, 2018, 276(8): 31-41.
[8] MARRA F, MINUTILLO S, TAMBURRANO A,. Production and characterization of graphene nanoplatelet-based ink for smart textile strain sensors via screen printing technique-ScienceDirect [J]. Materials & Design, 2021, 198: 109306.
[9] ZHU C, GUO S, DONG S. PdM (M = Pt, Au) bimetallic alloy nanowires with enhanced electrocatalytic activity for electro-oxidation of small molecules [J]. Advanced Materials, 2012, 24(17): 2326-2331.
[10] BEREZOVSKA A, NEDELLEC Y, GIROUD F,. Freestanding biopellet electrodes based on carbon nanotubes and protein compression for direct and mediated bioelectrocatalysis [J]. Electrochemistry Communications, 2021, 122: 106895.
[11] CHU Z Y, LIU Y, JIN W Q,. Recent progress in Prussian blue films: Methods used to control regular nanostructures for electrochemical biosensing applications [J]. Biosensors & Bioelectronics, 2017, 96(1): 17-25.
[12] CHU Z Y, PENG J M, JIN W Q. Advanced nanomaterial inks for screen-printed chemical sensors [J]. Sensors & Actuators: B. Chemical, 2017, 243: 919-926.
[13] CHU Z, SHI L, LIU Y,. In-situ growth of micro-cubic Prussian blue-TiO2composite film as a highly sensitive H2O2sensor by aerosol co-deposition approach [J]. Biosensors & Bioelectronics, 2013, 47(3): 329-334.
[14] 莫小凡, 王晓荣, 储震宇, 等. 基于STM32和生物传感器的葡萄糖检测仪设计 [J]. 仪表技术与传感器, 2019(11): 45-48.
MO X F, WANG X R, CHU Z Y,. Design of glucose analyzer based on STM32 and biosensor [J]. Journal of Instrument Technique and Sensor, 2019(11): 45-48.
[15] KURBANOGLU S, ERKMEN C, USLU B. Frontiers in electrochemical enzyme based biosensors for food and drug analysis [J]. TrAC Trends in Analytical Chemistry, 2020, 124: 115809
Multi-component online detection flow path control system for microbial fermentation based on new enzyme electrode
QIAO Wen-jie1, BO Cui-mei1, JIANG Shu-bo1, WANG Yi-qing1,2, LI Jun1,CHU Zhen-yu2, JIN Wan-qin2
(1. College of Electrical Engineering and Control Science, Nanjing Tech University, Nanjing 211816, China;2. State Key Laboratory of Materials-Oriented Chemical Engineering, Nanjing Tech University, Nanjing 211816, China)
An online-multi-channel detection flow path control system using a new type of enzyme biosensing electrode prepared based on Prussian Blue (PB) nanomaterials was developed for monitoring multi-component in the microbial fermentation. According to the micro-current response characteristics of enzyme biosensing electrodes, a multi-channel pump-valve synergy flow path control system was designed to reduce cross-contamination and improve equipment reliability effectively. The software program modules such as precise positioning of pipette needles, precise micro-injection and calibration detection during multi-component detection were developed according to the logic timing requirements of flow path detection. The precise positioning of the pipette needle and precise micro-injection were realized by combining the trapezoidal acceleration and deceleration algorithm and the stepping motor controlled by subdivision drive circuit. Multi-component, wide-range, fast and accurate detection was performed by independently adjusting the injection volume and calibration detection module. The experimental test results show that the system could detect glucose, lysine and lactic acid in a wide range of concentrations, and the detection accuracy was less than 2%, which can better meet the requirements of simultaneous online detection of multiple components of microbial fermentation.
enzyme biosensing electrode; multi-component online detection; flow path control system; acceleration and deceleration algorithm; micro precision injection
TP 27
A
10.3969/j.issn.1003-9015.2022.01.012
1003-9015(2022)01-0092-09
2021-03-09;
2021-05-12。
国家自然科学基金(21727818,62173178);国家重点研发计划(2019YFB1705800)。
乔文杰(1994-),男,河南商丘人,南京工业大学硕士生。
薄翠梅,E-mail:Lj_bcm@163.com
乔文杰, 薄翠梅, 蒋书波, 王轶卿, 李俊, 储震宇, 金万勤. 基于新型酶电极的微生物发酵多组分在线检测流路控制系统[J]. 高校化学工程学报, 2022, 36(1): 92-100.
:QIAO Wen-jie, BO Cui-mei, JIANG Shu-bo, WANG Yi-qing, LI Jun, CHU Zhen-yu, JIN Wan-qin. Multi-component online detection flowpath control system for microbial fermentation based on new enzyme electrode [J]. Journal of Chemical Engineering of Chinese Universities, 2022, 36(1): 92-100.

