幽门螺旋杆菌中CagA、VacA毒素与糜烂性胃炎的关系及其临床应用价值*
刘丹丹,辛 毅
安徽医科大学附属宿州医院消化内科(安徽省宿州市立医院),安徽宿州 234000
糜烂性胃炎是消化系统最常见的疾病之一,在我国检出率大约占胃镜检查的6.4%~9.8%,临床主要表现为上泛酸嗳气、腹部不适、腹胀等症状,这些与幽门螺杆菌(HP)感染、生活习惯、精神因素、自身免疫及胃酸-胃蛋白酶等密切相关。HP可通过口-口、粪-口、密切接触等多种途径传播,呈全球性感染,多不能自行清除,感染率随着年龄的增长累计升高,在我国,目前HP的感染率为42.0%~90.0%, 85.0% 以上会发展为胃炎,因此糜烂性胃炎中HP阳性早期根除问题引起广大临床医生的关注[1]。由于HP结构的多样性,其能够产生多种毒力因子,并能分泌多种高活性的酶及细胞毒素等,可以造成胃黏膜的直接损伤并产生炎性反应[2]。 HP的毒力因子较多,最主要的是空泡毒素(VacA)和细胞毒素相关蛋白(CagA),二者关系密切,而UreA 和UreB则是HP-Ⅱ型存在的标志[3]。但并非所有HP感染者均会发病,约20.0%~30.0%HP感染者可终身携带HP但未发病,超过50.0%感染者仅表现一定程度慢性炎症,10.0%~15.0%感染者可出现消化性溃疡[4-5]。碳呼气试验是通过分析呼气中14C标记的 CO2的含量来判断患者是否存在HP感染。近年来,随着经济、社会发展、工作压力的增大、饮食习惯不良,加之饮酒及煎炸食品摄入增多,糜烂性胃炎发病率逐年上升,部分患者甚至会发生癌前病变[6]。目前很多专家认为HP是导致胃癌发生的主要原因[7],但是很少研究HP-Ⅰ型中VacA、CagA阳性与糜烂性胃炎是否存在相关性。本研究目的探讨糜烂性胃炎发病风险是否与HP-Ⅰ型中VacA、CagA水平存在相关性,为其临床早期防治提供理论依据,现报道如下。
1 材料与方法
1.1研究对象 选取2020年1-12月在本院治疗的56例糜烂性胃炎患者为糜烂性胃炎组,54例慢性胃炎患者为慢性胃炎组,60例体检健康者作为健康对照组。纳入标准:参照《中国慢性胃炎共识意见(2017年,上海)》专家共识[8],患者经胃镜检查确诊为糜烂性胃炎。排除标准:(1)已知对本研究用药过敏患者;(2)妊娠或哺乳期女性。
1.2方法及结果判定 HP抗体检测标本处理:于清晨空腹抽取待测者外周静脉血2~5 mL,置试管待凝固后分离血清,采用免疫印迹试剂盒(深圳市伯劳特生物制品有限公司)进行HP抗体IgG检测。由同一实验室人员采用统一批次试剂盒对标本进行检测,检测步骤按试剂盒具体操作说明进行。结果判定116×103为CagA阳性;95×103、91×103为VacA阳性;30×103为UreA阳性,66 ×103为UreB阳性。HP-Ⅰ抗体阳性:CagA、VacA区带中任一或两种同时出现;HP-Ⅱ型抗体阳性:仅UreA和UreB区带中任一种或同时出现,未见CagA、VacA区带;碳呼气试验由本科门诊呼气试验室检测,仪器采用安徽养和医疗器械设备有限公司的YH04幽门螺旋杆菌检测仪和上海欣科医药有限公司的尿素14C胶囊,数值大于100标记为阳性。
2 结 果
2.1健康对照组与慢性胃炎组、糜烂性胃炎组临床基本资料比较 3组年龄、性别、吸烟史及糖尿病史比较,差异无统计学意义(P>0.05);3组饮酒史、高血压史、HP-Ⅰ、HP-Ⅱ型及14C呼气试验比较,差异有统计学意义(均P<0.05),见表1。

表1 3组一般临床资料比较
2.2多元Logistic回归分析 经多元Logistic逐步回归分析,以是否为影响糜烂性胃炎危险因素作为二分类因变量,纳入回归方程的自变量因素有:饮酒史、高血压史、HP-Ⅰ、HP-Ⅱ型及14C呼气试验。结果显示,14C呼气试验、饮酒史、HP-Ⅰ型是影响糜烂性胃炎独立危险因素,差异有统计学意义(P<0.05),其中HP-Ⅰ型相对危险度(OR)高达8.126,见表2。

表2 Hp感染危险因素的多元 Logistic 回归分析参数
2.3HP-Ⅰ型、14C呼气试验及饮酒史预测糜烂性胃炎的价值及ROC曲线分析 综合临床诊断及相关辅助检查为金标准,以误诊率(1-特异度)为横坐标,灵敏度为纵坐标,在SPSS22.0 软件上对HP-Ⅰ型、14C呼气试验及饮酒史来绘制ROC曲线图(图1),并计算AUC及约登指数,见表3,结果显示,HP-Ⅰ型的AUC最高,为0.761,约登指数达0.523,其次为14C呼气试验AUC为0.726,饮酒史AUC最低,为0.710,差异有统计学意义(P<0.05)。

表3 HP-Ⅰ型、14C呼气试验及饮酒史对糜烂性胃炎的预测价值
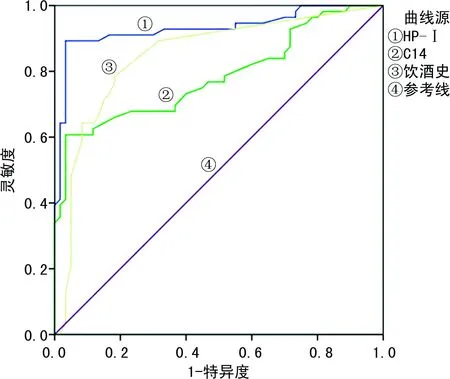
图1 HP-Ⅰ型、14C呼气试验及饮酒史预测糜烂性胃炎独立危险因素 ROC 曲线图
2.4健康对照组与慢性胃炎组、糜烂性胃炎组CagA、VacA 抗体阳性表达情况分析 在3组研究对象中,糜烂性胃炎组中CagA+和VacA+阳性率显著高于慢性胃炎组、健康对照组,差异有统计学意义(χ2=33.106,P<0.05),糜烂性胃炎组CagA+、VacA+阳性率与慢性胃炎组、健康对照组比较,差异无统计学意义(χ2=3.298、2.290,P>0.05);但是糜烂性胃炎组中CagA-和VacA-型阴性率明显低于慢性胃炎组、健康对照组,差异有统计学意义(χ2=43.285,P<0.05),见表4。
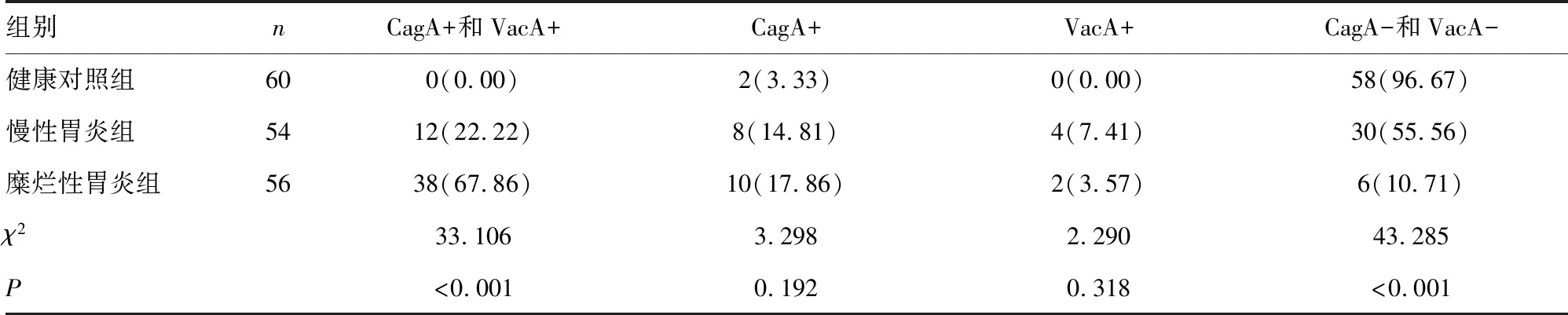
表4 健康对照组、慢性胃炎组、糜烂性胃炎组CagA、VacA抗体的表达[n(%)]
3 讨 论
HP呈全球性感染,感染会导致多种消化系统疾病,与人们饮食模式、生活方式改变等诸多因素影响有关。李萍等[9]认为,HP是糜烂性胃炎发病的重要因素,多见于胃窦部,病因比较复杂,可能与饮食习惯、细菌感染、精神因素等有关,但是目前对其病因及发病机制、原理尚未阐明。免疫印迹法可以同时检测HP-IgG中CagA、VacA、UreaA及UreaB 抗体,不仅可以判断是否感染HP,同时还可以将对HP的菌株进行分型分析[10]。14C呼气试验作为HP非侵入性诊断金标准已获得广泛应用,但因为其检测极易受到药物如质子泵抑制剂(PPI)、抗菌药物等影响,不能准确判断现有感染还是既往感染[11]。
本研究结果显示,健康对照组、慢性胃炎组、糜烂性胃炎组饮酒史、高血压史、HP-Ⅰ、HP-Ⅱ型及14C呼气试验相比较,差异有统计学意义(均P<0.05),这表明饮酒史、高血压史、HP-Ⅰ、HP-Ⅱ型及14C呼气试验阳性是导致糜烂性胃炎重要影响因素。进一步采用多元 Logistic 回归分析显示,14C呼气试验、饮酒史、HP-Ⅰ型抗体是影响糜烂性胃炎发病的独立危险因素,差异有统计学意义(P<0.05),其中HP-Ⅰ型抗体相对危险度(OR)高达8.126,这些研究表明,HP-Ⅰ型抗体对早期预测糜烂性胃炎危险因素具有一定的临床意义,这与杨丽君等[10]研究一致。周冷潇等[12]认为,HP-Ⅰ型感染与糜烂性胃炎的发生关系密切,CagA及VacA可造成胃黏膜上皮细胞的损伤,原因可能是CagA能够降解基底膜,导致阻碍上皮细胞的分化,从而进一步影响上皮细胞黏附,导致胃溃疡。而VacA会损伤胃黏膜[13],使患者胃部发生糜烂或溃疡。
此外,ROC曲线分析显示,HP-Ⅰ型的AUC最高,为0.761,约登指数也是最高,为0.523,其次为14C呼气试验AUC为0.726,灵敏度高达89.30,进一步提示HP-Ⅰ型在预测糜烂性胃炎风险因素时,比14C呼气试验检测优越,这可能与14C呼气试验易受外部环境影响,如果胃大部切除术、胆汁反流等都可能导致14C呼气试验假阴性[13]。通过糜烂性胃炎阳性率比较发现,糜烂性胃炎组CagA+和VacA+阳性率显著高于慢性胃炎组、健康对照组,差异有统计学意义(χ2=33.106,P<0.05);而糜烂性胃炎组CagA+、VacA+单阳性率与慢性胃炎组、健康对照组比较,差异无统计学意义(χ2=3.298、2.290,P>0.05),这与何媛等[14]研究一致,认为不同HP菌株基因型的致病机制不同,HP-Ⅰ型菌株为胃部疾病的主要致病菌株,且主要是以 CagA+和(或)VacA+抗体阳性表达最为常见。CagA及VacA双阳性可造成胃黏膜上皮细胞的损伤[15],导致糜烂性胃炎发生。
由于CagA、VacA阳性HP株型均属高毒株,致病力强,感染后可能会致胃黏膜组织细胞损害[16],并影响胃壁细胞分泌功能,胃酸分泌减少可为亚硝酸盐等致癌物质形成、集聚创造有利条件,加速胃黏膜正常组织细胞恶性演变过程。
本研究仍存在不足之处,纳入样本量有限、也缺乏长期随访,可能会对研究结果产生影响;且没有考虑到人群、区域差异,也可能会使研究结果产生一定偏差。
综上所述,HP-Ⅰ型、CagA、VacA阳性感染与糜烂性胃炎发病密切相关,是糜烂性胃炎发病独立危险因素,这为其临床早期防治提供理论依据及重要临床应用价值,也为以后精准治疗措施提供理论基础。

