基于化学修饰法制备油溶性栀子蓝色素及其性能表征研究
郝旭,郜亚昆,刘国荣*
(1.北京食品营养与人类健康高精尖创新中心 北京市食品添加剂工程技术研究中心 北京工商大学,北京 100048;2.天津市和平区市场监督管理局,天津 300041)
栀子蓝色素是GB 2760-2014《食品安全国家标准 食品添加剂使用标准》准许使用的天然色素之一,通过栀子果实内部的京尼平苷经β-葡萄糖苷酶水解反应后得到京尼平,进而再和伯胺化合物进行一系列的聚合和重排反应制得,其具备耐酸、耐碱和耐高温的特性,可以广泛用于食品、药品及化妆品领域[1]。栀子蓝色素所含有的京尼平有很好的保健功效,具备一定抑菌活性的同时具有抑制肿瘤生长、疏通血管和调节血糖的生理活性,受到食品和医学保健领域的广泛关注,在食品加工领域可以保证安全性的前提下,有效改善食品的色泽[2]。其主要通过与黄色素如栀子黄色素复配出不同色调的绿色,还可以与红色素如甜菜红色素和玫瑰茄红色素复配出不同色调的紫色进而用于硬糖、饼干、蛋糕和蔬菜类罐头食品的着色,特别被用作天然无毒的调味品添加于饮料、果汁、布丁和冰淇淋等食品中[3]。因其着色效果出色,受到食品加工行业和消费大众的青睐。
栀子蓝色素极性强,易溶于水,颜色呈现亮蓝色,染色性能好。但其不溶于油脂及其在光照下易发生褪色的缺点,直接影响产品在生产、储存及销售过程中的感官品质,限制了栀子蓝色素的广泛应用[4]。
对于色素本身已经具有的官能团,可运用化学修饰法通过化学反应来增添相应的化学基因,起到改变色素自身性质的作用,进而使得色素的溶解性发生变化,改善其稳定性[5]。茹先古丽·买买提依明等[6]和张兆英等[7]分别通过研究西红花色素和火龙果果皮红色素发现在强光和高温环境下色素极易分解,而卢佳云等[8]制备得到的川陕金莲花黄色素却具备较好的耐热性,说明色素的耐热性和耐光照性等受到色素分子结构的影响。Cruz等[9]通过运用原花青素和硬脂酰氯在一定条件下可发生的酯化反应,在进行纯化操作后获得亲脂性酰基化原花青素,并具有较高的得率。硬脂酰氯含有的酰氯基团可以发生酯化反应,通过改性引入长碳链来修饰其分子结构以改变其亲水特性,目前硬脂酰氯已经作为良好的改性材料用于茶多酚、莲原花青素和核桃青皮多酚等物质的化学改性。利用化学改性法可以在栀子蓝色素中引入相关疏水性基团,并封闭部分亲水性基团,使得分子极性显著减低,从而将色素的溶解范围进一步扩大。
在本试验研究中,油溶性栀子蓝色素的制备采用了硬脂酰氯酯化法,利用单因素逐级试验优化工艺条件,基于紫外-可见光谱、扫描电镜及傅里叶红外光谱对其进行定性表征;通过分析栀子蓝色素衍生物的溶解性及其在不同温度和光照条件下所具有的稳定性能,对化学修饰法在关于调整改善栀子蓝色素稳定性及溶解性两方面的应用可行性进行科学评价。
1 材料与方法
1.1 材料与试剂
水溶性栀子蓝色素:江苏迁润生物技术有限公司;硬脂酰氯(纯度≥97%):上海麦克林生化科技有限公司;乙腈(色谱纯):赛默飞世尔科技有限公司;硅胶板GF254(50 mm×100 mm)、玻璃层析缸、硅胶(200~300目):青岛海洋化工厂;60~90 ℃沸程石油醚:北京化工厂;氢氧化钠、乙醇、二氯甲烷、三乙胺、乙酸乙酯等其他试剂均为国产分析纯。
1.2 主要仪器与设备
BSA2245型分析天平 北京赛多利斯科学仪器有限公司;PHS-3C精密pH计 上海仪电科学仪器股份有限公司;SHZ-A水浴恒温振荡器、离心机 上海博迅实业有限公司;UV-3600 plus型紫外可见光分光光度计 日本岛津公司;CM-3600A分光测色计 柯尼卡美能达投资有限公司;IKA RV10旋转蒸发仪、恒温加热磁力搅拌器 德国IKA公司;玻璃层析柱(26 mm×300 mm) 北京欣维尔玻璃仪器有限公司。
1.3 试验方法
1.3.1 油溶性栀子蓝色素的制备及纯化
采用酯化法制备油溶性栀子蓝色素:先使用分析天平精确称取一定质量的水溶性栀子蓝色素,将其放入三颈瓶中,然后加入一定体积的二氯甲烷使其充分溶解。在0 ℃下按一定比例分别向三颈瓶中加入硬脂酰氯和三乙胺,置于带有磁力搅拌器的恒温加热器中,并在一定温度下加热回流一定时间,反应结束后冷却至室温。采用石油醚对上述步骤制得的栀子蓝色素衍生物萃取3次,每次置于4 ℃冰箱中萃取0.5 h,4 ℃下12000 r/min离心15 min,将3次提取液合并;将萃取后的栀子蓝色素衍生物加入层析柱中,以V正己烷∶V乙酸乙酯为1∶2为洗脱剂进行洗脱除去杂质,最后将色素洗脱出来,旋蒸除去正己烷及乙酸乙酯,然后将其放置在40 ℃的烘箱中进行烘干,直至恒重,从而得到纯化后的油溶性栀子蓝色素。
1.3.2 油溶性栀子蓝色素制备工艺条件优化
在制备栀子蓝色素衍生物的过程中,主要有三方面因素:反应物的比例和反应的温度条件以及反应时间。将获得的栀子蓝色素衍生物的产量以及其具备的色价作为考察指标进一步展开单因素逐级试验,以此来对影响色素衍生物形成的主导因素进行确定。
1.3.2.1 不同反应物比例对油溶性栀子蓝色素产量和色价的影响
在分析天平上量取40 mg(0.1 mmol)的水溶性栀子蓝色素,将其溶于3 mL二氯甲烷,加入三颈瓶中,在0 ℃下按1∶3∶3、1∶4∶4、1∶5∶5、1∶6∶6、1∶7∶7(n水溶性栀子蓝色素∶n硬脂酰氯∶n三乙胺)的摩尔比例分别加入硬脂酰氯和三乙胺置于30 ℃恒温加热磁力搅拌器中,并加热回流24 h,反应结束后冷却至室温,纯化并进行干燥,测定所得色素的产量和色价。
1.3.2.2 不同反应温度对油溶性栀子蓝色素产量和色价的影响
称取40 mg (0.1 mmol)的水溶性栀子蓝色素,将其溶于3 mL二氯甲烷,加入三颈瓶中,在0 ℃下按1∶5∶5(n水溶性栀子蓝色素∶n硬脂酰氯∶n三乙胺)的摩尔比加入硬脂酰氯和三乙胺,分别置于30,40,50,60 ℃恒温加热磁力搅拌器中,并加热回流24 h,反应结束后冷却至室温,纯化并进行干燥,测定所得色素的产量和色价。
1.3.2.3 不同反应时间对油溶性栀子蓝色素产量和色价的影响
在分析天平上量取40 mg(0.1 mmol)的水溶性栀子蓝色素,将其溶于3 mL二氯甲烷中,加入三颈瓶中,在0 ℃下按1∶5∶5(n水溶性栀子蓝色素∶n硬脂酰氯∶n三乙胺)的摩尔比加入硬脂酰氯和三乙胺,置于40 ℃恒温加热磁力搅拌器中,并加热回流18,24,30,36,42 h,反应结束后冷却至室温,纯化、干燥,测定所得色素的产量和色价。
1.3.3 最大吸收波长的测定
使用分析天平分别称取油溶性栀子蓝色素和水溶性栀子蓝色素各100 mg,将这两种色素分别溶解在石油醚和超纯水中,并进行适当倍数的稀释,将石油醚和超纯水作为参比物,运用紫外-可见分光光度计对色素溶液在400~700 nm区间内的可见吸收光谱进行测定,进而明确油溶性栀子蓝色素所具有最大吸收波长。
1.3.4 色素的色价测定
先取出油溶性栀子蓝色素粉末及水溶性栀子蓝色素,分别在分析天平上称取一定质量的粉末物,将油溶性栀子蓝色素在石油醚中溶解,而水溶性栀子蓝色素在超纯水中溶解,并稀释至适当倍数,用容量瓶定容后,采用色差仪测定其色度,以1 cm 玻璃比色皿分别在超纯水和石油醚做参照下,采用紫外分光光度计在最大吸收波长处下测定其吸光值,色价参考陈思佳[10]的方法进行测定,代入下式进行计算:
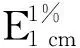
1.3.5 色素的色值、色差及色素残留率的测定
色素的色值(CIELAB 体系),即L*、a*、b*值使用色差计进行测定,经不同处理后的色差值计算公式如下[11-12]:
明度差:ΔL*=LS*-LT*。
红/绿差:Δa*=aS*-aT*。
黄/蓝差:Δb*=bS*-bT*。
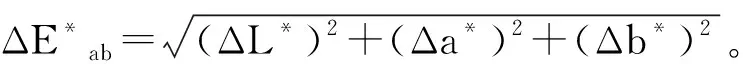
式中:下标S代表处理后样品,下标T代表处理前样品。
在λmax下测定栀子蓝色素及其衍生物的吸光值A[13],根据公式计算色素残留率:
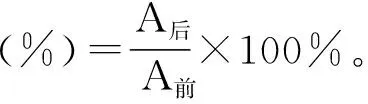
式中:A后表示试验完成后,在λmax处油溶性栀子蓝色素具有的吸光值;A前表示试验开始前,该色素在最大吸收波长处所测得的吸光值。
1.3.6 微观形态(SEM)
将干燥后的水溶性栀子蓝色素和油溶性栀子蓝色素粉末经点样、喷金后,采用Hitachi S-3400N型扫描电子显微镜观察两种栀子蓝色素微粒间的微观结构差异。
1.3.7 傅里叶红外光谱检测(FTIR)
分别称取3 mg水溶性栀子蓝色素和油溶性栀子蓝色素色素粉末,与300 mg溴化钾粉末充分混合研磨至100目,取少量混合物进行压片。采用DTGS检测器,光谱范围为4000~400 cm-1,分辨率为4 cm-1,扫描时扣除水和空气的干扰。
1.3.8 栀子蓝色素衍生物的溶解性
先称取质量相同的油溶性栀子蓝色素和水溶性栀子蓝色素,然后量取体积相同的不同溶剂,观察上述两种色素在溶剂中的溶解性。
1.3.9 栀子蓝色素衍生物的稳定性
1.3.9.1 光照稳定性
将水溶性栀子蓝色素和油溶性栀子蓝色素粉末分别溶于超纯水和石油醚中,分别在590 nm和 624 nm处将吸光值调整为0.80,然后分别将其放置在下面4种光照条件下7 d:(1)阳光照射强度(40000 lux);(2)灯光直射强度(13000 lux);(3)室内散射强度(300 lux);(4)阴暗避光条件(对照)。待试验结束后分别对溶液取样,进行色调以及吸光值的测量,根据测量结果进行色素色差以及残留率的计算。
1.3.9.2 温度稳定性
将水溶性栀子蓝色素和油溶性栀子蓝色素粉末分别溶于超纯水和石油醚中,分别在590 nm和 624 nm处调吸光值A=0.80,分别在4,25(室温),40,60,80,100,120 ℃ 7个条件下避光放置24 h,然后取样并对色素溶液进行色素色调以及吸光值的测定,根据测量结果对色素色差和残留率展开计算。
1.3.10 数据处理与分析
每一个试验需重复进行3次,然后选用SPSS 25软件展开相应的数据分析。
2 结果与分析
2.1 栀子蓝色素衍生物制备工艺条件优化
2.1.1 反应物比例对油溶性栀子蓝色素产量和色价的影响
由图1可知,在水溶性栀子蓝色素添加量为40 mg,反应物比例(水溶性栀子蓝色素∶硬脂酰氯∶三乙胺)为1∶5∶5(摩尔比)时,油溶性栀子蓝色素的产量最高,为(308±8.6)mg,色价最高,为23.9±0.9。之后,随反应物比例的增加,栀子蓝色素衍生物的产量不再增加,色价也随之降低,说明此时水溶性栀子蓝色素与硬脂酰氯和三乙胺已基本反应完全,反应物的最佳比例为水溶性栀子蓝色素∶硬脂酰氯∶三乙胺 1∶5∶5(摩尔比)。
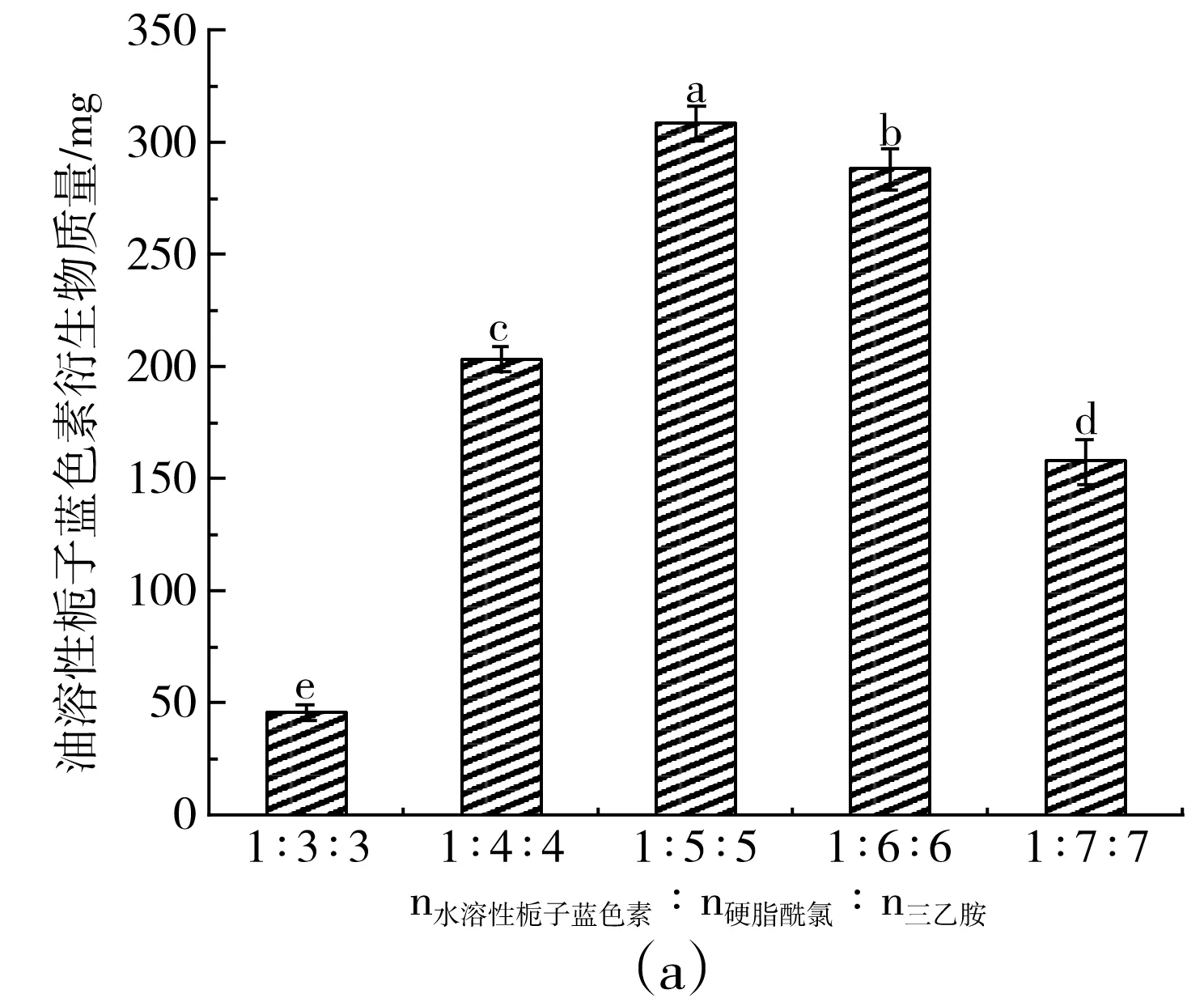
图1 不同反应物比例对栀子蓝色素衍生物产量(a)和色价(b)的影响Fig.1 Effect of molar ratios of reactants on yield (a) and color value (b) of gardenia blue pigment derivatives
2.1.2 反应温度对油溶性栀子蓝色素产量和色价的影响
由图2 可知,反应温度在30 ℃时,水溶性栀子蓝色素添加量为40 mg可制备得到的油溶性栀子蓝色素的产量最高,为(422±7.4) mg,但产物色价仅为7.3±0.2;而在反应温度为40 ℃时,制备得到的油溶性栀子蓝色素的质量为(309±6.8) mg,色价最高,为23.9±0.6,随着反应温度的增加,栀子蓝色素衍生物的产量开始下降,色价也降低明显,推测可能是由于反应温度较高造成色素分解,因此栀子蓝衍生物制备的最佳反应温度为40 ℃。
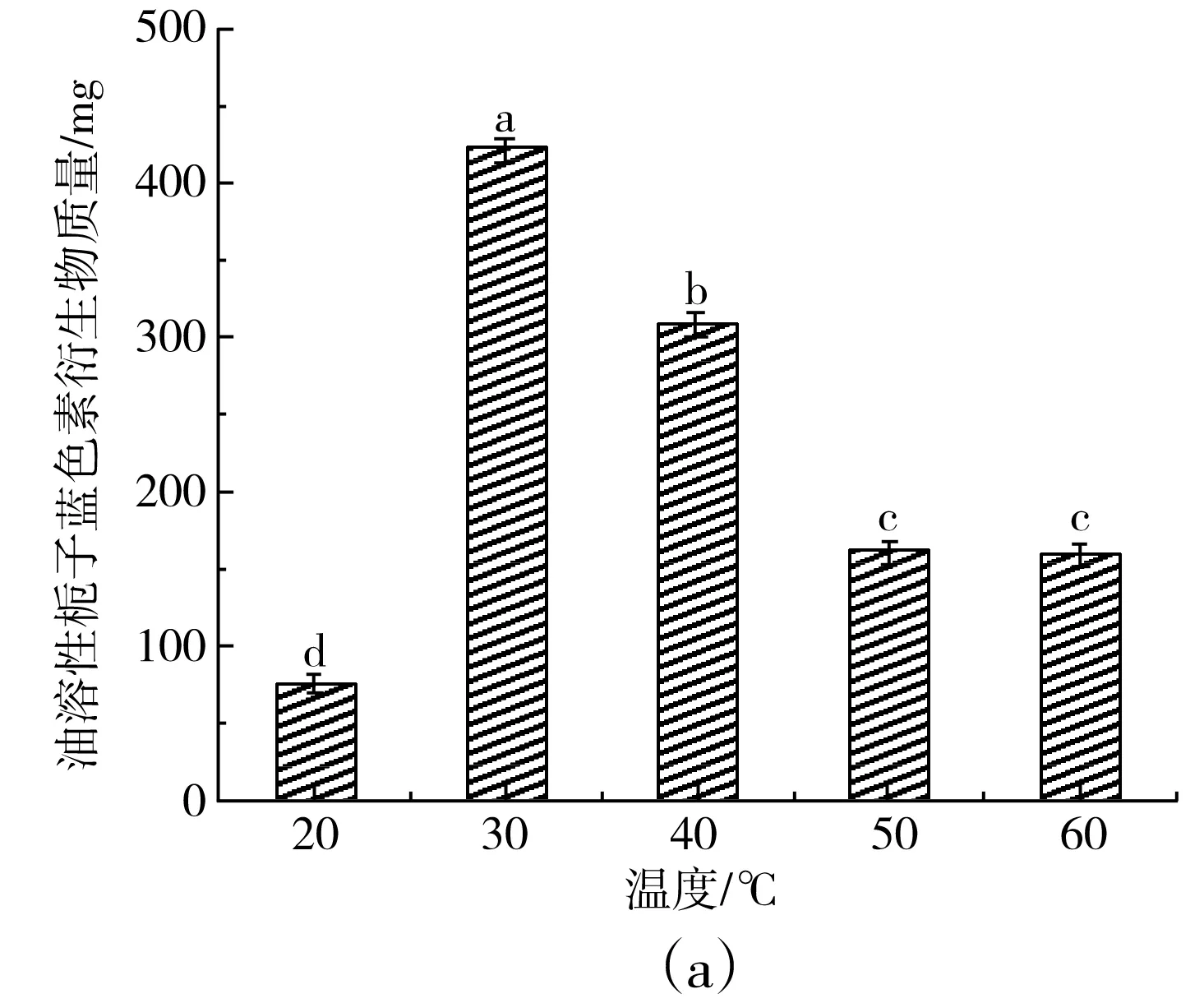
图2 不同反应温度对栀子蓝色素衍生物产量(a)和色价(b)的影响Fig.2 Effect of reaction temperatures on yield (a) and color value (b) of gardenia blue pigment derivatives
2.1.3 反应时间对油溶性栀子蓝色素产量和色价的影响
由图3可知,当反应时间达到30 h时,经反应得到的油溶性栀子蓝色素产量为(402±7.1) mg,且随着反应时间的增加,衍生物产量不再增加;而衍生物色价在反应时间为30 h时最高,为26.3±0.7,随着反应时间的增加,色素的色价不再升高反而开始下降,表明此时的水溶性栀子蓝色素和硬脂酰氯两者基本上已经反应完全,同时色素没有出现分解的情况。因此,30 h是该化学反应的最佳反应时间。
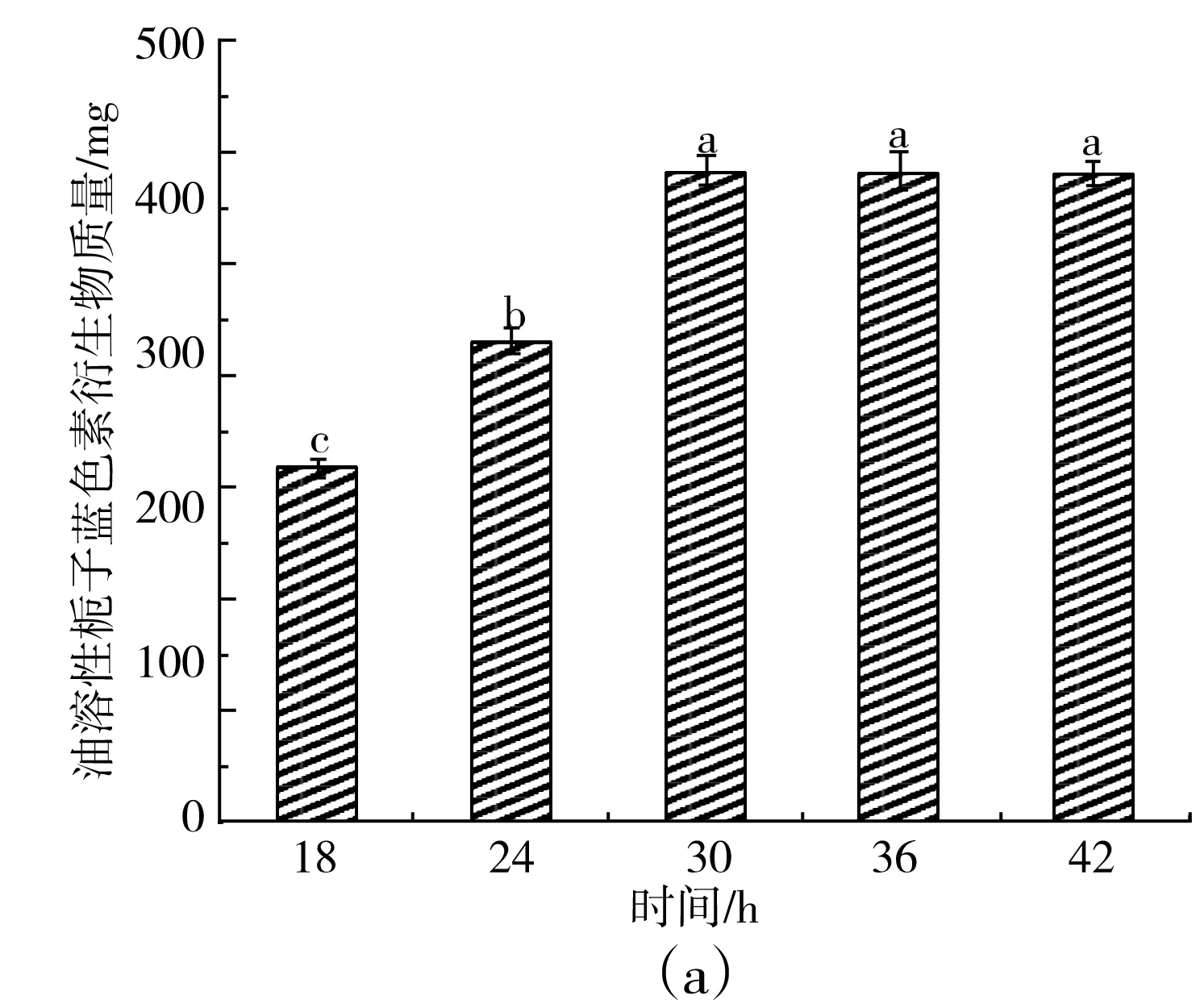
图3 不同反应时间对栀子蓝色素衍生物产量(a)和色价(b)的影响Fig.3 Effect of reaction time on yield (a) and color value (b) of gardenia blue pigment derivatives
2.1.4 验证试验
由上述单因素试验得到制备油溶性栀子蓝色素的优化后工艺条件:反应物摩尔比例n水溶性栀子蓝色素∶n硬脂酰氯∶n三乙胺为1∶5∶5,反应温度为40 ℃,反应时间为30 h。在上述反应条件下展开相应的验证试验,最终得到油溶性栀子蓝色素的质量为(402±8.2) mg,色价为 26.3±0.6,油溶性栀子蓝色素呈现深蓝绿色粉末,溶液为蓝绿色。
2.2 油溶性栀子蓝色素的紫外-可见吸收光谱图
两种栀子蓝色素的紫外-可见吸收光谱图见图4。
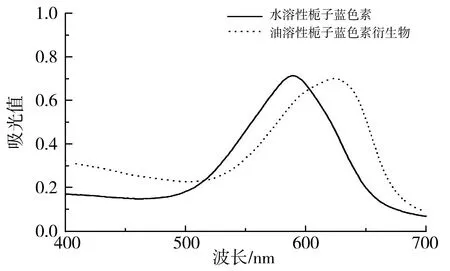
图4 水溶性和油溶性栀子蓝色素的紫外-可见吸收光谱图Fig.4 UV-vis spectra of water-soluble and oil-soluble gardenia blue pigments
由图4可知,水溶性栀子蓝色素的最大吸收波长(λmax)为590 nm,油溶性栀子蓝色素的λmax为624 nm。肉眼所见蓝色及蓝绿色物质所具有的紫外-可见吸收波长区间范围是640~580 nm,由此可见,上述两种色素都是蓝色素,由于油溶性栀子蓝色素的化学改性使其化学结构出现了变化,所以改性后的色素衍生物所具有的最大吸收峰出现了红移(即最大吸收峰向长波长方向移动)。
2.3 微观形貌分析(SEM)
采用扫描电子显微镜可以观察色素样品微粒的微观结构。水溶性栀子蓝色素(a)及油溶性栀子蓝色素(b)在放大20000倍下的扫描电镜图见图5。

图5 两种栀子蓝色素的扫描电镜图Fig.5 Scanning electron microscope images of two gardenia blue pigments
由图5可知,两种色素的立体形态截然不同,水溶性栀子蓝色素为不规则状,而油溶性栀子蓝色素则为片状结构,说明通过化学改性使得栀子蓝色素衍生物的化学结构发生了变化,进而影响其结构形态产生了改变。
2.4 FTIR分析
对水溶性栀子蓝色素和油溶性栀子蓝色素进行红外光谱检测,结果见图6。
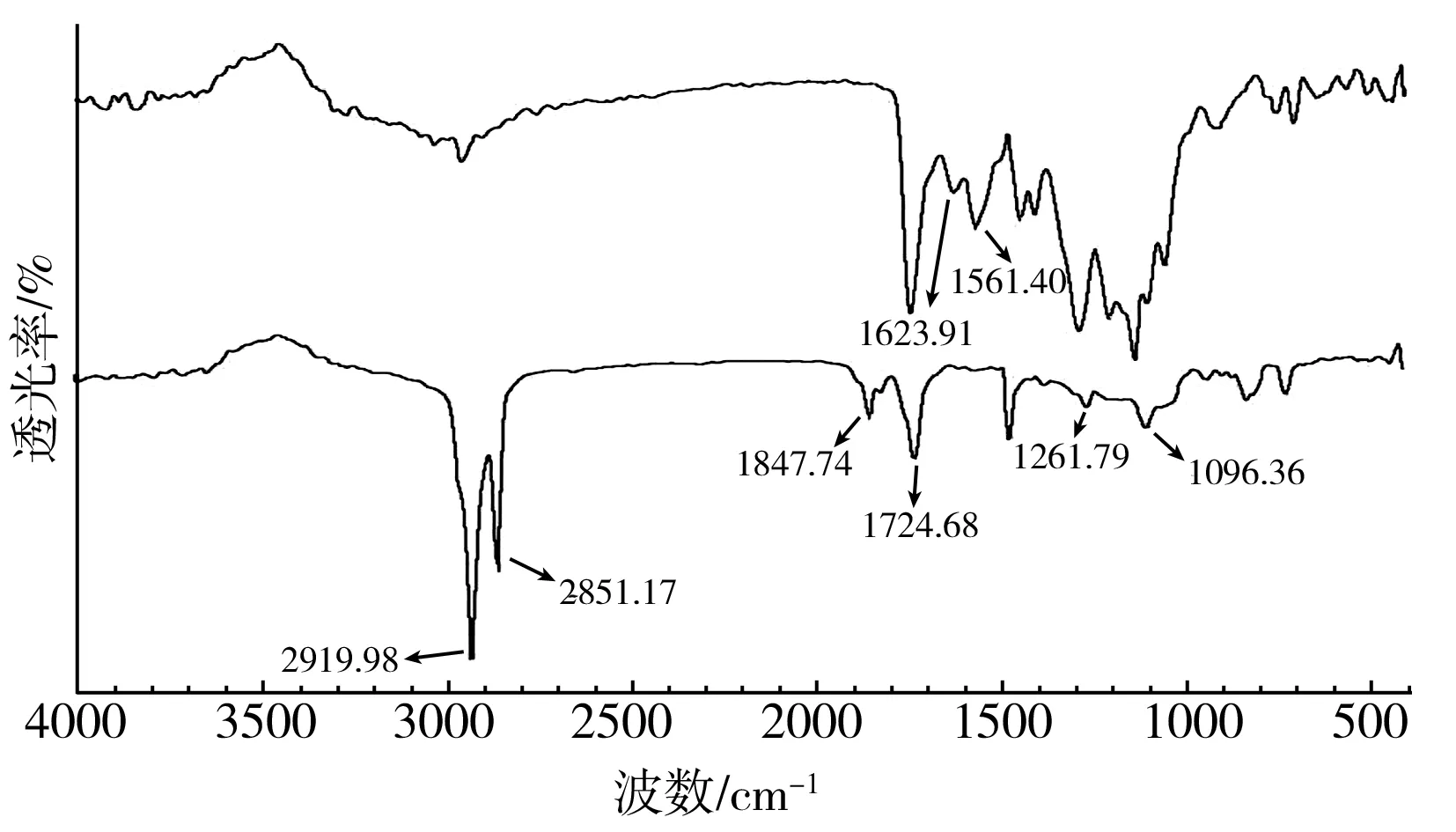
图6 水溶性栀子蓝色素(a)和油溶性栀子蓝色素(b)的红外光谱图Fig.6 FT-NIR spectra of water-soluble gardenia blue pigment(a) and oil-soluble gardenia blue pigment (b)

2.5 溶解性分析
水溶性栀子蓝色素和油溶性栀子蓝色素在不同溶剂中的溶解性见表1。
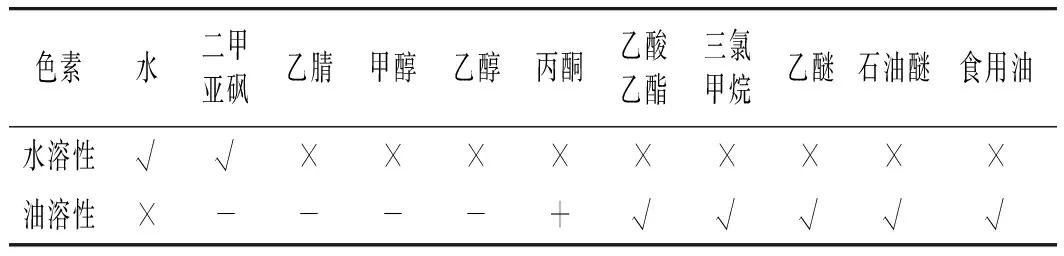
表1 两种栀子蓝色素在不同溶剂中的溶解性Table 1 The solubility of two gardenia blue pigments in different solvents
由表1可知,经化学改性后,油溶性栀子蓝色素可溶于乙酸乙酯和食用油等弱极性的脂溶性溶剂,表明通过化学改性一定程度上封闭了栀子蓝色素的亲水性基团,使得通过硬脂酰氯酯化法制得的油溶性栀子蓝色素具有较好的脂溶性。栀子蓝色素衍生物溶解性与红外光谱结果相印证,这是由于通过硬脂酰氯酯化改变了栀子蓝色素的分子结构,在栀子蓝色素分子中引入了酯基并且增加了疏水性烷基,降低了栀子蓝色素衍生物与油脂间的极性差异[15],从而提高了两种物质间的互溶程度。
2.6 稳定性分析
2.6.1 光照稳定性
水溶性栀子蓝色素及油溶性栀子蓝色素放置在下面4种光照条件下:(1)阳光照射强度(40000 lux);(2)灯光直射强度(13000 lux);(3)室内散射强度(300 lux);(4)阴暗避光(对照),得到的光照稳定性绘制结果见图7。
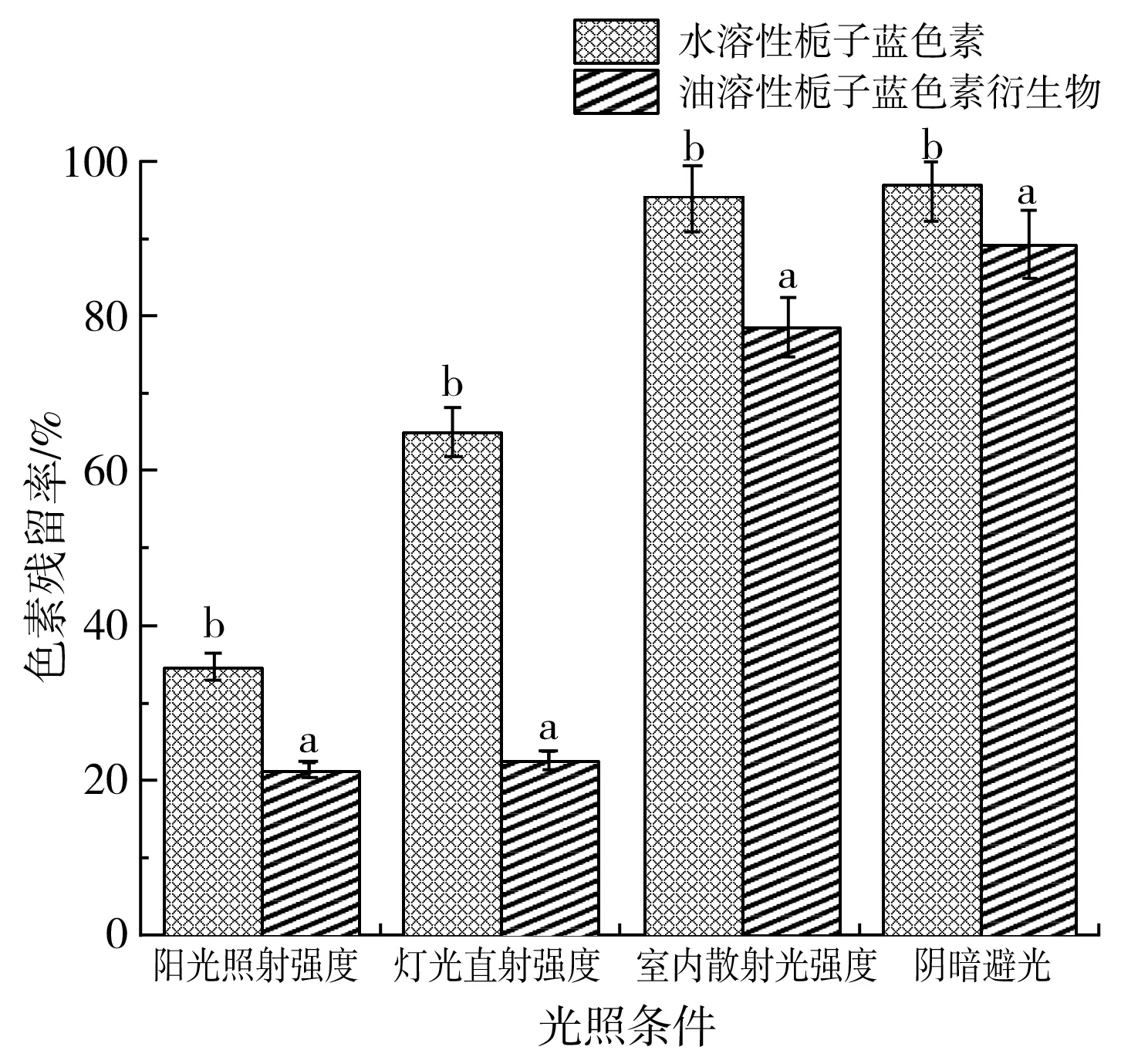
图7 两种栀子蓝色色素在不同光照条件下的稳定性Fig.7 The stability of two gardenia blue pigments under different light conditions
由图7可知,在阳光照射强度、灯光直射强度、室内散射光强度、阴暗避光条件下处理7 d后的油溶性栀子蓝色素稳定性显著低于水溶性栀子蓝色素;油溶性栀子蓝色素对光最不稳定,在阳光照射和灯光直射7 d时色素残留率仅为21.2%和22.5%,而在室内散射和阴暗避光的条件下残留率则为79.8%和88.6%。张芳等[16]研究了憎水性栀子蓝色素的稳定性,结果表明,在阴暗避光条件下栀子蓝色素衍生物的稳定性较好,静置28 d之后色素残留率维持在52.8%;周庆新等[17]对栀子红色素的光稳定性进行了测定,发现经强光照射处理后,其吸光值显著下降,而在室内自然光、紫外灯照射和避光条件下,其吸光度无明显变化。此外,色差分析结果(见表2)与色素残留率结果基本保持一致,在4种光照条件下,两种色素的亮度差、绿值差、蓝值差、总色差均有明显差异(P<0.05),油溶性栀子蓝色素在4种光照条件处理7 d后的亮度、绿值、蓝值均变化明显,总色差较大。陈峰等[18]也发现室外自然光对栀子蓝色素具有一定的影响,避光条件下稳定性良好,栀子蓝色素残留率可维持在较高水平。因此,通过化学修饰法得到的油溶性栀子蓝色素在室内散射光和阴暗避光条件下的稳定性明显好于阳光照射和灯光直射条件下的稳定性。
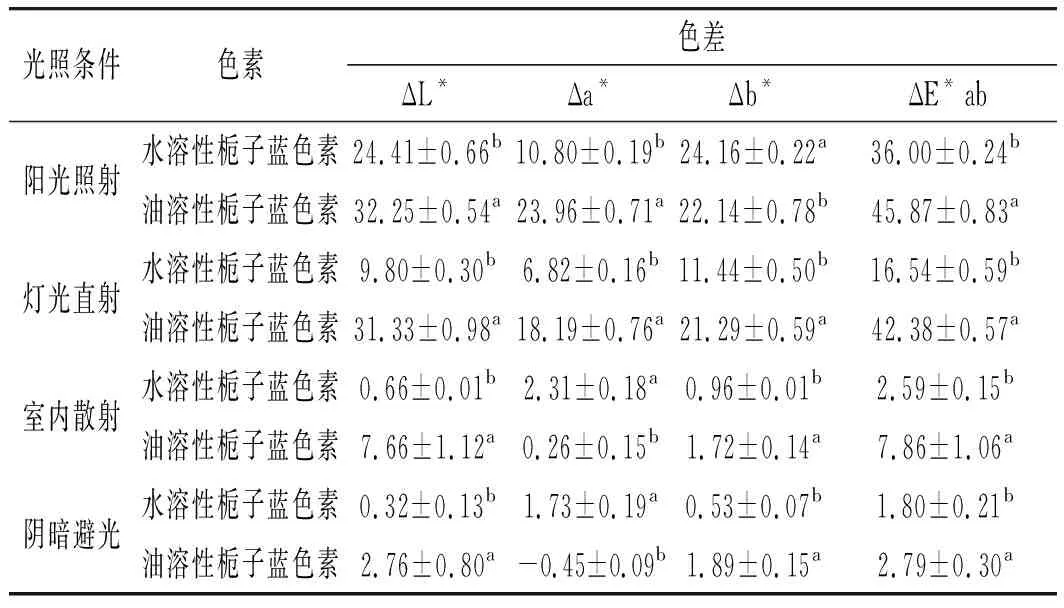
表2 两种栀子蓝色素在不同光照条件下的色差变化Table 2 The color differences of two gardenia blue pigments under different light conditions
2.6.2 温度稳定性
水溶栀子蓝色素和油溶性栀子蓝色素分别在4,40,60,80,100,120,25 ℃(室温对照)温度条件下的稳定性结果见图8。
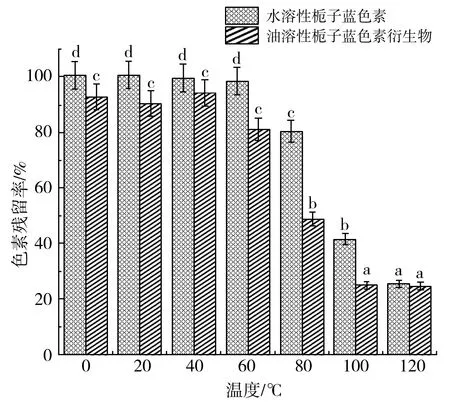
图8 两种栀子蓝色素在不同温度条件下的稳定性Fig.8 The thermal stability of two gardenia blue pigments at different temperatures
由图8可知,油溶性栀子蓝色素在80~120 ℃条件下,保温24 h后的残留率明显低于水溶性栀子蓝色素(P<0.05),而4~60 ℃保温24 h后的残留率略低于水溶性栀子蓝色素(P>0.05)。油溶性栀子蓝色素稳定性在4,25,40,60 ℃条件下色素残留率分别为91.8%、90.2%、94.5%和79.6%。刘兰香等[19]研究了油溶性胭脂红酸衍生物的稳定性,制备所得的5种油溶性胭脂红酸衍生物的光及热稳定性良好,Cu2+、Fe3+和Al3+可使色素产物发生褪色,本研究制备的油溶性栀子蓝色素则在较高温度下稳定性变差。此外,色差分析结果(见表3)与色素残留率结果基本一致,在4~60 ℃条件下,油溶性栀子蓝色素与水溶性栀子蓝色素的亮度差、蓝值差和总色差有明显差异(P<0.05)。油溶性栀子蓝色素稳定性的研究结果与罗义发等[20]发现的低于室温的条件下放置对栀子蓝色素稳定性影响较低的结论相一致。因此,油溶性栀子蓝色素在4,25,40 ℃等较低温条件下的稳定性较好,环境温度越高,制备所得的油溶性栀子蓝色素的稳定性均随之降低。
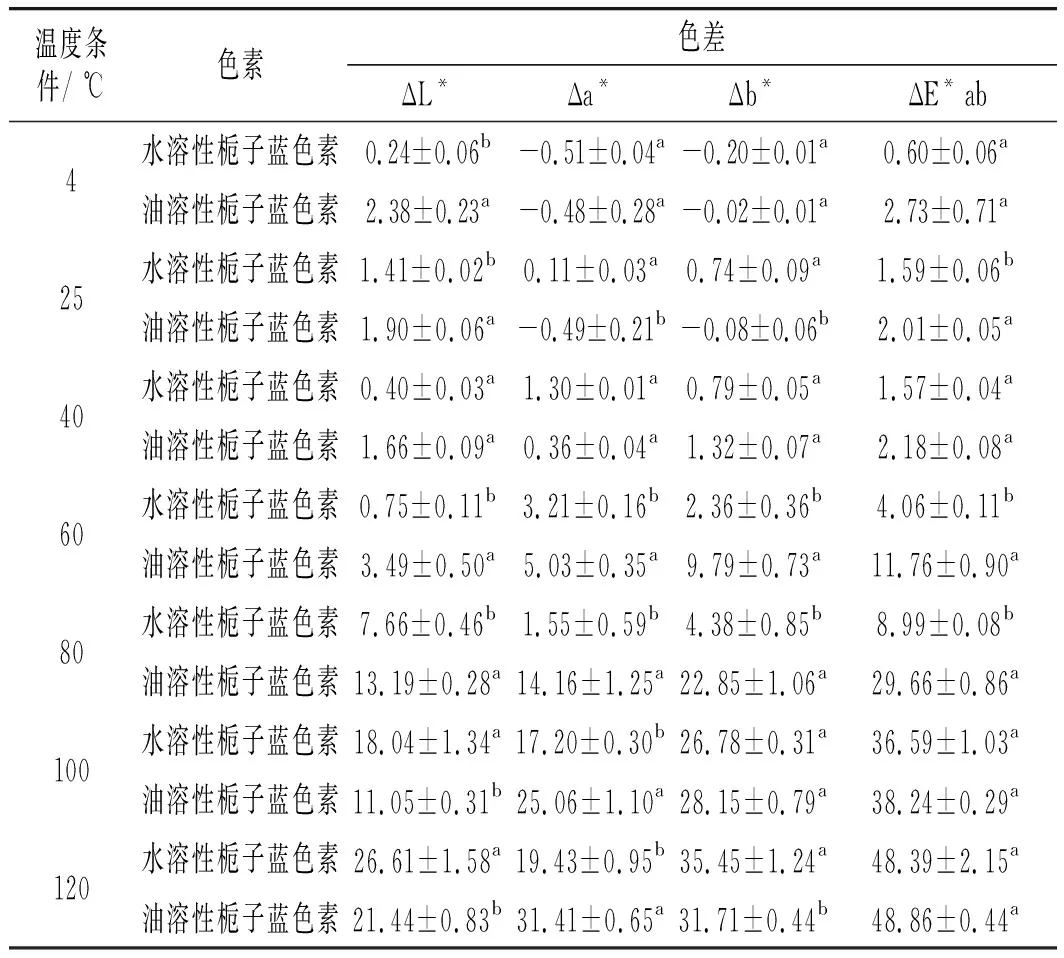
表3 两种栀子蓝色素在不同温度下的色差Table 3 The color differences of two gardenia blue pigments at different temperatures
3 结论

在接下来的研究中,试验应深入探索栀子蓝色素与硬脂酰氯酯化反应的动力学特性、可能出现的副产物及油溶性栀子蓝的化学结构,从而更好地理解油溶性栀子蓝色素的形成过程,并为减少副产物生成、提高色素的稳定性提供理论依据。

