注射用克林霉素磷酸酯质量分析
李香荷 张冬 王强 王韵 田兰 高燕霞
(河北省药品医疗器械检验研究院,石家庄 050200)
克林霉素磷酸酯(clindamycin phosphate)为化学半合成的克林霉素前药,在体外无抗菌活性,进入机体后在碱性磷酸酯酶作用下水解为克林霉素而发挥抗菌活性[1]。克林霉素作用于敏感菌核糖体的50 S亚基,抑制细菌细胞的蛋白质合成,可作为对β-内酰胺类抗生素过敏时的替代药物[2]。临床主要用于治疗革兰阳性菌所致的呼吸道、耳鼻喉系统、皮肤软组织、泌尿系统等感染,还可用于厌氧菌引起的各种感染性疾病。不良反应主要为肾功能损害和血尿。
克林霉素磷酸酯注射液为美国法玛西亚普强公司(Pharmacia and Upjohn Company,即现在的辉瑞制药)研发,在1982年上市,其规格为2 mL:0.3 g。1994年,华北制药厂的仿制药被批准在国内上市。目前克林霉素磷酸酯制剂国产批准文号258个,剂型包括:胶囊剂、片剂、注射剂、凝胶剂、栓剂和阴道乳膏剂。注射用克林霉素磷酸酯批准文号103个,生产企业36家,规格有:0.15、0.25、0.3、0.4、0.45、0.5、0.6、0.75、0.9和1.2 g。
克林霉素磷酸酯原料药收载于《中国药典》2020版、USP44、EP11.0、BP2021和JP2021,注射用粉针剂各国药典均未收载。目前国内执行国家药品标准有:WS1-(X-358)-2003Z-2011-2017、WS1-(X-526)-2003Z-2010、YBH02202016、YBH00802012、YBH03602014、YBH02292015等。2021年,该品种被列为国家药品评价性抽验品种。共抽取142批次,涉及21个生产企业和38个批准文号,见表1。本文参考文献报道[3-9],通过对国产注射用克林霉素磷酸酯的法定标准检验及探索性研究,以问题为导向,以提高药品质量为目标,对该品种药品进行全面质量评价。
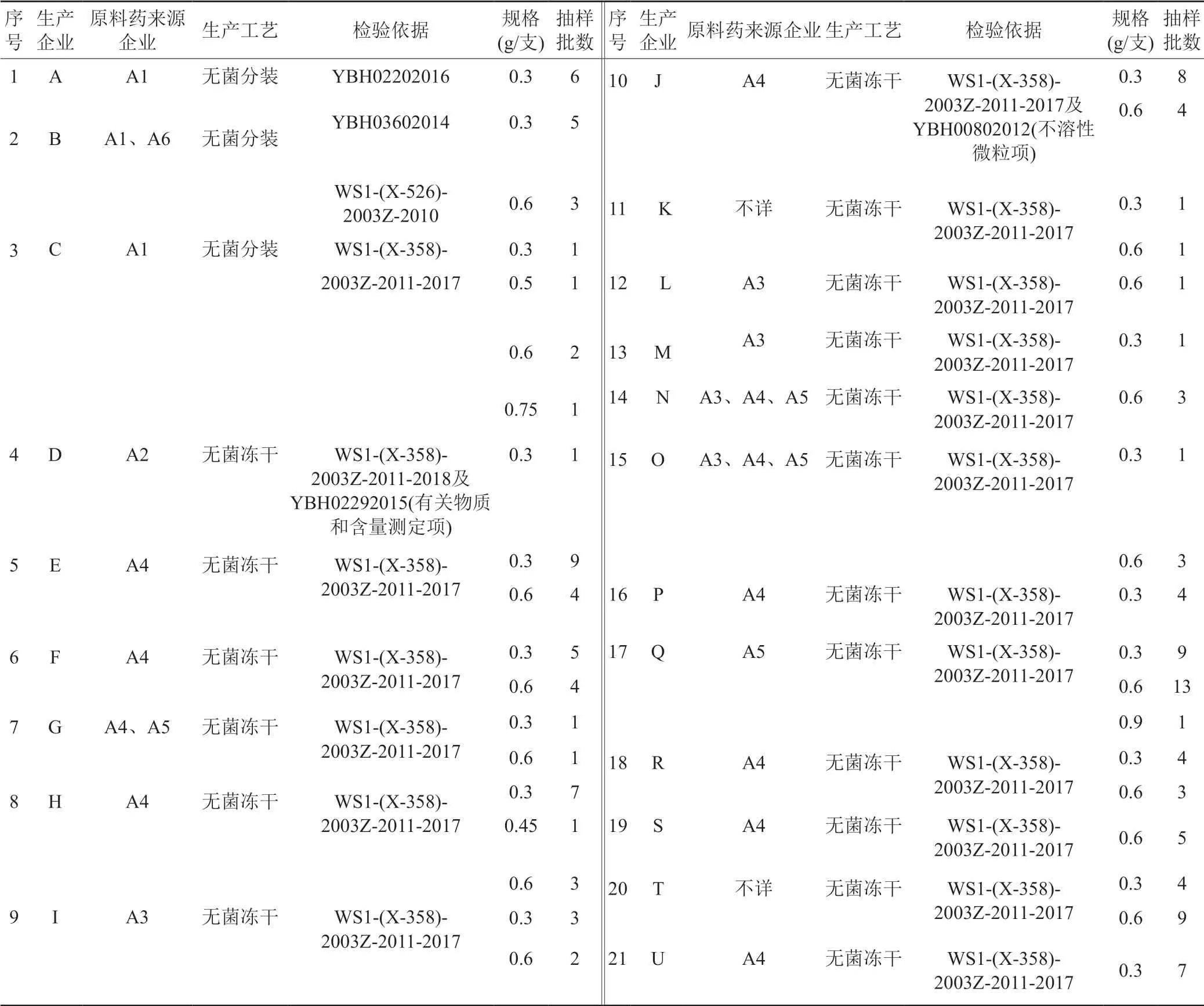
表1 抽样情况表Tab.1 Table of samping
1 材料与方法
1.1 仪器
岛津离子阱飞行时间液质联用仪,安捷伦1260高效液相色谱仪;梅特勒XS125分析天平,XSPBM-3CA 显微镜,布鲁克D2 Phaser X射线衍射仪。
1.2 试药
克林霉素磷酸酯对照品(中检院提供,批号130486-201805,含量82.7%);醋酸铵、甲醇、乙腈均为色谱纯(Fisher chemical),其余试剂为分析纯。
142批次注射用克林霉素磷酸酯为2021年国家评价性抽验样品,规格分别为0.3、0.45、0.5、0.6、0.75和0.9 g/支。其中3个企业采用无菌分装工艺,共抽样19批,18个企业采用无菌冻干工艺,共抽样123批,调研收集到19个企业的原料和辅料,其对应的原料涉及6家企业。
2 试验方法
2.1 法定检验
按产品说明书上对应的执行标准,对142批次注射用克林霉素磷酸酯进行法定标准检验,主要评价项目为有关物质、水分、溶液的澄清度与颜色、酸度和含量测定。
2.2 HPLC法分析有关物质
色谱条件:色谱柱为岛津Shim-pack C18柱(规格:4.6 mm×250 mm,5 μm);流动相A:pH6.0磷酸盐缓冲液(称取磷酸二氢钾13.6 g,加水1000 mL使溶解,用0.45 mg/mL氢氧化钾溶液调节pH值至6.0)-乙腈(79:21,V/V),流动相B:pH6.0磷酸盐缓冲液(称取磷酸二氢钾13.6 g,加水1000 mL使溶解,用0.45 mg/mL氢氧化钾溶液调节pH值至6.0)-乙腈(40:60,V/V),先以流动相A等度洗脱,待克林霉素磷酸酯峰洗脱完毕后立即按表2线性梯度洗脱;流速:1.1 mL/min;柱温:35℃;进样量:20 μL;检测波长:210 nm。
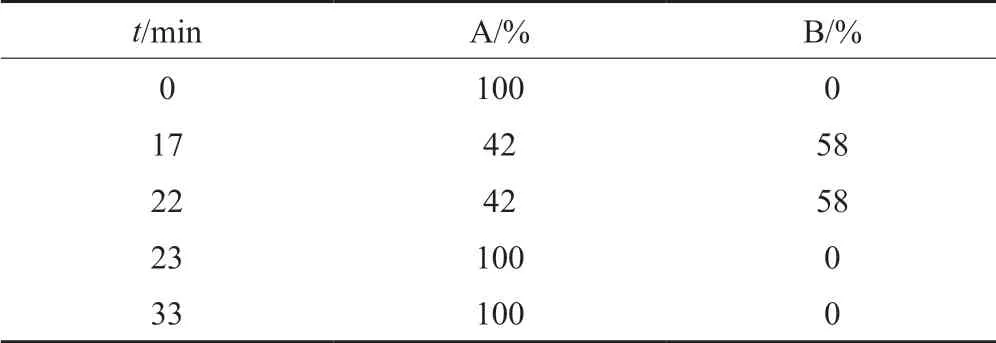
表2 梯度洗脱程序Tab.2 Gradient elution program
2.3 LC-MS分析杂质结构
液相色谱条件:色谱柱为岛津Shim-pack C18柱(规格:4.6 mm×250 mm,5 μm);流动相A:0.036 mol/L乙酸铵溶液(用乙酸调节pH值至6.0),流动相B:乙腈;按表3线性梯度洗脱;柱温35 ℃;流速:1.0 mL/min(柱后分流比为7:3,V/V);进样体积20 μL。
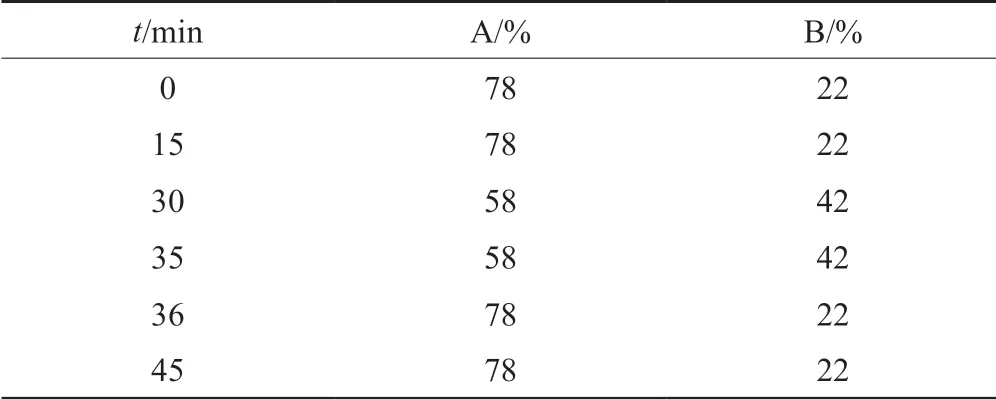
表3 梯度洗脱程序Tab.3 Gradient elution program
质谱条件:离子源:ESI(+);检测电压:1.54 kV;CDL温度:200℃;脱溶剂管温度:200℃。
2.4 HPLC含量测定
色谱条件:色谱柱为岛津Shim-pack C18柱(规格:4.6 mm×250 mm,5 μm);流动相:pH6.0磷酸盐缓冲液(称取磷酸二氢钾13.6 g,加水1000 mL使溶解,用0.45 mg/mL氢氧化钾溶液调节pH值至6.0)-乙腈(79:21,V/V);柱温:35℃;流速:1.1 mL/min;进样体积20 μL;检测波长为210 nm。
3 结果与讨论
3.1 法定标准检验
依据法定标准检验,142批次抽样,全部符合规定,合格率为100%。对与产品质量密切相关的主要检验项目如有关物质、水分、溶液的澄清度与颜色、酸度和含量测定结果进行统计分析。
3.1.1 有关物质
现行法定标准中的有关物质检测方法及限度差异较大。比较其差异:WS1-(X-358)-2003Z-2011-2017、YBH03602014(B企业 0.3 g)和YBH02292015(D企业)标准,采用梯度系统(色谱系统相同),YBH02202016(A企业)、WS1-(X-526)-2003Z-2010(B企业0.6 g)标准采用等度法。在限度方面,差异主要集中于对已知杂质的控制,国家药品标准WS1-(X-358)-2003Z-2011-2017仅控制林可霉素、克林霉素两个已知杂质;YBH02202016(A企业)控制了7个已知杂质;YBH02292015(D企业)控制了8个已知杂质;YBH03602014(B企业0.3 g)控制了4个已知杂质,国家药品标准WS1-(X-526)-2003Z-2010(B企业0.6g)未控制已知杂质,仅控制了单杂和总杂。
139批次中均未检出林可霉素,克林霉素含量为0~0.6%,其他单杂含量为0.01%~1.4%,其他总杂含量为0.1%~3.6%;不同工艺产品之间杂质差异较大(图1),其中企业A、B和C 3家无菌分装产品,克林霉素含量均值分别为0.015%、0.10%和0.08%、其他单杂含量均值分别为0.03%、0.11%和0.38%,其他总杂含量均值分别为0.11%、0.30%和0.62%;M企业(冻干工艺)产品杂质含量最高,克林霉素含量为0.6%、其他单杂含量为1.2%,其他总杂含量为3.1%。采用无菌分装的3家企业产品无论单个杂质还是杂质总量均远低于冻干工艺产品。
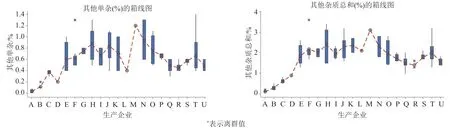
图1 有关物质检验结果Fig.1 The standard test results for related substances
同一生产企业不同批次产品之间亦存在一定的差异。统计同企业3批次以上的产品结果,其他总杂含量差异最大的产品来自A、B、O、H和T企业,其中A和B的产品(无菌分装品),由于其杂质含量本身较低,使得批间的RSD相对较大;O、H和T企业产品(无菌冻干品),由于稳定性较差,其杂质含量与贮存时间呈正相关(P<0.05),贮存时间的差异导致批间杂质含量差异较大,使得RSD值偏大。
此外,现行质控标准的差异使得测定结果可比性不强。从测定结果看,不同分析方法造成杂质总量的极差可高达3.5%,说明该品种有关物质控制方法亟待规范统一。
3.1.2 水分
各现行标准中的水分限度不统一。国家药品标准WS1-(X-358)-2003Z-2011-2017和YBH03602014(B企业)均规定“水分不得过1.5%”,YBH02202016(A企业)规定“水分不得过6.0%”,国家药品标准WS1-(X-526)-2003Z-2010(B企业0.6g)规定“水分不得过1.3%”。
142批次样品采用费休氏法测定水分,结果为0.2%~1.4%,均值为0.77%,企业间水分结果差异较大(图2),其中,A、B、C、K和R企业5家的产品水分含量均值较低,分别为0.4%、0.4%、0.5%、0.3%和0.3%;I、O、P和F企业4家的产品水分值较高,分别为1.2%、1.1%、1.2%和1.1%。3家无菌分装工艺的产品水分含量明显低于采用无菌冻干工艺的产品;不同企业冻干工艺产品的水分含量差异较大,其中E、O、S和T企业产品的批间差异较大,反映该企业冻干工艺稳定性有待提高。
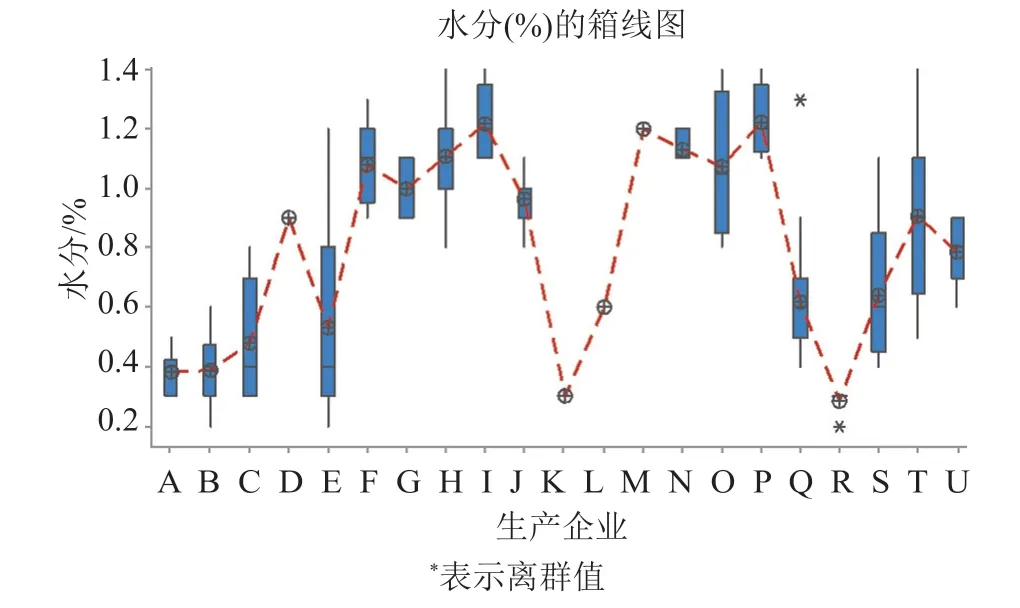
图2 水分检测结果Fig.2 The result of moisture
3.1.3 溶液的澄清度与颜色
冻干工艺产品的检测浓度为0.2 g/mL,无菌分装产品的检测浓度为0.04 g/mL;142批次产品检验结果均符合规定,但检测浓度的差异使得其结果不完全具有可比性。
检验结果显示,137批次产品澄清,5批次澄清度略显浑浊,但浅于1号浊度标准液;140批次产品的溶液颜色为无色,S企业和J企业各1批产品颜色稍深,介于黄色1号与2号之间。
3.1.4 酸度
按法定标准检验均符合规定。其中,123批次无菌冻干产品的pH值在6.2~6.8之间(标准规定pH值5.0~7.0),19批次无菌分装产品的pH值在3.7~4.4之间(标准规定pH值3.5~4.5),同一生产企业不同批次的酸度值均较为接近。
3.1.5 含量测定
按法定标准检验142批次样品均符合规定。虽然不同标准中含量的限度有所差异,但从所有样品的含量测定结果,按无水物计分布于76.4%~85.8%之间,均值为80.6%,极差9.4% ;按平均装量计,含克林霉素为标示量的94.0%~106.2%,均值为98.6%,极差12.2%;未发现低限投料的问题。
对不同生产企业3批次以上产品数据进行分析,批间含量差异最大的为B企业,变异系数为1.8%(按无水物计)和3.5%(按平均装量计),批间含量差异最小的为O企业,变异系数为0.6%(按无水物计)和0.5%(按平均装量计)。
3.2 探索性研究
3.2.1 杂质谱分析
采用新建立的杂质谱分析方法共检出13个杂质,应用LC-IT-TOF/MS技术,结合克林霉素磷酸酯EP系统适用性对照品、杂质F(林可霉素2-磷酸酯)、杂质G(2,4-磷酯酰林可霉素)、杂质B(克林霉素B磷酸酯)对照品,中国药品检验研究院提供的杂质A(林可霉素)和杂质E(克林霉素)对照品,参考国外药典,确证样品中11个杂质的结构。杂质1为林可霉素2-磷酸酯,杂质2为2,4-磷酯酰林可霉素,杂质3为林可霉素,杂质4为克林霉素2,4-二磷酸酯,杂质5为克林霉素B磷酸酯,杂质6为克林霉素2,3-二磷酸酯,杂质7为7-表克林霉素磷酸酯,杂质8为克林霉素(2R-顺式)-非对映异构体2磷酸盐,杂质9为3′(6′)-去氢克林霉素磷酸酯,杂质10为克林霉素,杂质11为克林霉素焦磷酸酯。各杂质结构见表4。
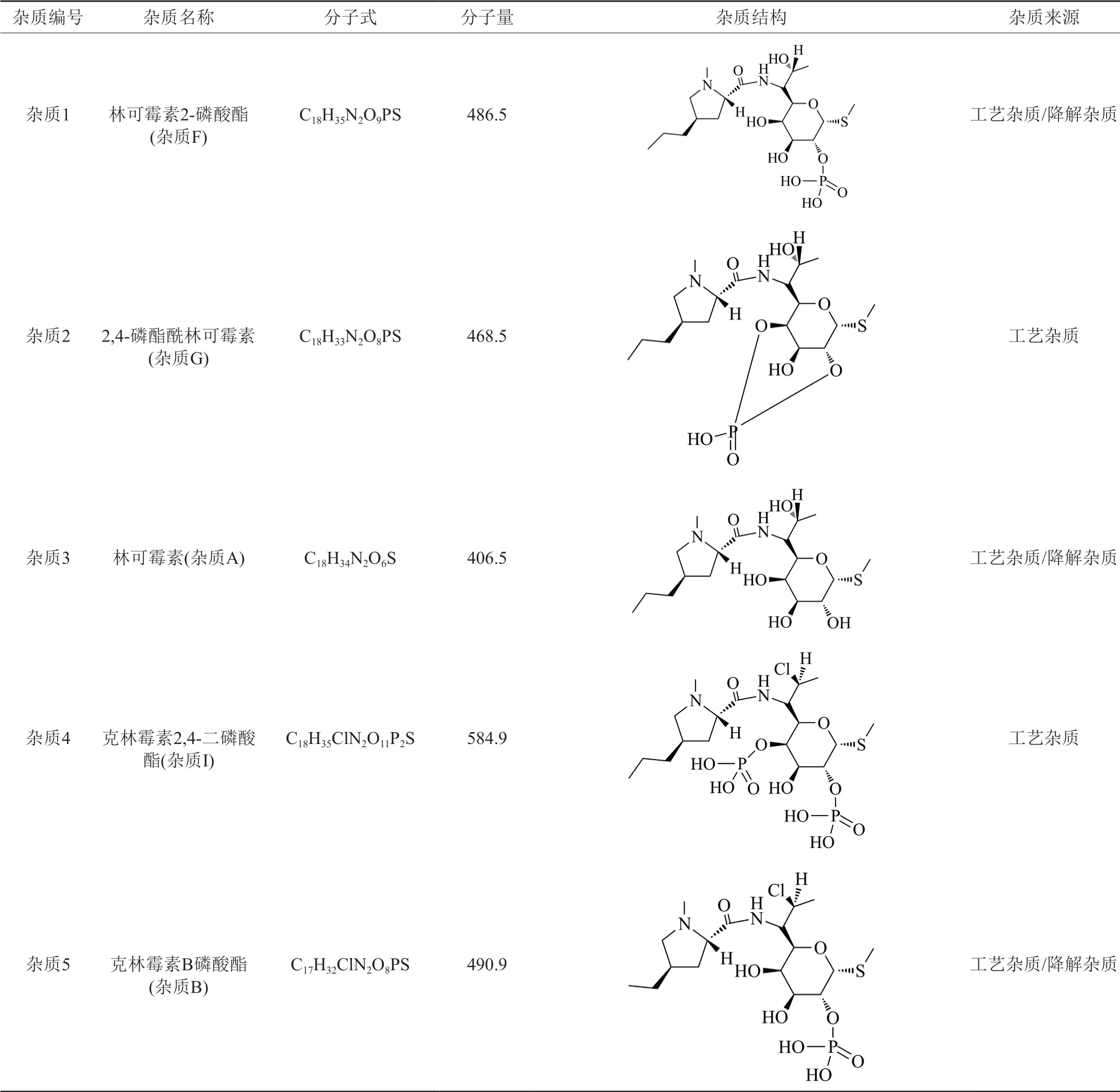
表4 各杂质推定结构及来源分析Tab.4 Structure and source analysis of peaks of related substances

续表4
利用强制降解试验结合LC-MS/ MS质谱分析,探讨产品中诸杂质的来源。无菌冻干制剂中杂质F和杂质B的含量远高于原料,尤其是随着贮存时间的延长,两个杂质含量显著增加,提示其为贮存中的主要降解杂质;克林霉素磷酸酯对酸较稳定,在热、碱、氧化和紫外条件下易产生杂质F、G、E。
3.2.2 有关物质测定结果
比较EP11.0(BP2021与EP11.0方法及限度一致)、USP44和《中国药典》2020年版克林霉素磷酸酯原料的有关物质方法,初步认为EP11.0收载的克林霉素磷酸酯有关物质的分析方法较理想,以此为基础对其梯度洗脱程序进行了优化(图3),全部已知杂质均可以良好分离。
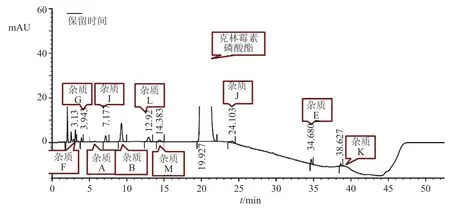
图3 优化的有关物质高效液相色谱图Fig.3 Optimized chromatogram of the related substances
按优化方法检验,142批次注射用粉针剂中,杂质F在0.04%~1.5%之间,杂质G在0.03%~0.4%之间,杂质B在0.1%~1.8%之间,杂质L在0.02%~0.6%之间,杂质E在0.03%~0.8%之间,其他单一杂质在0.1%~0.3%之间,杂质总和在0.6%~5.5%之间。
参照EP11.0、克林霉素磷酸酯原研企业的限度,建议注射用克林霉素磷酸酯有关物质限度为:杂质F(相对保留时间为0.15)不得过3.0%、杂质G(相对保留时间为0.20)不得过0.5%,杂质B(相对保留时间0.45为)不得过1.5%,杂质L(相对保留时间为0.63)不得过0.8%、杂质E(相对保留时间为1.7)不得过1.5%,其他单一杂质不得过0.5%,杂质总和不得过6.0%。142批次注射用克林霉素磷酸酯中,仅3批次近效期的冷冻干燥产品(分别来自H、T和F企业)达不到上述要求(图4)。
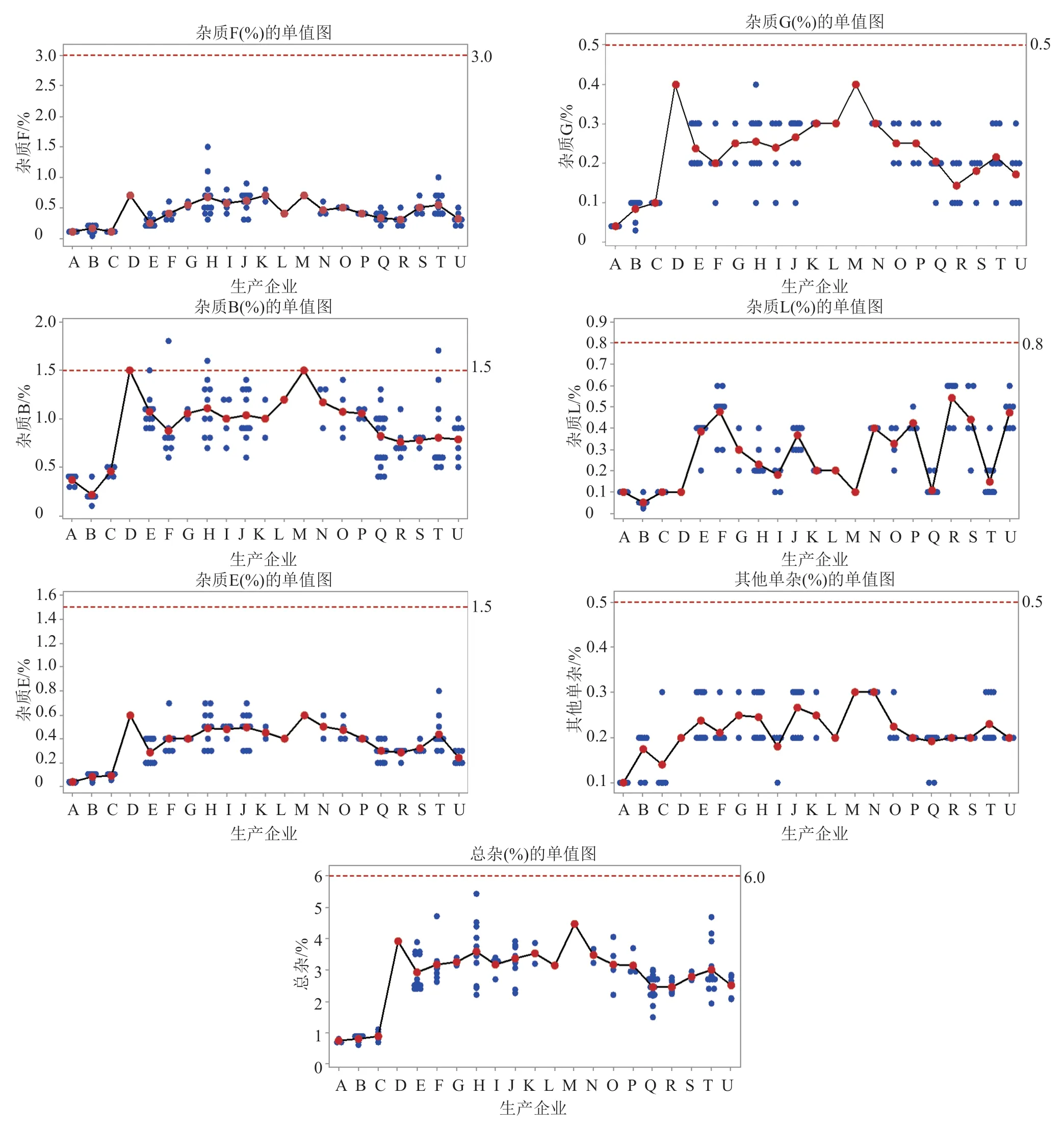
图4 有关物质检测结果单值图Fig.4 The results of related substances
3.2.3 含量测定方法的改进
法定标准中的含量测定方法均采用C8色谱系统,但流动相系统与有关物质测定的流动相完全不同,结果杂质A(相对保留时间为0.97)与克林霉素磷酸酯主峰之间与不能达到完全分离(图5),采用上述优化的有关物质分析方法测定克林霉素磷酸酯的含量,诸杂质及辅料和溶剂均不干扰测定。142批次样品按优化后色谱系统检验,结果与法定标准检验结果相比,差异较小(图6),但结果的稳定性更好。
图5 法定标准典型色谱图Fig.5 The typical chromatogram with legal standard
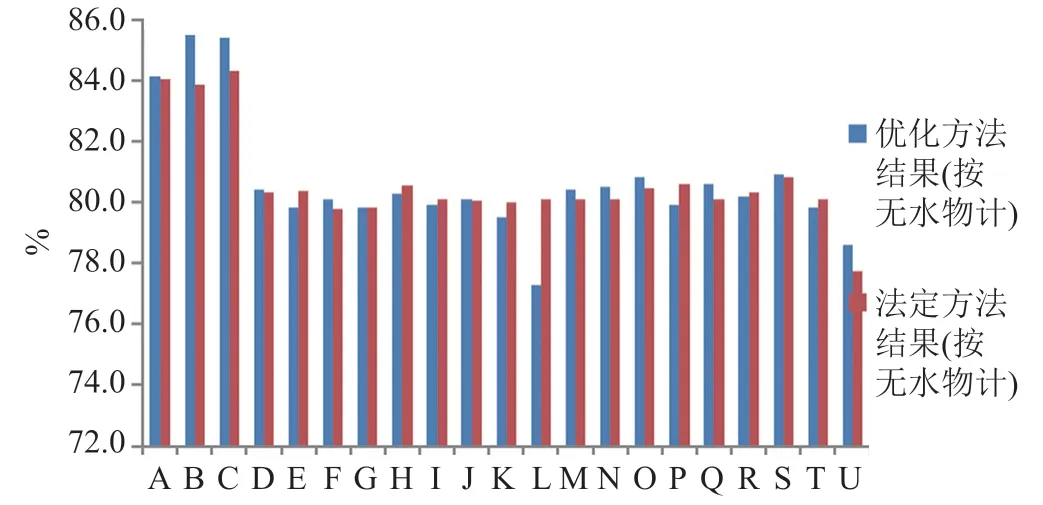
图6 含量测定结果比较Fig.6 Comparison chart of assay results
3.2.4 原料晶型比较
目前国内克林霉素磷酸酯原料药生产厂家为10个,调研共收集到其中6个企业(A1~A6企业)的原料。采用显微镜观察法对6个企业原料晶型进行测定,结果 A1企业的晶粒规整,有六边形板状和不规整状,细晶少,A2、A3和A4企业的晶粒为长方体板状,A5和A6企业的晶粒较小,且晶体粒径大小不一(图7)。

图7 克林霉素磷酸酯原料晶型图Fig.7 The pictures of clindamycin phosphate
采用X-粉末衍射法对6家企业的原料进行测定,发现A6企业的原料X-粉末衍射图峰形和其他5家企业有一定差异。提示不同原料药企业的结晶工艺存在差异。3家采用无菌分装工艺生产的企业所用原料均来自A1和A6企业;采用冻干工艺的产品原料来自其他4家原料企业,有的制剂企业未固定原料供应商(使用2~3家供应商的原料)。由于结晶工艺可直接影响原料的杂质谱,采用不同供应商的原料药生产制剂,可能是导致制剂杂质谱变异的原因之一。
评价结果显示,采用无菌分装工艺生产的制剂,从杂质控制角度明显优于冷冻干燥工艺制剂。但另一方面,从注射剂无菌保障水平角度,冷冻干燥工艺较无菌分装工艺在制剂过程更易控制产品的污染。对该类产品生产工艺的评价将是国内仿制药一致性评价/再评价的关键。

