不同剂型克拉霉素口服固体制剂质量比较
刘旭春 姚羽 张玲变 刘亚妮 王丹 周晓溪
(山西省食品药品检验所,太原 030031)
克拉霉素为大环内酯类抗生素,主要适用于呼吸道感染、皮肤软组织感染、根除幽门螺杆菌等[1-3]。目前国内市场上克拉霉素口服固体制剂主要有克拉霉素片、分散片、胶囊、颗粒和缓释片5种剂型。克拉霉素片、胶囊、颗粒主要执行《中国药典》2015年版标准,克拉霉素分散片执行标准为《中国药典》2010年版第二增补本,克拉霉素缓释片目前没有统一的标准,2020年国家药品抽检抽取到5家企业的样品,执行标准分别为YBH06702003-2016Z、YBH15382006-2016Z、YBH17582005-2016Z、YBH25772005-2016Z和YBH01642018。
本次国家药品抽检共抽取到249批次克拉霉素口服固体制剂,涉及49家生产企业、58个批准文号。其中,克拉霉素片95批次,克拉霉素分散片55批次,克拉霉素胶囊51批次,克拉霉素颗粒12批次,克拉霉素缓释片36批次。依据现行质量标准检验并结合探索性研究,本文对国内市场上不同克拉霉素口服固体制剂的关键质量属性进行比较分析,探讨产品存在的主要质量问题,寻求提高产品质量的方向,并对完善现行标准提出建议。
1 仪器与试药
1.1 仪器
岛津LC-20AT高效液相色谱仪;赛多利斯CPA225D电子天平;梅特勒V30水分滴定仪;戴安U3000/QE液质联用仪;SOTAX AT自动溶出仪;戴安U3000高效液相色谱仪;超纯水机。
1.2 试药
克拉霉素对照品(批号:130558-201904,含量:86.6%)由中国食品药品检定研究院提供;克拉霉素杂质鉴别对照品为EP对照品;克拉霉素杂质J对照品由J2企业提供。乙腈为色谱纯;磷酸二氢钾、氢氧化钾、氢氧化钠为分析纯;水为超纯水。
2 试验方法
2.1 法定标准检验
按照法定标准[4-15],对克拉霉素片、分散片、胶囊、颗粒以及缓释片分别进行检验。
2.2 探索性研究
根据本品自身特点,结合法定检验中出现的问题,通过文献检索[16,17]、企业调研等,对产品的杂质谱、溶出曲线、影响药物稳定性的因素等进行研究。
2.2.1 杂质谱分析
《中国药典》2015年版二部克拉霉素片、胶囊,《中国药典》2010年版第二增补本克拉霉素分散片,H1、H2、H3企业克拉霉素缓释片有关物质检测方法均采用等度洗脱,仅控制单个杂质或总杂质,且限度较宽;H4企业克拉霉素缓释片有关物质检测方法采用TLC法,只能进行半定量;克拉霉素颗粒无有关物质检查项。参考EP10.0克拉霉素标准建立了本品杂质谱的分析方法。
(1)色谱条件:采用十八烷基硅烷键合硅胶(4.6 mm×250 mm,5 μm)为填充剂;以磷酸盐缓冲液(取4.76 g/L磷酸二氢钾溶液,用10%磷酸或45%氢氧化钾溶液调节pH值至4.4)为流动相A;乙腈为流动相B;按表1进行线性梯度洗脱;检测波长为205 nm;柱温为40℃;流速为1.2 mL/min;进样体积为10 μL。

表1 梯度洗脱程序Tab.1 Gradient elution procedure
(2)杂质的确证:采用LC-MS双三元柱切换技术在线脱盐进行杂质确证。一维色谱条件同上,二维色谱以10 mmol/L碳酸氢铵溶液为流动相A;乙腈为流动相B;按表2进行线性梯度洗脱。根据一维液相出峰时间,设置质谱阀切换参数,进行二级质谱扫描。
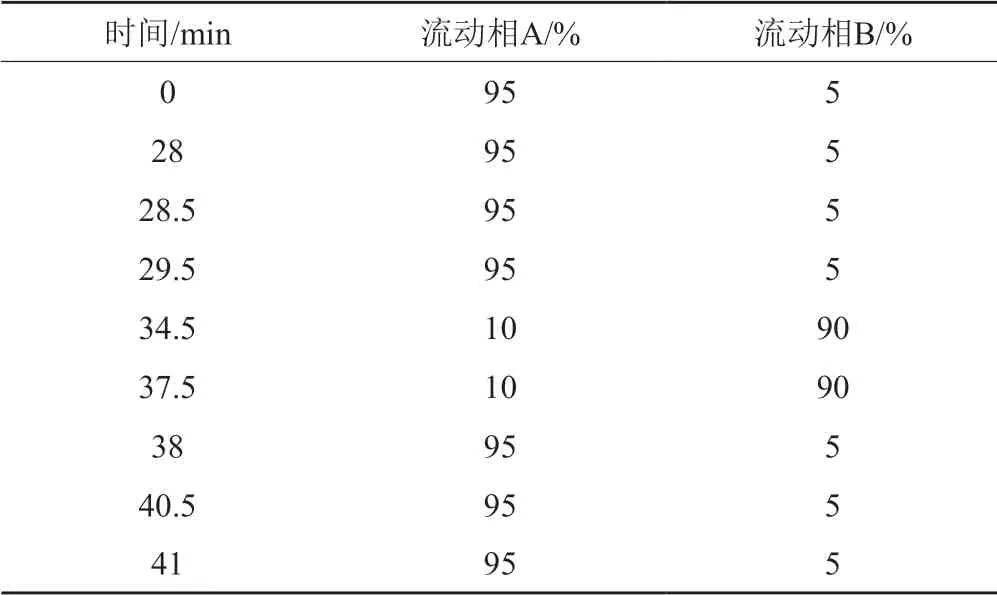
表2 梯度洗脱程序Tab.2 Gradient elution procedure
2.2.2 溶出曲线研究
以上海雅培克拉霉素片(原研地产化品种,国家药品监督管理局公布的仿制药参比制剂目录第十一批)为参比制剂,选取大于6批次的10家企业0.25 g规格的样品,采用桨法,分别以pH4.5、pH6.0和pH6.8磷酸盐缓冲液900 mL为溶出介质,转速为50 r/min依法测定,绘制溶出曲线。其中P1、P2、P3、P4企业样品为克拉霉素片,F1、F2、F3、F4企业为克拉霉素分散片,J1、J2企业为克拉霉素胶囊。
2.2.3 影响药物稳定性的因素
(1)加速试验条件 选取不同剂型12批样品,于温度40℃,相对湿度75%条件下分别放置0、20、40和60 d,考察样品的性状、杂质、碱度和水分等的变化。
(2)高温试验 选取加速试验条件下能检出克拉霉素杂质I的1批样品,于60℃条件下分别放置0、5和10 d,比较克拉霉素杂质I变化情况。
(3)高湿试验 选取不同剂型10批样品,于相对湿度92.5%的条件下分别放置0、5和10 d,比较其性状、杂质、碱度和水分等的变化情况。
3 结果与讨论
3.1 法定标准检验结果
按照现行法定标准检验,249批次样品中,有1批次不符合规定,合格率99.6%。
不合格样品为H1企业的克拉霉素缓释片,不合格项目为干燥失重。不合格原因分析:客观上与样品接近效期有关。该企业克拉霉素缓释片有效期为24个月,检验日期距离效期约为5个月。比较该企业9批次样品的干燥失重测定结果与生产日期,发现距离失效日期越近,干燥失重越大,二者显著相关;但其本质是该企业样品受环境的影响较大,将本品于相对湿度92.5%的条件下分别放置10和20 d,其干燥失重随放置时间逐渐增大(图1)。
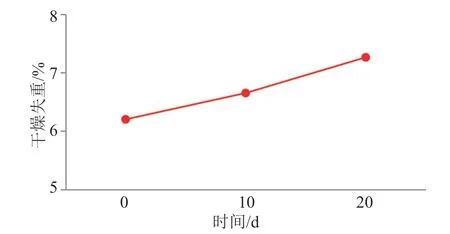
图1 高湿条件下干燥失重变化情况Fig.1 Trend of loss on drying under high humidity
3.2 探索性研究结果
3.2.1 杂质谱分析
采用新建立的分析方法共检出16个杂质(图2),与《中国药典》2015年版克拉霉素有关物质检测方法比较,各杂质峰分离更好,杂质个数和杂质总量均明显增加。
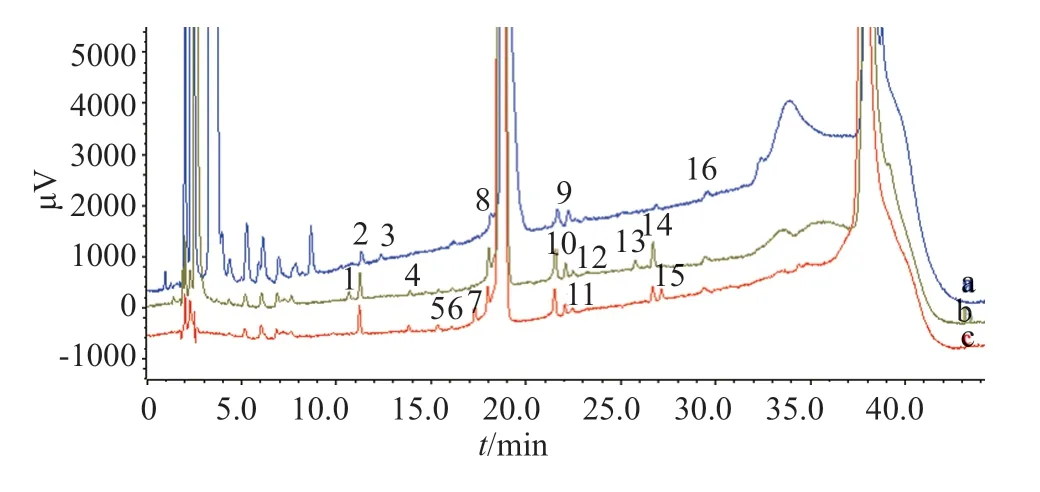
图2 克拉霉素口服固体制剂有关物质典型色谱图Fig.2 Typical chromatograms of related substances of clarithromycin oral solid preparations
利用克拉霉素杂质鉴别对照品、克拉霉素杂质J对照品确证了其中的13个杂质;通过LC-MS双三元柱切换技术,参照EP10.0收载的克拉霉素已知杂质,并结合克拉霉素合成路径、原料药杂质检测情况及质谱裂解规律[18-19],推测了3个杂质结构,杂质名称见表3。

表3 克拉霉素口服固体制剂杂质归属Tab.3 The ascription of impurities in clarithromycin oral solid preparations
参照EP10.0克拉霉素原料和通过一致性评价样品的质量标准设定本品有关物质的限度,249批次样品均符合该限度。不同剂型样品的杂质谱基本一致,仅F2企业的克拉霉素分散片和H1、H3企业的克拉霉素缓释片检出杂质I。比较不同剂型样品的杂质总量,克拉霉素颗粒中所含杂质总量较其他剂型的高(图3)。建议克拉霉素颗粒增订有关物质检查项,对单个杂质、总杂质和特定杂质均进行控制。
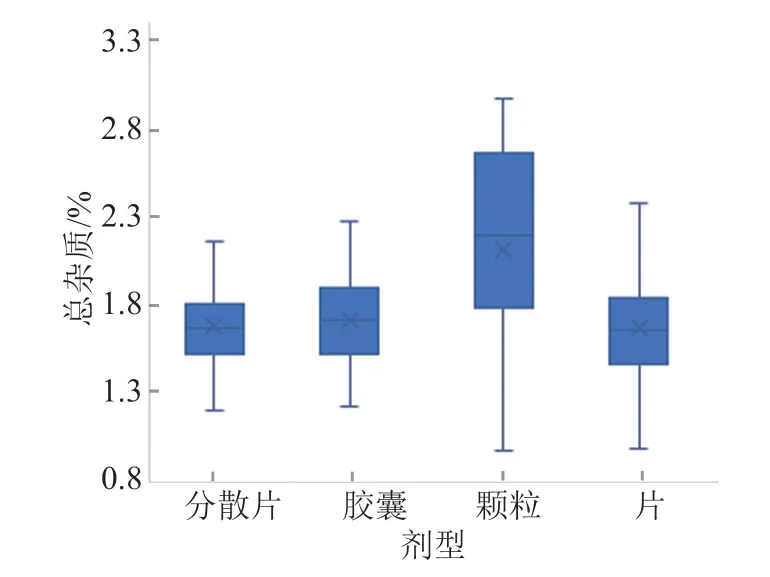
图3 不同剂型克拉霉素总杂质量比较Fig.3 Comparison of the total impurities of clarithromycin in different dosage forms
进一步比较原料质量对制剂的影响。结果显示,Y企业原料杂质较高,H2企业1批克拉霉素缓释片使用Y企业原料,杂质也较高,表明原料药的质量影响制剂质量,企业对进厂原料的控制是保证制剂质量的关键。
3.2.2 溶出曲线研究
口服固体制剂的溶出特征是其重要的关键质量属性。参比制剂和10家企业样品的溶出曲线见图4~6,仅P1、P2企业的克拉霉素片以及F1、F2企业的克拉霉素分散片溶出曲线与参比制剂相似,2家胶囊生产企业产品均与参比制剂不相似。2家胶囊生产企业样品从15 min开始,在3种溶出介质中各取样点的溶出量较其他剂型样品均偏低。原料来源相同的不同企业样品的溶出曲线也各不相同,提示制剂处方与工艺是影响制剂溶出的关键。仿制药质量和疗效一致性中,通过对处方工艺的合理优化,是保证溶出曲线与参比制剂相似的关键。
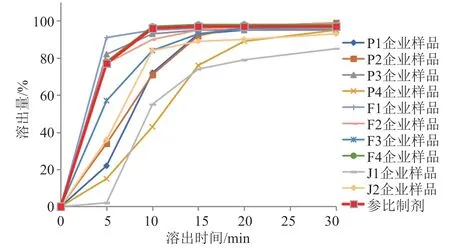
图4 溶出曲线(pH4.5磷酸盐缓冲液)Fig.4 Dissolution curves(pH4.5 phosphate buffer)
《中国药典》2015版二部克拉霉素胶囊溶出方法为桨法、克拉霉素片为篮法,《中国药典》2010年版第二增补本克拉霉素分散片溶出方法为篮法。建议参照参比制剂溶出度测定法[6],将三者溶出方法统一为桨法,并将限度修订为标示量的85%。
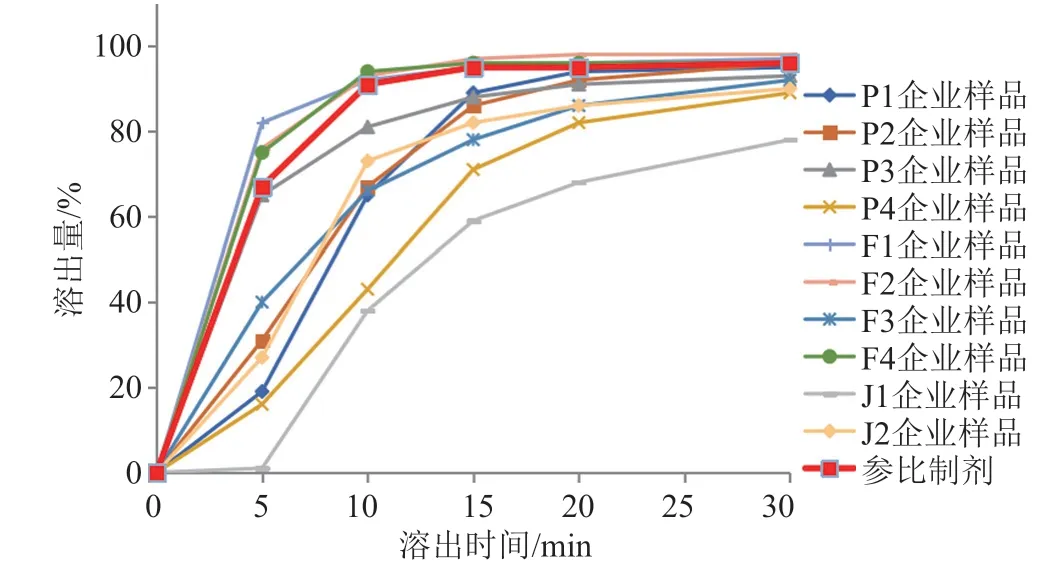
图5 溶出曲线(pH6.0磷酸盐缓冲液)Fig.5 Dissolution curves(pH6.0 phosphate buffer)
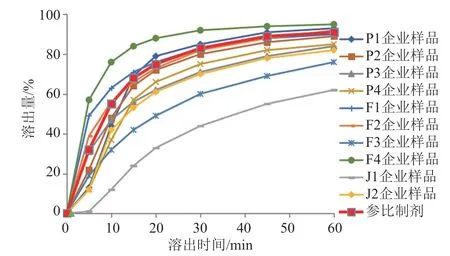
图6 溶出曲线(pH6.8磷酸盐缓冲液)Fig.6 Dissolution curves(pH6.8 phosphate buffer)
按上述方法进行试验,克拉霉素胶囊平均溶出量略低于片和分散片(图7)。克拉霉素分散片和片在平均溶出量方面无明显差异,分散片中虽然大量使用了羧甲基淀粉钠、低取代羟丙基纤维素或交联羧甲基纤维素钠等优质崩解剂,分散较快,但因克拉霉素为BCSⅡ类,溶解性较差,导致克拉霉素分散片在溶出行为方面并未体现出其优势。
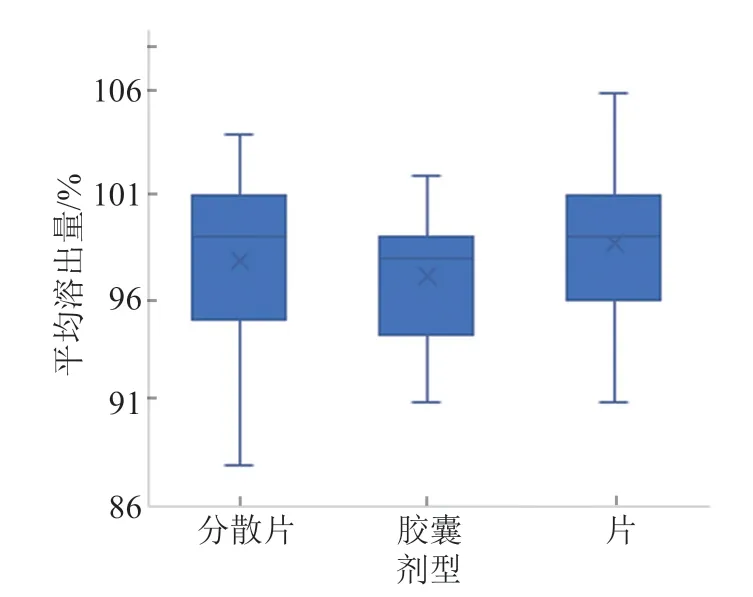
图7 不同剂型克拉霉素平均溶出量比较Fig.7 Comparison of the average dissolution of clarithromycin in different dosage forms
3.2.3 影响药物稳定性的因素
在各种加速试验条件下按现行法定标准及《中国药典》2015年版四部通则要求检测样品的性状、水分和碱度(仅颗粒剂测定),并采用新建立的杂质谱分析方法检测样品中杂质。在温度40℃,相对湿度75%条件下,样品的性状无明显变化;克拉霉素杂质I增大(图8A),其他杂质无明显变化;颗粒剂碱度无明显变化;F5企业克拉霉素分散片和H1、H3企业克拉霉素缓释片水分增,见图8B;在60℃高温条件下,随着放置时间延长,克拉霉素杂质I增大(图8C);在相对湿度92.5%的高湿条件,随着放置时间延长,部分企业的样品水分会增大(图8D)。H1企业样品在此条件放置10 d后,杂质I无明显变化。
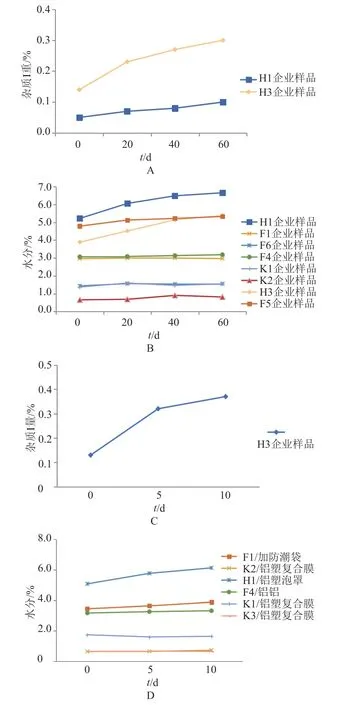
图8 各种加速试验中克拉霉素制剂关键指标的变化Fig.8 Variation of key characteristics of clarithromycin preparations in accelerated stability test
加速试验和高温、高湿试验表明,克拉霉素口服固体制剂的主要降解杂质是杂质I。克拉霉素杂质I为3-O-去克拉定糖基-6-O-甲基红霉素A,是克拉霉素的水解产物,固体条件下主要受温度的影响,并与样品的水分含量有关。由于高湿条件下部分样品水分增大,保证产品贮存期不吸潮,并控制贮存温度是保证产品稳定性的关键。
上述试验显示,克拉霉素片、胶囊和颗粒均较稳定。部分企业克拉霉素分散片和缓释片水分增大。H1企业和H3企业克拉霉素缓释片中杂质I增大。
4 结论
本次国家药品抽检结果显示,克拉霉素口服固体制剂总体质量较好,合格率99.6%。
探索性研究结果表明,不同企业样品的溶出曲线存在较大差异,建议企业尽早开展仿制药质量和疗效一致性评价。高温条件下克拉霉素杂质I增大,高湿条件下部分样品水分增大,建议在药品生产、流通、贮藏各环节均严格控制环境温湿度。
K2企业克拉霉素颗粒处方中的甜味剂为糖精钠,糖精钠的安全性一直饱受争议[20],由于其潜在的风险,《GB 2760-2014食品安全国家标准食品添加剂使用标准》不允许在婴幼儿配方食品中使用。虽然国家药品监督管理局2019年第56号公告附件3《可免登记的产品目录》中列有糖精钠,但克拉霉素颗粒主要受众者为幼儿及儿童,故克拉霉素颗粒处方中糖精钠的合理性有待商榷。
克拉霉素口服固体制剂质量标准有待提高,建议克拉霉素颗粒增订有关物质检查项,并统一克拉霉素口服固体制剂有关物质检验方法为梯度洗脱,对单个杂质、总杂质和特定杂质均进行控制;并将克拉霉素片、分散片、胶囊的溶出检测方法统一修订为桨法,限度修订为标示量的85%。

