中国大陆原发性高草酸尿症1型临床特点及诊治情况总结
王心悦 詹浩苏 孙丽莹
原发性高草酸尿症(primary hyperoxaluria,PH)是一种代谢性疾病[1],是由于基因变异导致草酸代谢过程中的一些酶缺失,使得尿中草酸盐浓度升高,进而引起结石、肾脏钙化甚至出现肾功能不全的一种肾脏疾病[2]。根据分子生物学,PH分为3型,PH1、2、3型均可导致肾脏草酸钙结石病,其中PH1型(PH1)最常见,约占PH的80%[3-4],是AGXT基因突变导致肝脏特异性过氧化物酶体系丙氨酸乙醛酸转氨酶(alanine glyoxylate aminotransferase,AGT)缺乏所致的内源性草酸增多[5]。草酸盐易沉积于钙离子浓度较高的区域如肾脏、骨骼、心脏、血管等,多以尿草酸钙排泄增加、反复尿路结石、肾钙质沉着和全身不溶性草酸沉积为特征,造成相应的器官损害。PH1的罕见性使得此病患者常出现延迟诊断和漏诊,目前国内已有部分PH1的相关研究,但较为完善的PH1临床数据及研究仍存在大片空白。本研究分析了57例来自中国大陆PH1患者的临床数据,为今后开展国内PH1临床诊疗及研究提供相对可靠的数据支持。
1 资料与方法
1.1 文献检索
检索维普网、中国知网、万方数据库、PubMed、Web of Science、Embase和Cochrane数据库中的文献。检索时限从2000年1月1日至2021年11月30日,采用主题词与自由词结合检索,没有主题词的仅使用自由词检索,检索语种为中文和英文,检索完成后交叉比对。中文检索词为“高草酸盐尿症”“高草酸尿症”“原发性高草酸尿症”或“原发性高草酸盐尿症”,英文检索词为“primary hyperoxaluria”“China”或“Chinese”。
1.2 纳入标准与排除标准
纳入标准:(1)包含PH1病例数据的期刊文章;(2)研究报道了患者的性别、发病年龄、年龄、症状、诊疗经过等指标;(3)患者经中国大陆医院诊治。
排除标准:(1)内容重复的文献;(2)文章不含有待统计研究结局指标;(3)多篇文献间病例选取重复者,选择患者资料最为清晰的一篇;(4)患者经国外或我国港澳台地区医院诊治。
信息提取:提取患者的临床资料,包括患者的性别、年龄、发病年龄、症状、治疗经过(透析时长、是否进行器官移植或保守治疗、行何种类型器官移植等)、治疗效果及结局。
1.3 统计学方法
采用 SPSS 26.0 软件进行统计学分析。计数资料以率表示,比较采用 Fisher 精确检验。P<0.05 为差异有统计学意义。
2 结 果
2.1 文献检索结果
本研究共检索到661篇文献,其中重复或不符合纳入标准626篇,经筛选共纳入35篇[2,6-39],共包含24个医院的57例确诊为PH1的患者,纳入文献基本信息见表1。57例PH1患者中男39例,女18例,年龄0.2~57.0岁,发病年龄为出生后至42岁。
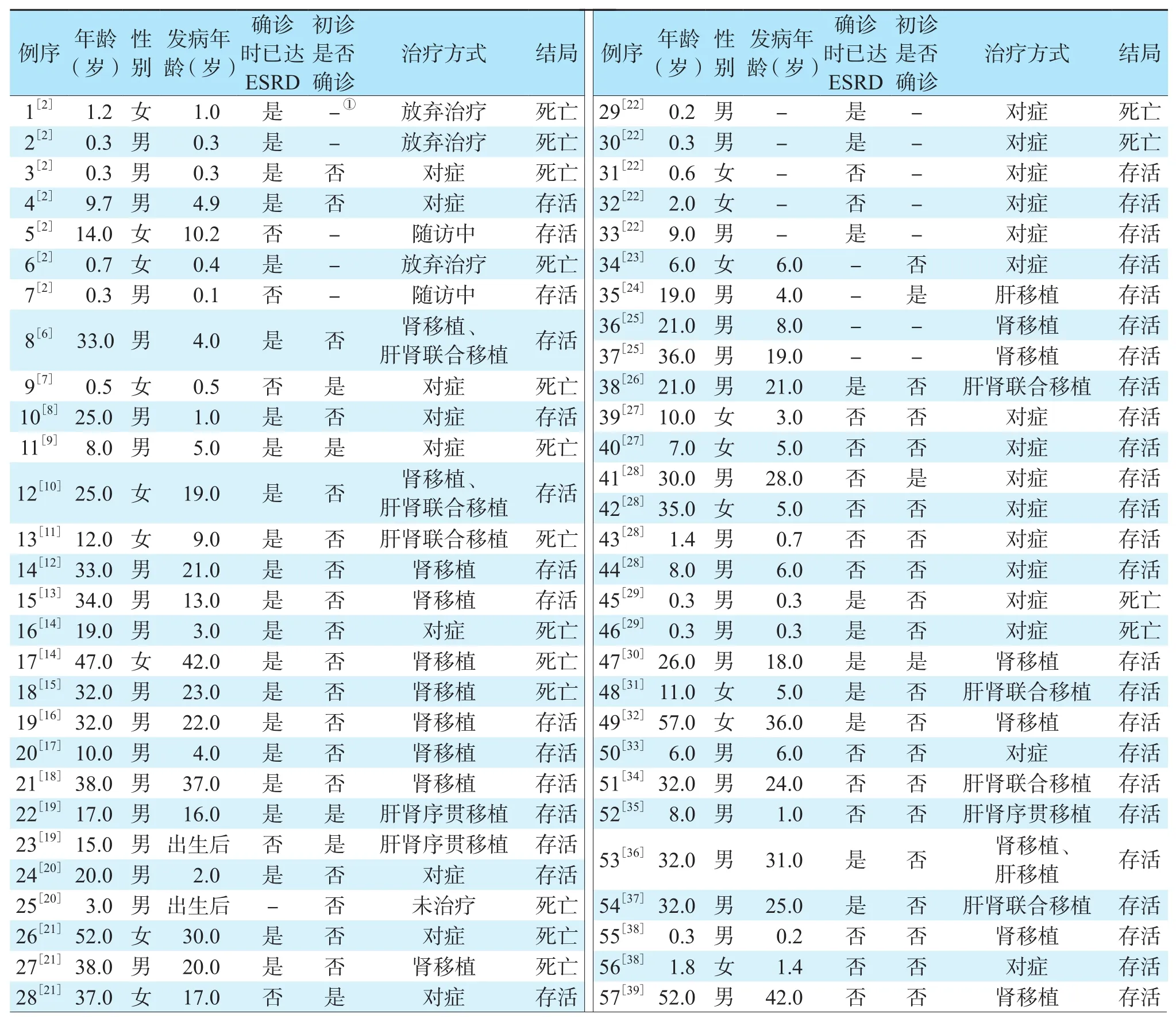
表1 纳入患者的基本信息Table 1 Basic information of the included patients
2.2 PH1的临床表现
57例PH1患者的临床表现特异性较低,其中肾结石41例,肾钙化和(或)肾钙质沉积21例,泌尿系统外(骨骼、心脏、血管等)草酸沉积12例,腰背腹痛12例,输尿管结石8例,此外尿量减少、代谢性酸中毒、水电解质紊乱、贫血、肉眼血尿等症状均有报道。诊断时已进入终末期肾病(end-stage renal disease,ESRD)33例,其中15例是儿童,初步诊断不明确的患者占37例。
2.3 PH1的治疗及预后
57例PH1患者中26例接受移植治疗,85%(22/26)的患者存活,58%(15/26)的患者肾功能有所恢复,死亡4例。17例接受肾移植治疗,死亡3例(2例死于感染,1例死因不详),肾移植术后结石复发和(或)移植肾草酸结晶11例,恢复透析10例,2例因结石复发、恢复透析再次接受移植手术(肝肾联合移植),1例恢复透析并再次接受移植手术(肝移植);7例接受肝肾联合移植治疗,死亡1例(死因为低血容量性休克、左心衰竭致多器官衰竭),余6例患者肾功能改善并脱离透析,无慢性肾脏病5期患者;2例接受肝移植治疗,患者全部存活; 3例接受肝肾序贯移植,患者全部存活,1例恢复透析,2例肾功能改善并脱离透析。
31例PH1患者未接受移植治疗,58%(18/31)的患者存活,死亡13例。Fisher精确检验结果显示,接受移植治疗的患者与未接受移植治疗的患者存活率差异有统计学意义(P<0.05)。
3 讨 论
由于PH的罕见性,已发表的病例报道是研究临床表现、治疗及预后的重要信息来源。据笔者查询,这是首次对中国大陆PH发生情况进行系统综述,以往的研究并没有提供关于临床病例概括性的描述及综合性的数据统计。本研究通过探讨中国大陆PH1的临床特点及诊治情况,为该病的诊断、治疗及预后等积累经验。
在北美地区和欧洲,PH1的发病率为(1~2)/10万人口,患病率为(7~30)/10万人口[40-41]。在欧洲,活产婴儿中PH1的发病率为(83~100)/10万人口[41-42],婴儿型 PH1约占欧洲和北美PH1病例的10%[42]。在我国,因尚未建立系统的PH登记体系,关于本病的流行病学情况仍不清晰[2]。
PH1临床分型分为5型,包括婴儿型、儿童及青少年型、成人型、移植后型、家族型[2,40]。PH1可发生在任何年龄,发病中位年龄在5.5岁甚至更早[43],PH1易进展至ESRD,20%~50%的患者在诊断时已发展为慢性肾病甚至进入ESRD阶段[41]。在儿童甚至婴幼儿中,其比例可高达65.4%[44]。进入ESRD阶段后,PH1的治疗相对更复杂、难度更高,预后相对较差,所以临床医师更应提高认识,争取做到早诊断、早治疗。
器官移植是目前唯一公认可治愈PH的方法,包括预先肝移植、肝肾联合移植、肝肾序贯移植等,可治愈PH的药物仍在研究中[8]。欧洲高草酸尿症联盟专家组针对PH1的治疗建议包括保守治疗、透析以及移植。保守治疗包括大量补液,充分水化,补充枸橼酸钾及磷酸吡哆醇(维生素B6);其中透析患者必要时需行加强透析;不推荐单独进行肾移植[45]。当患者存在明显肾损伤时,推荐肝肾联合移植[39,42,46]。而对于已进入ESRD阶段的患者则推荐行肝肾序贯移植[42,47-48]。单纯肾移植术后若肾结石复发,可在术后数周至数月内出现肾功能减退,此时对患者行移植肾活组织检查,可再次发现草酸盐结晶[36]。根据国际PH登记系统2010年的统计,复发性草酸沉积导致38%的首次肾移植失败[2]。肝移植是治疗遗传代谢性疾病的方法之一,对于缺陷完全在肝脏的遗传代谢性疾病,肝移植可以完全治愈,对于缺陷部分在肝脏的遗传代谢性疾病,肝移植可以起到缓解或部分缓解病情的作用,避免出现代谢危象。通过肝移植可以治疗的遗传代谢性疾病包括尿素循环障碍、PH、有机酸代谢异常、Wilson病等[49-54]。
在我国,遗传代谢性肝病肝移植受者的比例近年逐渐增加,首都医科大学附属北京友谊医院肝脏移植中心自2013年至今共行肝移植1 309例,其中遗传代谢性肝病肝移植受者223例。理论上尽早行预先性肝移植可有效阻止肾功能及其他器官功能损伤[46-47]。到目前为止,关于PH是否优先考虑预先肝移植仍存在争议。一些研究者认为,考虑到伦理、安全、长期抗排斥反应等问题,不应考虑预先肝移植,而另一些研究者认为,其可帮助患者避免肾功能进展至尿毒症期、草酸在组织沉积等问题。由于对本病的发现不够及时,确诊时多已累及肾脏及其他器官组织,目前国内部分患者治疗时已错过预先肝移植的最佳时机,从而只能采取肝肾联合移植或肝肾序贯移植。据本研究统计,未接受移植治疗和接受移植治疗的患者总体生存率分别为58%和85%;接受移植治疗后58%的受者肾功能有所恢复;肝移植和肝肾序贯移植受者均存活,肝肾联合移植术后6/7的受者术后肾功能改善并脱离透析,肝移植和肝肾联合移植术后均未出现ESRD。从不同角度判断治疗效果,各种移植术式各有优势,应结合患者原发病进展情况、患者预后情况、各医疗机构诊疗条件、社会现有技术及资源等情况综合判断,有条件的情况下应优先考虑预先肝移植或肝肾联合移植。
由于本病的罕见性,笔者在选择入组文献时,以不同方式治疗后的生存情况作为主要结局指标,将纳入标准放宽。另外,一部分研究的患者随访时间较短,笔者只进行了汇总的生存率统计与比较,其分阶段统计比较困难。未来关于治疗PH疗效的独立研究如果可以基于更大的样本量及更详细的临床信息,将会获得更完善可靠的结果。
PH1的临床表现多样各异,以肾结石、肾钙化、肾钙质沉积、泌尿系统外草酸沉积、腰背腹痛等表现为主。目前,临床医师对PH1的认识不足,一部分临床医师在典型临床表现面前仍无法形成清晰的诊断思路,使得本病诊断被延迟,错过预先肝移植的机会,从而导致预后不理想。临床医师有必要提高对本疾病的认知,对有结石家族史、近亲结婚史、临床表现典型和(或)严重的患者不应仅对症支持治疗,需考虑到PH的可能,对疑似病例完善结石成分分析,血、尿草酸测定,基因检测,肾活组织检查等[14],治疗上应优先考虑预先肝移植或肝肾联合移植。
综上所述,PH1的临床表现多样且缺乏特异性,延误诊断多,发现时多已进入ESRD阶段,治疗方法上应优先考虑预先肝移植或肝肾联合移植。

