不同类型恶性血液病异基因造血干细胞移植后发生T-LGL临床特征及预后分析
刘四红,刘丹丹,朱明清,潘金兰,邹桦烨
(1.扬州大学第五临床医学院,常熟市第二人民医院血液科,江苏 常熟 215500;2.苏州大学附属第一医院,江苏省血液病研究所,江苏 苏州 215006)
大颗粒淋巴细胞(LGL)是因含有粗大嗜苯胺蓝颗粒而得名,属于淋巴细胞的一种亚型,起源于两大细胞系:大约85%为CD3+、CD57+、CD56-的T细胞是体内抗原活化的效应器-记忆细胞毒性T细胞,其余15%是CD3-、CD56+的自然杀伤(NK)细胞[1]。T大颗粒淋巴细胞的形态特点为体积较大(直径15~18 μm)约为正常红细胞的2倍,细胞胞浆丰富,着淡蓝色“苍白浆”,胞浆边缘可见染色加深如裙边状,胞浆内有粗或细的嗜天青颗粒,细胞核呈肾形或圆形,核染色质粗糙呈块状聚集[2]。大颗粒淋巴细胞增殖性疾病是一种以外周血中大颗粒淋巴细胞持续增多而无明确病因的一组疾病的总称,根据克隆源性分析可以分为非克隆性和克隆性LGL。在自体和异体造血干细胞移植(SCT)、骨髓移植(BMT)和实体器官移植(SOT)后已有报道出现T大颗粒淋巴细胞增多(T-LGL)[3]。本研究回顾性分析了2010年1月—2021年12月在我中心接受异基因造血干细胞移植(allo-HSCT)后发生T-LGL的病例资料,并通过原发血液病的种类不同进行分类对比,分析不同血液病移植后发生T-LGL的临床特征及对预后的影响。
1 资料与方法
1.1 对象 回顾性分析2010年1月—2021年12月在苏州大学附属第一医院接受allo-HSCT后发生T-LGL的9 例患者的临床及实验室资料,其中除1 例急性淋巴细胞白血病(ALL)为骨髓移植外,余均为外周血造血干细胞移植,均为连续性病例资料。
1.2 方法
1.2.1 临床资料的收集:通过医院的电子病历系统收集查阅患者的信息资料,采集临床数据,包括疾病类型、性别、年龄、移植时间、血常规、骨髓检查、流式免疫分型、染色体核型、病毒学检测等。
1.2.2 T-LGL的诊断标准:满足以下至少两条标准:①移植后任意2~3 个月内至少连续3 次血常规中淋巴细胞计数>3 ×109/L;②任一次外周血流式免疫分型检测LGL比例>30%;③任一次TCR经PCR检测证实为单克隆重排。淋巴细胞持续增高的患者首次淋巴细胞计数>3 ×109/L定义为LGL起始时间,持续时间定义为淋巴细胞计数>3 ×109/L的持续时间[4]。
1.3 随访 随访时间截止至2021年12月31日,通过患者的住院记录、门诊就诊记录、电话沟通等方式,随访患者的生存情况,有无复发等。无病生存时间的计算是从移植当天至疾病进展、复发、死亡或最后随访时间。
1.4 统计学方法 描述性分析。计数资料以数量表示,非正态分布的计量资料采用范围表示。
2 结果
2.1 一般资料 共纳入9 例患者,男5 例,女4 例,中位年龄为28(17~54)岁,其中再生障碍性贫血(AA)1 例,急性髓系白血病(AML)3 例,ALL 4 例,急性杂合细胞白血病(HAL) 1 例,各组患者基本资料及移植相关信息见表1。
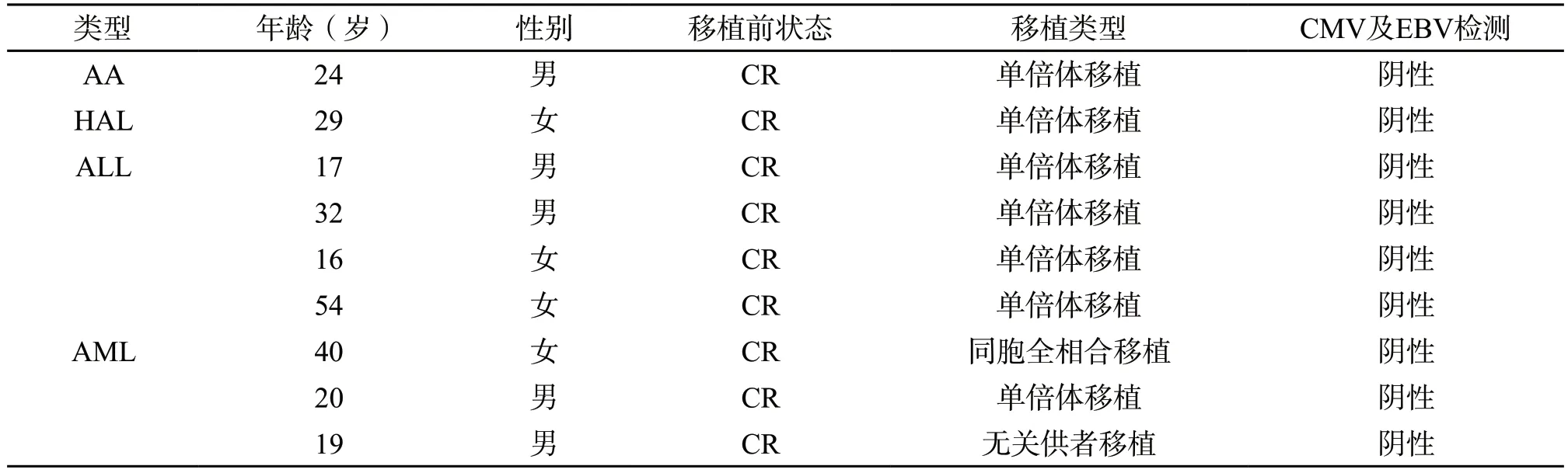
表1 9 例不同类型血液病移植后发生T-LGL患者的基本信息
2.2 不同类型血液病移植后T-LGL患者的临床特征分析 本研究涉及的9 例移植后T-LGL患者的临床及实验室特点见表2。移植后LGL起始时间不等,中位LGL起始时间AA为11.5 个月,HAL为1.3 个月,ALL为16.9(3.2~46.5)个月,AML为10.9(6.9~21.0)个月;中位T-LGL持续时间AA为45.2 个月,ALL为31.2(7.2~73.5)个月,AML为19.2(15.7~32.4)个月,HAL为26.3 个月,至随访终点,前三组均仍存在LGL。移植后首次发现T-LGL时骨髓涂片除1 例AML未检测外,余淋巴细胞百分比为6.5%~61%;流式外周血淋巴瘤分型除1 例ALL未检测外,余CD8+成熟大颗粒T淋均增高,为57.1%~92.3%;染色体核型分析除1 例ALL及2 例AML未检测外,大多数患者为未见异常表达,仅HAL患者为复杂异常;病毒学检查中CMV及EBV多次检测均为阴性;TCR基因重排除AA 1 例未检测外,其余8 例均呈阳性。移植前预处理方案均为改良BUCY,预防GVHD均为小剂量MTX;在移植前均处于完全缓解状态。在移植后各类血液病患者其中AML、AA、ALL 8 例均未出现血细胞减少相关症状和/或脾大、类风湿性关节炎及B症状,不满足WHO定义的T大颗粒淋巴细胞白血病(T-LGLL)的诊断标准,因而这三组均未进行干预治疗,HAL在移植后26.3 个月出现复发,复发后采用化疗及对症治疗。
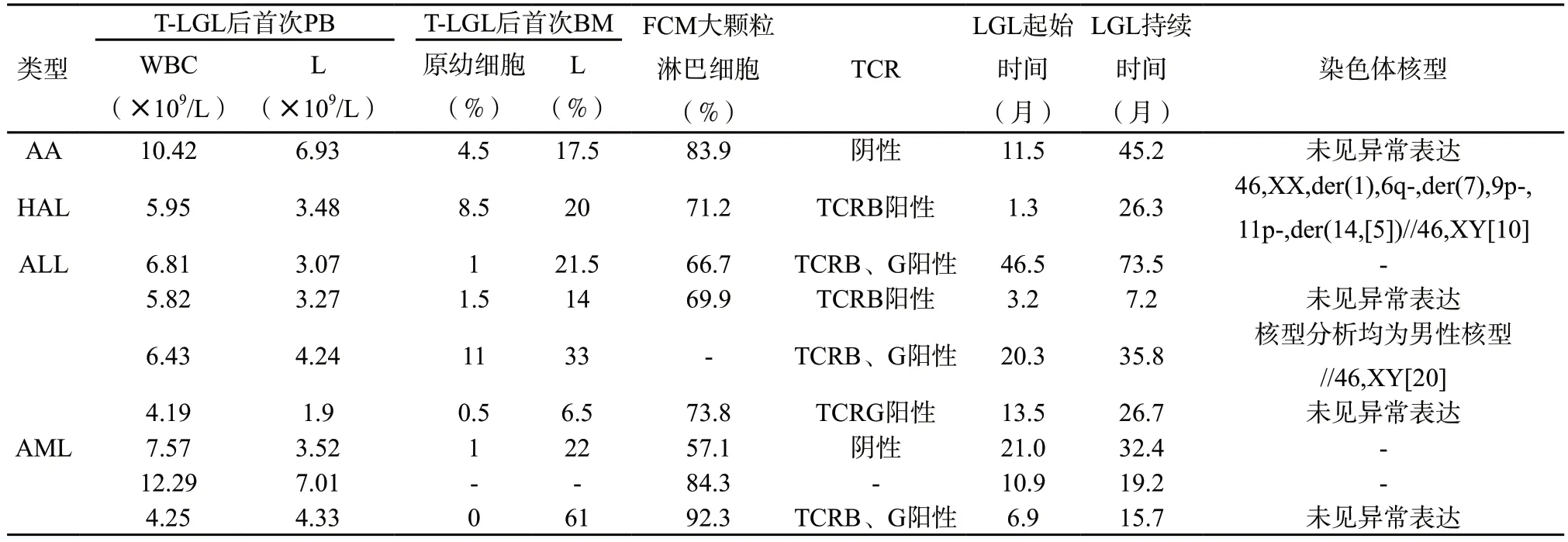
表2 9 例不同类型血液病移植后T-LGL的临床及实验室特点
2.3 不同类型血液病移植后T-LGL对预后的影响 截至2021年12月,共8 例患者无病生存,中位无病生存时间AA为45.2 个月,ALL为31.2(7.2~73.5)个月,AML为19.2(15.7~32.4)个月,HAL为26.3 个月,无病生存率为89%。HAL 1 例在移植后26.3 个月复发,TVP方案化疗未缓解后,进行CART治疗效果仍不佳最终死亡。
3 讨论
目前,越来越多的研究表明,恶性血液病患者移植后可发生T-LGL,而且它的发生与预后是密切相关的,但是关于它的发生率以及发生的相关因素在各项研究中尚未完全明确。
关于T-LGL的发生因素,国外相关研究表明移植后LGL增多可能与GVHD或病毒感染相关,特别是CMV的长期抗原刺激。LGL增多症在移植后早期发生严重的CMV再激活事件,移植后EBV血清学状态、CMV再激活和病毒感染等可能代表一种病理状态,其中慢性抗原刺激可能导致LGL增多[5]。移植后的免疫抑制治疗也是导致LGL增多的原因之一,免疫抑制的不良反应是使得防止淋巴增殖性疾病发展的先天防御机制的丧失,免疫抑制治疗也可导致CMV的重新激活,随后导致LGL增多。免疫抑制的强度和治疗方案带来的副作用可能是T-LGL进一步的危险因素[6]。
还有文章[7]认为T-LGL是移植后淋巴增殖性疾病(PTLD)的一种,从反应性多克隆自限扩增到寡/单克隆淋巴细胞增多甚至显性白血病,PTLD的发生机制是与EBV感染及EBV特异T细胞介导的免疫功能损伤相关。在正常情况下,EBV感染的B细胞受控于细胞毒T细胞,B细胞的生长与死亡均处于平衡的状态,一旦T细胞功能受损,这种平衡状态就会被打破,从而导致PTLD的发生,因而对于PTLD而言,EBV-DNA负荷测试是其早期诊断的特异性指标,连续监测该指标有利于PTLD的早期诊断。该文章得出的是无论T-LGL是否属于PTLD,是克隆性的还是非克隆性的,移植后T-LGL都应该被视为患者的一种潜在的积极免疫反应,而非真正的肿瘤过程。本研究纳入的9 例患者发生T-LGL均与CMV再激活、EBV血症及GVHD无关,原因是我们的研究数据偏少,需要更大的数据资料对此进行深入研究从而才能进一步验证LGL的发生相关因素。
关于移植后T-L G L 的发生机制,M e n d e s等[8]研究表明,部分患者移植后数月,可检测到CD57+CD8+CD28-T细胞亚群逐渐增多,CD28+CD57-T细胞亚群同时逐渐减少。移植后120 d内,患者免疫系统处于明显抑制状态,容易在感染源和同种异体抗原中暴露,反复面对免疫刺激,当感染源被激活,移植受者体内CD8+T淋巴细胞丢失表面的CD28分子,获得CD57表达,从而表现为T-LGL。
移植后T-LGL常与T-LGLL相鉴别,T-LGLL中约60%的患者可出现全身症状,包括与中性粒细胞减少相关的反复细菌感染、盗汗、乏力、体重减轻等[9]。常伴有自身免疫性疾病,如纯红细胞再生障碍性贫血、类风湿性关节炎、溶血性贫血、特发性血小板减少性紫癜、系统性红斑狼疮以及干燥综合征等。体征主要有肝脏肿大、脾脏肿大,而淋巴结肿大及肺浸润少见。而T-LGL在本研究中除1 例原发病复发外,其余均无明显的症状和体征。
在治疗方面,T-LGL在缺乏症状和体征时,我们是无需过度干预的,但对其克隆性仍然需要长期的随访和监测,从而确定LGL的来源,再考虑合适的干预措施,如停用免疫抑制剂或输注供体淋巴细胞。同时有研究[10]已经证实了STAT3突变在区别T-LGLL与其他成熟T细胞肿瘤和反应性T细胞增多方面具有诊断价值。在allo-HSCT相关的LGLL中,STAT3激活可以帮助识别LGLL和反应性T细胞增多[11],从而快速帮助我们分析以及制定相关治疗方案。
近年来,有文献[12]报道将移植后出现T-LGL与未出现T-LGL进行对比分析其临床特征及预后,他们首次发现单倍体/无关供者移植可作为移植后发生T-LGL的独立预测因素,而与免疫重建和T细胞调节机制相关的因素可作为其主要预测因素。
本研究中1 例HAL病例在发生LGL后复发,但因本研究病例数据较少,回顾性评估具有一定的局限性,并不能因此而得出HAL患者在接受allo-HSCT后发生T-LGL复发率高于其他血液病的结论。此例HAL患者虽然移植后出现了T-LGL,但其不同于其他类型血液病的特点为:①为混合表型白血病;②染色体核型分析为复杂异常。是否因以上因素影响了LGL发生后的预后尚有待进一步的研究。但目前的结果我们可以得出的是移植后T-LGL并不总是代表良好的预后。在国外一篇报道[13]中也提到受体来源的LGL增多可能通过攻击供体干细胞而导致晚期移植排斥反应。因此进一步评估还是非常有必要的,仍需要更多的研究来分析移植后T-LGL对长期预后的潜在影响。

