Siglec-15对胃癌细胞系MKN-45增殖和凋亡作用的影响
丁祥林,张光波,谢金晶
(1.苏州永鼎医院,江苏 苏州 215200;2.苏州大学附属第一医院临床免疫所,江苏 苏州 215006)
在全球胃癌确诊患者中,东亚国家人数约占一半,且胃癌一经发现常诊断为晚期[1-2],胃癌的发生和发展给社会造成了沉重的负担,这一癌症的诊断和治疗技术亟待提高[3],更好地了解胃癌发生发展的分子机制,探索新的标志性分子,并将其运用到免疫治疗和靶向治疗中,对胃癌的诊断和治疗具有重要意义。唾液酸结合免疫球蛋白样凝集素(Siglec)-15是免疫调节家族成员之一[4],在哺乳动物中具有高度保守性,其受体主要为抑制性受体,存在于造血系统的细胞上,包含受体酪氨酸抑制基序(ITIM),抑制免疫应答[5]。Siglec-15不仅能够维持破骨细胞的细胞形态和活性[6],也在抗肿瘤免疫中发挥着重要作用[7-8]。本文主要探究Siglec-15在胃癌进展中的分子机制,希望为治疗胃癌提供新的潜在治疗靶点。本研究经免疫组织化学和Western blotting实验发现Siglec-15在人肾癌组织标本及细胞系MKN-45中高表达,为进一步研究Siglec-15对胃癌细胞生物功能的影响以及存在的可能分子机制,通过慢病毒转染MKN-45建立Siglec-15低表达稳转细胞系进行体外实验,研究MKN-45细胞生物学功能变化,探究Siglec-15对胃癌细胞的作用机制,本次研究发现,Siglec-15能够促进肿瘤细胞增殖和抑制凋亡进程,促进肿瘤进展。
1 材料与方法
1.1 主要试剂和仪器 胎牛血清(Gibico,美国);RPMI 1640培养基、DMEM培养基、磷酸盐缓冲液(Hclycon,美国);青霉素-链霉素、胰蛋白酶消化液、细胞周期试剂盒(碧云天公司,中国);10% ExpressCast PAGE彩色凝胶快速试剂盒(新赛美公司,中国);RT-qPCR试剂盒(诺唯赞,中国);Annexin Ⅴ-PE细胞凋亡检测试剂盒(Becton,Dickinson and Company,美国);化学发光显影液(翊圣公司,中国);Siglec-15抗体(上海生工,中国);Apaf-1抗体、β-actin抗体(碧云天公司,美国);Caspase-3、Caspase-9抗体(Proteintech,美国)。CO2培养箱、酶标仪(Thermo,美国)、凝胶成像系统(BIO-RAD,美国)、实时定量PCR仪(Beckman,美国)。
1.2 细胞株 胃癌细胞株786-O购自中国科学院细胞库。
1.3 细胞培养 MKN-45细胞培养于10%胎牛血清+45% RPMI 1640+45% DMEM+1%青霉素-链霉素培养基中,37 ℃,5% CO2浓度培养箱中静置培养。
1.4 s h R N A 慢病毒表达载体 S i g l e c-1 5 及阴性对照组慢病毒由上海吉玛公司设计并合成,滴度:1×1 08T U/m L,慢病毒干扰载体为p G LV 2-U 6-P u r o-G F P Ve c t o r,序列:5'-GGGTTCTCCCGACAGGCTCAT-3'。
1.5 免疫组织化学实验 将石蜡切片机切好的组织进行融蜡、脱水以及洗涤处理,于柠檬酸盐缓冲液中水浴加热至100 ℃,时间3 min,使用PBST洗涤切片,免疫组化笔在组织周围圈出阻水范围,加入免疫抗原修复缓冲液,常温避光反应5 min,PBST洗涤,加入免疫封闭液,37 ℃孵育1 h,PBST洗涤,一抗4 ℃孵育18 h,PBST洗涤,二抗37 ℃孵育30min,PBST洗涤后滴加DAB染色液,使用苏木素复染,中性树脂封片,晾干后于正置显微镜下选取合适的视角拍照。免疫组织化学的评分标准根据四级评分进行。实验重复3 次以上。
1.6 Western blotting实验 使用含有10%磷酸酶抑制剂和蛋白酶抑制剂的细胞裂解液裂解对数生长期的细胞,收集细胞总蛋白,离心12 000 g,20 min后取上清,按照等比例与1×SDS上样缓冲液混合,95.5℃金属浴5 min使蛋白样品变性,根据每孔25 μg的上样量进行150 V恒压凝胶电泳,按照三层滤纸、电泳后的凝胶、PVDF膜以及三层滤纸的顺序放入转膜装置中,恒流转膜,5%脱脂牛奶水平摇床室温封闭2 h,一抗(Siglec-15、Apaf-1、caspase-3、p-PI3K等)水平摇床低速摇晃孵育3 h,TBST溶液洗涤,二抗水平摇床低速摇晃孵育1 h,膜上滴加化学发光试剂,凝胶成像系统记录结果。实验重复3次以上。
1.7 RT-qPCR实验 使用总RNA快速提取试剂盒提取细胞总RNA,检测细胞总RNA的纯度(OD=A260/A280),若RNA纯度值在1.9~2.0范围内,则可以用于后续cDNA的合成,使用诺唯赞RT-qPCR试剂盒,以GAPDH为内参,根据试剂盒说明书进行RT-qPCR,根据基因循环数分析目的基因的相对表达。实验重复3 次以上。
1.8 构建siglec-15低表达稳转MKN-45细胞株 将生长至85%左右的MKN-45细胞消化离心,调整细胞密度为1.0×104个/mL,加入2 mL细胞悬液至六孔板中,37 ℃培养箱中培养12 h,根据病毒滴度公式计算所需病毒体积(MOI=20)加入慢病毒,24 h后更换新鲜培养基,使用4 μg/mL嘌呤霉素进行阳性筛选,RT-qPCR和Western blotting实验验证病毒转染效率,获得Siglec-15低表达稳转细胞株(MKN-45-LV-sh-S15)和阴性对照组(MKN-45-LV-NC)。实验重复3 次以上。
1.9 CCK-8法检测细胞增殖能力 将MKN-45-LVsh-S15和MKN-45-LV-NC根据相同细胞数量接种于96孔板中,37 ℃培养箱中培养12 h后,分别于0、24、48、72 h四个时间点加入CCK-8试剂,培养条件下反应2 h后,使用450 nm波长酶标仪检测细胞吸光度值,细胞增殖率(%)=(处理组OD450-空白组OD450)/(对照组OD450-空白组OD450)×100%。实验重复3 次以上。
1.10 细胞克隆形成实验 将对数生长期的MKN-45-LV-sh-S15和MKN-45-LV-NC细胞消化离心,将细胞悬液进行梯度倍数稀释,以每孔600 个细胞的细胞密度接种于六孔板中。37 ℃培养箱中培养2~3周,期间观察细胞是否形成克隆,当培养板中出现肉眼可见的克隆时,对细胞克隆进行清洗、固定以及染色处理,拍照记录两组的细胞克隆数。实验重复3 次以上。
1.11 流式细胞术检测细胞凋亡和周期的变化 使用细胞凋亡试剂盒和细胞周期试剂盒检测MKN-45的Siglec-15稳定低表达组与对照组细胞的细胞周期和细胞凋亡效率,实验操作按照试剂盒说明书进行,流式细胞术检测细胞周期和凋亡情况并记录结果。实验重复3 次以上。
1.12 统计学方法 使用SPSS 26.0统计学软件、ImageJ以及GraphPad Prism 7.0进行数据分析处理,两组间比较采用非配对t检验,P<0.05表明差异具有统计学意义。
2 结果
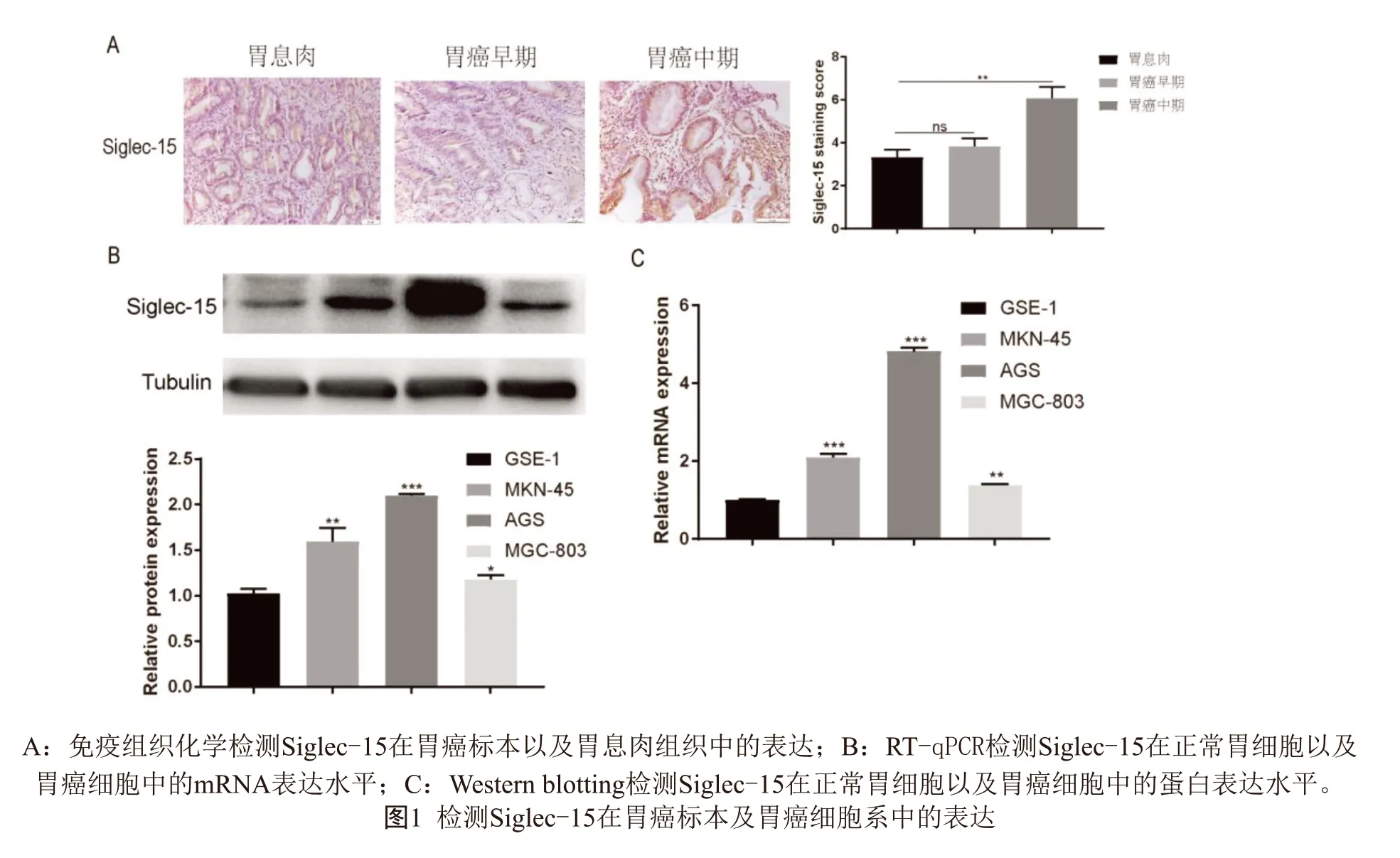
2.1 Siglec-15在胃癌标本及胃癌细胞系中的表达 免疫组织化学检测胃癌标本以及胃息肉中Siglec-15的表达发现(图1A,见封二),Siglec-15在胃癌中期组织中的表达高于胃息肉以及胃癌早期组织,差异具有统计学意义(P<0.05)。RT-qPCR和Western blotting检测正常胃细胞GSE-1和胃癌细胞系MKN-45、AGS以及MGC-803细胞中Siglec-15的表达发现(图1B,1C,见封二),相比正常胃细胞,Siglec-15在胃癌细胞中的mRNA以及蛋白水平表达升高,差异具有统计学意义(P<0.05)。其中,MKN-45细胞中Siglec-15的表达处于中等水平,因此使用该细胞系进行后续研究。
2.2 慢病毒载体构建Siglec-15低表达细胞株 使用慢病毒载体敲低MKN-45上Siglec-15的表达,空载体慢病毒作为对照组(阴性对照,LV-NC)。RT-qPCR检测Siglec-15 mRNA表达水平发现(图2A),MKN-45-LV-sh-S15组细胞中Siglec-15mRNA表达水平低于MKN-45-LV-NC组,差异具有统计学意义(P<0.05)。Western blotting实验检测Siglec-15蛋白表达水平发现(图2B),MKN-45-LV-sh-S15组中Siglec-15蛋白表达水平低于MKN-45-LV-NC组,差异具有统计学意义(P<0.05)。
2.3 Siglec-15对胃癌细胞系MKN-45增殖和细胞克隆形成的影响 使用CCK-8实验检测MKN-45细胞增殖能力的变化发现(图3A,见封二),MKN-45-LVsh-S15组细胞在24、48、72 h三个时间点的OD450明显低于MKN-45-LV-NC组,差异具有统计学意义(P<0.05)。细胞克隆形成实验检测细胞克隆率发现(图3B,见封二),MKN-45-LV-sh-S15组细胞的克隆数目低于MKN-45-LV-NC组,差异具有统计学意义(P<0.05)。结果表明敲减Siglec-15的表达,对MKN-45细胞的增殖和克隆形成能力具有抑制作用。
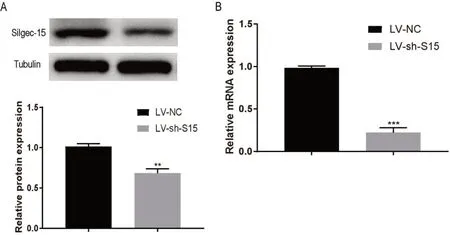
图2 构建Siglec-15分子低表达稳转细胞系
2.4 Siglec-15对胃癌细胞系MKN-45凋亡和细胞周期的影响 使用流式细胞术检测MKN-45细胞凋亡的变化发现(图4A),MKN-45-LV-sh-S15组细胞早期凋亡细胞百分率明显高于MKN-45-LV-NC组,差异具有统计学意义(P<0.05);MKN-45-LV-sh-S15组细胞晚期凋亡百分率与MKN-45-LV-NC组细胞相比差异无统计学意义(P>0.05)。PI染色法测定细胞周期发现(图4B),MKN-45-LV-sh-S15组细胞在G0/G1期所占百分比低于MKN-45-LV-NC组细胞,差异具有统计学意义(P<0.05);S+G2/M期MKN-45-LV-sh-S15组所占的百分率高于MKN-45-LV-NC组,细胞在S+G2/M期受到阻滞,差异具有统计学意义(P<0.05)。结果表明敲减MKN-45细胞上Siglec-15的表达,细胞凋亡水平升高。
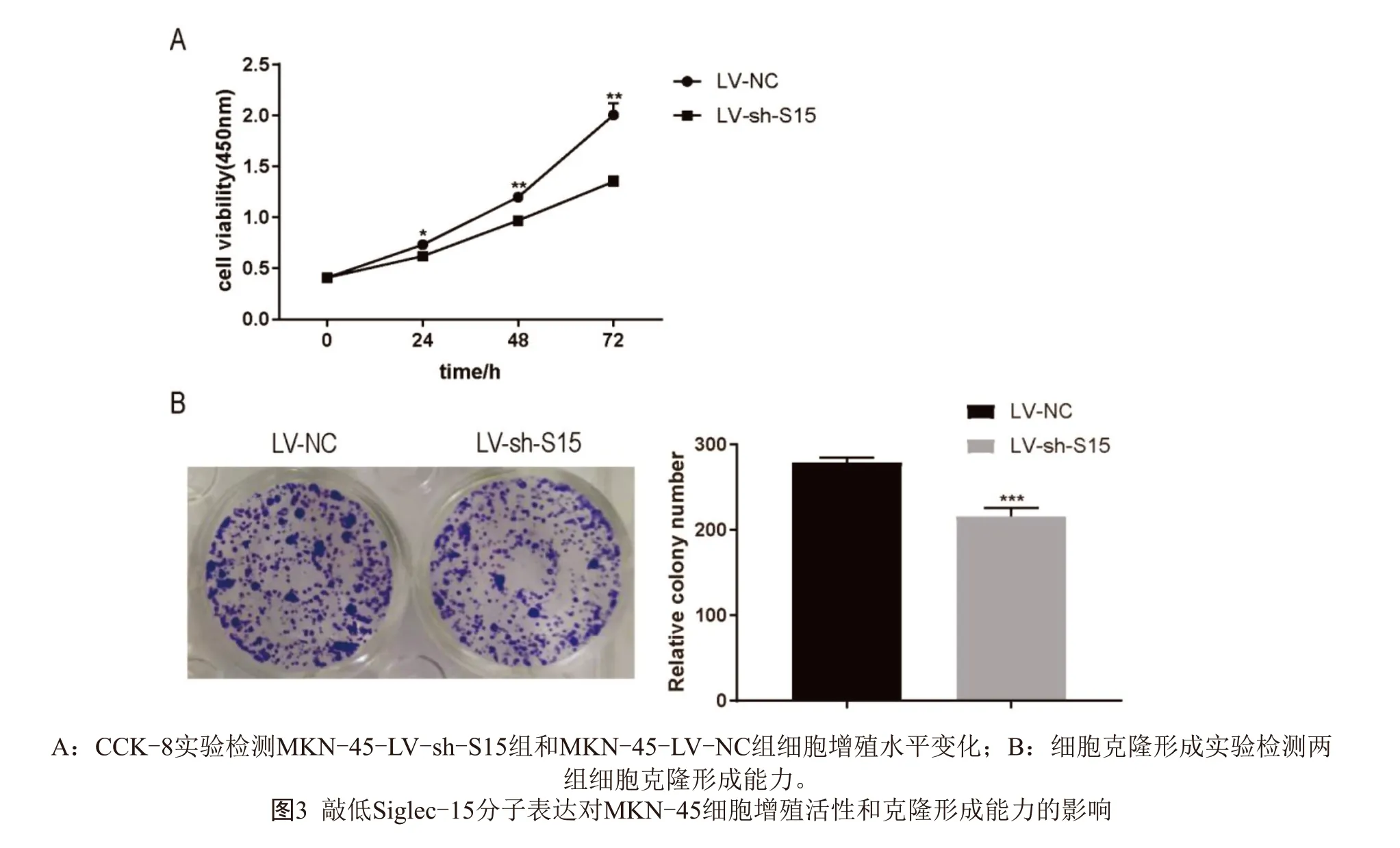
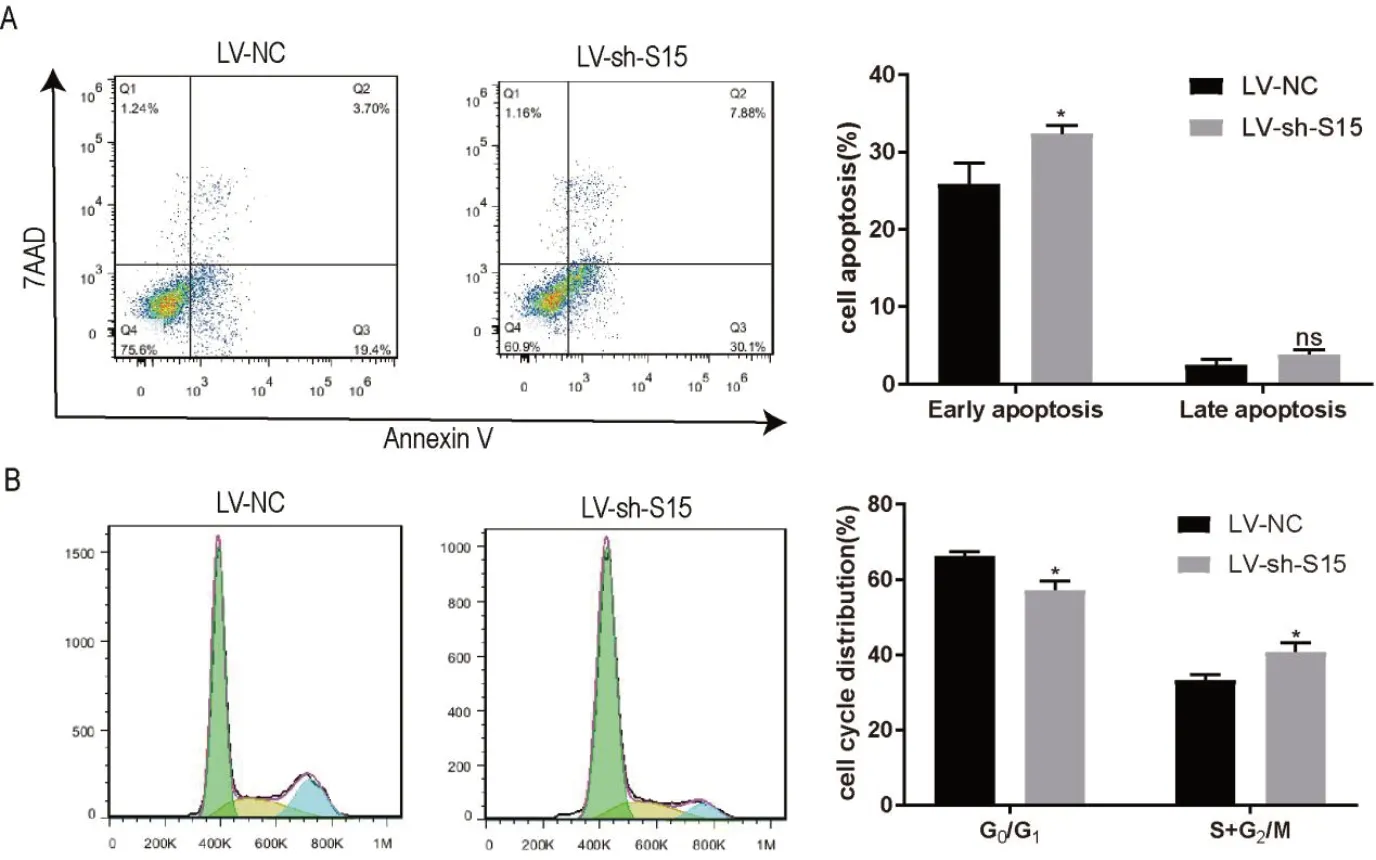
图4 敲低Siglec-15分子表达对MKN-45细胞凋亡和周期的影响
2.5 Siglec-15对MKN-45凋亡相关蛋白和信号通路相关蛋白表达的影响 Western blotting实验检测敲减MKN-45细胞上Siglec-15表达凋亡相关蛋白的表达发现(图5A),相比MKN-45-LV-NC组细胞,MKN-45-LV-sh-S15组中Apaf-1、Cleaved-caspase-3以及Cleaved-caspase-9的表达明显降低,差异具有统计学意义(P<0.05)。随后检测PI3K/AKT通路蛋白发现(图5B),MKN-45-LV-sh-S15组中PI3K和AKT的磷酸化水平明显低于MKN-45-LV-NC组,差异具有统计学意义(P<0.05)。实验结果进一步表明敲减MKN-45细胞上Siglec-15的表达能够诱导细胞凋亡,并且其调控可能有PI3K/AKT信号通路的参与。
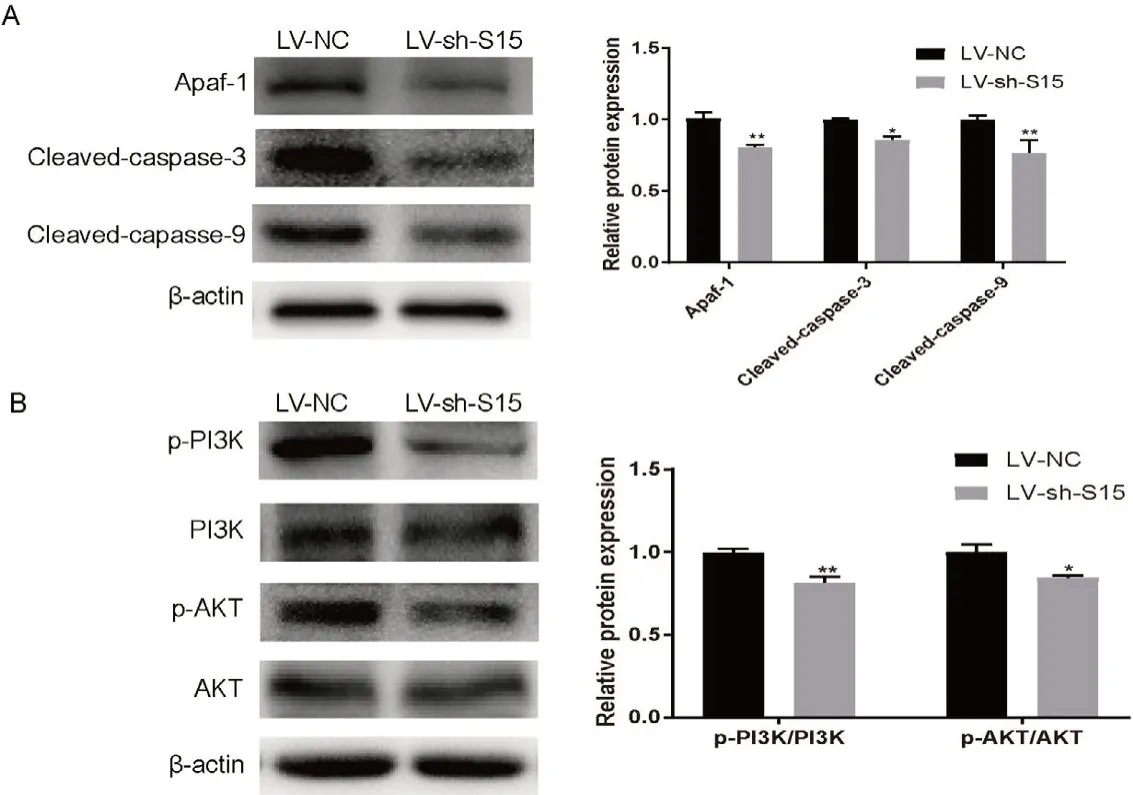
图5 敲低Siglec-15分子表达对MKN-45细胞凋亡相关蛋白和信号通路相关蛋白表达的影响
3 讨论
Siglec-15在2007年被Takashi等[9]发现和研究,又称为CD33L3和HsT1361。Siglec-15与其他Siglecs家族成员相比具有一定的差异性,最初发现其可以促进破骨细胞分化,维持细胞活性,是骨质疏松的治疗靶点之一[10-12]。但随后研究[7]发现,其胞外结构域与B7家族成员间存在20%左右的相似性,表明Siglec-15也可能具有免疫调节功能。进一步研究[13]发现,Siglec-15是免疫细胞上的膜表面受体,可以识别肿瘤细胞上的唾液酸聚糖,从而在肿瘤微环境中发挥抗肿瘤作用。Chen等[8]于2018年揭示了Siglec-15在肿瘤调控中的具体功能机制,Siglec-15可能是一种有效的免疫抑制分子,为未来肿瘤治疗提供了新的治疗靶点。另外,Siglec-15在多种恶性肿瘤细胞中过度表达,包括肝癌、肾癌以及肺癌等[9,14],但其具体作用模式并没有详细阐述,因此本文主要探究Siglec-15在胃癌细胞中的表达模式及作用机制,为胃癌的靶向治疗和免疫治疗提供新的切入点。
胃癌是世界上最致命的癌症类型之一,目前幽门螺杆菌感染是已知的诱发胃癌的主要原因之一[15-16],随着食品保鲜技术和幽门螺杆菌治疗技术的进步,胃癌的发生率逐年减少,但胃癌患者的康复率极低[17-18],且一经发现经常为晚期,患者的存活时间较短,目前的治疗方法有限,亟需具有针对性的精准有效的治疗靶标。通过免疫组织化学我们发现,相对于胃息肉以及胃癌早期组织标本,Siglec-15在胃癌中期组织标本中表达较高,认为Siglec-15在胃癌的进展过程中可以作为一种潜在的标志性分子参与肿瘤进展。随后我们通过构建慢病毒Siglec-15低表达稳转细胞株,探究Siglec-15对胃癌细胞生物学功能的影响,了解其在肿瘤进展中具体作用机制。胃癌目前仍是世界上的主要致死性癌症之一,晚期治疗主要依靠化疗方式以及放化疗结合的方式进行。随着科学技术的进步,靶向治疗以及免疫治疗逐渐成为人们的研究热点[19-21],如何减缓肿瘤进展是胃癌治疗过程中我们始终关心的问题,针对这一问题我们探究Siglec-15对胃癌细胞存活的作用机制,通过CCK-8实验、细胞克隆形成以及周期凋亡实验我们发现,Siglec-15对胃癌细胞的凋亡具有抑制作用,MKN-45细胞上敲减Siglec-15的表达后,凋亡相关蛋白Apaf-1以及Caspase-3、Caspase-9剪接体的表达降低,并且能够通过提高胃癌细胞增殖能力,促进胃癌进展。相关研究[22-23]发现,Siglec-15作为免疫调节分子,主要通过NF-κB信号通路,抑制免疫细胞活性,发挥抗肿瘤免疫作用。但我们进一步的信号通路探究发现,Siglec-15可能通过PI3K/AKT通路抑制肿瘤细胞的凋亡和促进细胞增殖能力,然而具体作用机制仍需要进一步的实验验证。
综上所述,敲减胃癌细胞系M K N-4 5 上Siglec-15的表达能够抑制肿瘤细胞的增殖和克隆形成能力,诱导细胞凋亡,并且这一过程可能存在PI3K/AKT信号通路的调控,但仍需进一步的实验进行验证其具体调控机制。

