普通青霉D12和罗伊氏乳杆菌发酵产物促进平邑甜茶幼苗生长和连作土壤生物环境改善
张 荣,黄君霞,段亚楠,王海燕,王 玫,陈学森,沈 向,尹承苗,毛志泉
(作物生物学国家重点试验室/山东农业大学园艺科学与工程学院,山东泰安 271018)
我国已成为名副其实的苹果生产大国[1]。随着苹果产业的不断发展,尤其是苹果新品种的不断更新以及矮化密植技术的推广,苹果连作障碍又称苹果再植病,成为我国苹果产区重茬栽培时普遍发生的一种综合病[2],具体表现为再植苹果幼树的根系不健康、生长慢、植株矮小、病虫害加重,严重时导致整树死亡[3],对苹果产业的可持续发展造成非常不利影响[4]。多数研究认为,连作障碍的发生与土壤微生物群落结构失衡有密切联系,最显著的表现为连作土壤中有害真菌数量的增加,有益细菌数量减少[3,5–7]。大量研究表明,镰孢属(Fusarium)真菌是苹果连作障碍中最常见的有害菌,在中国、南非、意大利等苹果产区普遍存在且生命力强[6,8]。徐文凤[9]和王功帅[10]分别从环渤海湾苹果产区的老苹果园以及连作苹果园土壤中分离到大量镰孢菌,通过致病性试验发现其对苹果砧木平邑甜茶幼苗有强致病性。因此,抑制病原菌数量,改善土壤的微生物群落结构对防控连作障碍具有重要意义[11–12]。
在土壤中引入生防菌来改善微生物环境,对苹果连作障碍进行生物防治是一种绿色环保的方式。在苹果连作障碍研究中,生防菌大多从健康苹果树根系及根际土壤中分离获得,细菌多为枯草芽胞杆菌和假单胞杆菌,真菌有丛枝菌根真菌、木霉和青霉[13],放线菌以链霉属为主[14–15]。混合微生物防治是一种生物防治的新思路新热点[16],前人研究表明生防菌的混合使用比单一使用效果更好。Hammad等[17]曾报道用放线菌和细菌联合可有效地防治黄瓜枯萎病。Latha等[18]研究表明绿色木霉 (Trichoderma viride)、荧光假单胞菌 (Pseudomonas fluorescens) 和枯草芽胞杆菌(Bacillus subtilis)的组合使用在防治土传病害的根腐病和茎腐病方面效果显著。
刘锦霞等[19]研究表明互不拮抗的生防菌 2种和土壤改良菌 3种,以一定比例有效结合于有机介质上制成多效微生物复合固体制剂,能够有效改良干旱区连作马铃薯土壤的生态环境,防控病害,促进植株生长,并提高产量和品质。李恩琛等[20]研究表明复合生防细菌发酵液对苹果主要病原菌抑制作用优于单一菌株,并且具有较好的稳定性。因此,利用多种微生物防治苹果连作障碍有巨大的潜力,加上发酵产物制作工艺简单,生产成本低,使用混合微生物发酵产物进行生物防治具有广阔的市场前景。
青霉属真菌和乳杆菌属细菌作为生防菌使用的研究较少[21],苏前富等[22]研究表明微黄青霉ZF1 可用于防治玉米禾谷镰孢茎腐病和穗腐病。有研究表明,乳杆菌属(Lactobacillus)不仅可以抑制灰霉属和镰孢属等真菌菌丝体和孢子的生长,还可以降解真菌毒素[23–24]。本研究将普通青霉D12和罗伊氏乳杆菌进行发酵,以苹果常用砧木平邑甜茶为试材,在盆栽试验条件下研究普通青霉D12和罗伊氏乳杆菌及其混合发酵产物对平邑甜茶幼苗和连作土壤环境的影响,探讨发酵产物对苹果连作障碍的防控效果,为生物防控苹果连作障碍提供理论依据。
1 材料与方法
1.1 试验材料
盆栽试验所用土壤取自山东省泰安市满庄镇 32年生的苹果园,从距离苹果树干80 cm、深 10—40 cm 的区域,多点随机取土,混匀。土壤质地为砂土,有机质含量为8.3 g/kg、硝态氮含量为11.76 mg/kg、铵态氮含量为5.76 mg/kg、速效钾含量为116.6 mg/kg、速效磷含量为 10.4 mg/kg、土壤 pH 5.66。
本研究供试材料为苹果常用砧木平邑甜茶(Malus hupehensis Rehd.)。2019年 1 月将用水浸泡过的种子与湿润细沙混匀,于 4℃左右层积处理 40天,待种子萌动露白后在育苗盘中播种育苗。于四月中旬选取有6片真叶且长势整齐无病虫害的幼苗移栽到外径 29 cm、内径 25 cm、高 18cm 的泥瓦盆中进行盆栽试验,每盆两株幼苗,统一肥水管理。
普通青霉 D12 (Penicillium commune D12)由苹果重茬与微生物实验室提供,其生物保藏号为CGMCC No. 11112。D12在PDA固体培养基接种活化7天,接种至PDA液体培养基,摇床125 r/min 25℃培养5天,即得D12发酵液,活菌数≥2×109CFU/mL,8层纱网过滤得上清液即D12发酵产物,于4℃保存。
罗伊氏乳杆菌(Lactobacillus reuteri)购自中国食品发酵工业研究院有限公司,保藏编号为CICC 6118。罗伊氏乳杆菌活化接入改良MRS培养基中,37℃条件下培养5天,即得罗伊氏乳杆菌发酵液,活菌数≥3×109CFU/mL,罗伊氏乳杆菌发酵液混匀至无沉淀,8000 r/min离心10 min,取上清液即得罗伊氏乳杆菌发酵产物,于4℃保存。
1.2 试验设计
试验设置4个处理:连作土壤对照(CK)、施用D12发酵产物 (R1)、施用罗伊氏乳杆菌发酵产物(R2)、两个发酵产物1∶1混合施用 (R3),每个处理20个重复。6月中旬按每盆80 mL施入相应的发酵产物,之后进行正常的肥水管理。各处理在施加相应发酵产物后第38天(7月23日)、69天(8月23日)、100天(9月23日)取样并测定相关指标,每个处理随机取3盆作为3个重复。取土样时,去除表层土,取根围土,混匀,过0.85 mm筛,制成3份平行样品,一份自然风干,用于测定土壤酶活性;一份用于测定微生物数量;一份存于 –80℃冰箱,用于提取DNA。取植株样品时,将根部土壤轻轻抖落,用清水冲洗根部,迅速取白根,放入液氮中,用于测定根系保护性酶活性。将植株完整带回,测定根系呼吸速率、株高、地径、鲜重,烘干至恒重后,测定干重。
1.3 测定指标
1.3.1 生物量使用卷尺、游标卡尺、天平测量株高、地径、鲜重及干重。
1.3.2 根系呼吸速率 (活力)参照毛志泉等[25]的方法使用Oxy-Lab 氧电极自动测定系统测定根系呼吸速率。
1.3.3 土壤酶活性脲酶活性测定采用比色法,过氧化氢酶测定采用滴定法,磷酸酶活性测定采用磷酸苯二钠比色法,蔗糖酶活性测定采用比色法[26]。
1.3.4 根系保护性酶活性和根系丙二醛含量超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)法,过氧化物酶(POD)活性的测定采用愈创木酚法,过氧化氢酶(CAT)活性的测定采用紫外吸收法,丙二醛含量的测定采用硫代巴比妥酸法[27]。
1.3.5 土壤中可培养细菌真菌数量细菌、真菌数量的测定采用稀释平板培养计数法[28]。细菌用LB培养基培养1天后计数,真菌用PDA培养基培养3天后计数。
1.3.6 土壤微生物测定从处理后第100天的土壤样品中取 0.25 g,用 MIO-BIO Power Soil DNA Isolation Kit土壤 DNA试剂盒按照试剂盒说明书所述步骤提取和纯化土壤微生物DNA。用1.2% 琼脂糖凝胶电泳对DNA样品进行检测,检测合格后进行双向测序,用真菌 ITS 区通用引物 ITS1-F (5′−CTT GGTCATTTAGAGGAAGTAA−3′) 和 ITS2-R(5′−GCTGCGTTCTTCATCGATGC−3′) 进行 PCR 扩增,设计目标区域和带有 “ 5′Miseq 接头-barcode-测序引物-特异引物-3′ ”的融合引物,并采用两步 PCR扩增的方法构建文库。用 2%琼脂糖凝胶电泳检测合格后,采用 AXYGEN 公司 AxyPrepDNA 凝胶回收试剂盒回收PCR产物。之后用FTC-3000TM real-time PCR 仪进行定量,将样本按照等摩尔比混匀后完成文库制备,使用Miseq测序仪将文库进行测序。
1.4 数据分析
根据 Barcode 序列和 PCR 扩增产物序列从原始序列中分出各样品数据,对其进行拼接及质控过滤,获得优化序列。利用软件USEARCH和mothur以 97%的一致性将拼接好的序列聚类为OTU。利用软件 mothur和QIIME对数据进行后续分析,利用R语言绘图。试验数据采用WPS 2019进行计算和作图,采用SPSS 20.0软件对数据进行单因素方差分析(one-way ANOVA)和差异显著性检验(邓肯氏法,α = 0.05)。
2 结果与分析
2.1 不同发酵产物对平邑甜茶幼苗生物量的影响
由表1可以看出,施用普通青霉D12和罗伊氏乳杆菌发酵产物后促进了平邑甜茶幼苗的生长,具体表现为R3>R1>R2>CK。发酵产物混合施用处理(R3)在促进平邑甜茶幼苗生长方面效果显著,其幼苗的株高、地径、鲜重、干重与连作对照相比均差异显著。施用微生物发酵产物后第100天,R1处理的幼苗株高、地径、鲜重、干重与对照相比分别增加了3.9%、14.78%、23.28%、18.96%;R2处理幼苗的地径、鲜重与干重与对照相比分别增加了14.36%、12.57%、13.75%;R3处理幼苗的株高、地径、鲜重、干重与对照相比分别增加了7.7%、17.4%、50.82%、37.5%。
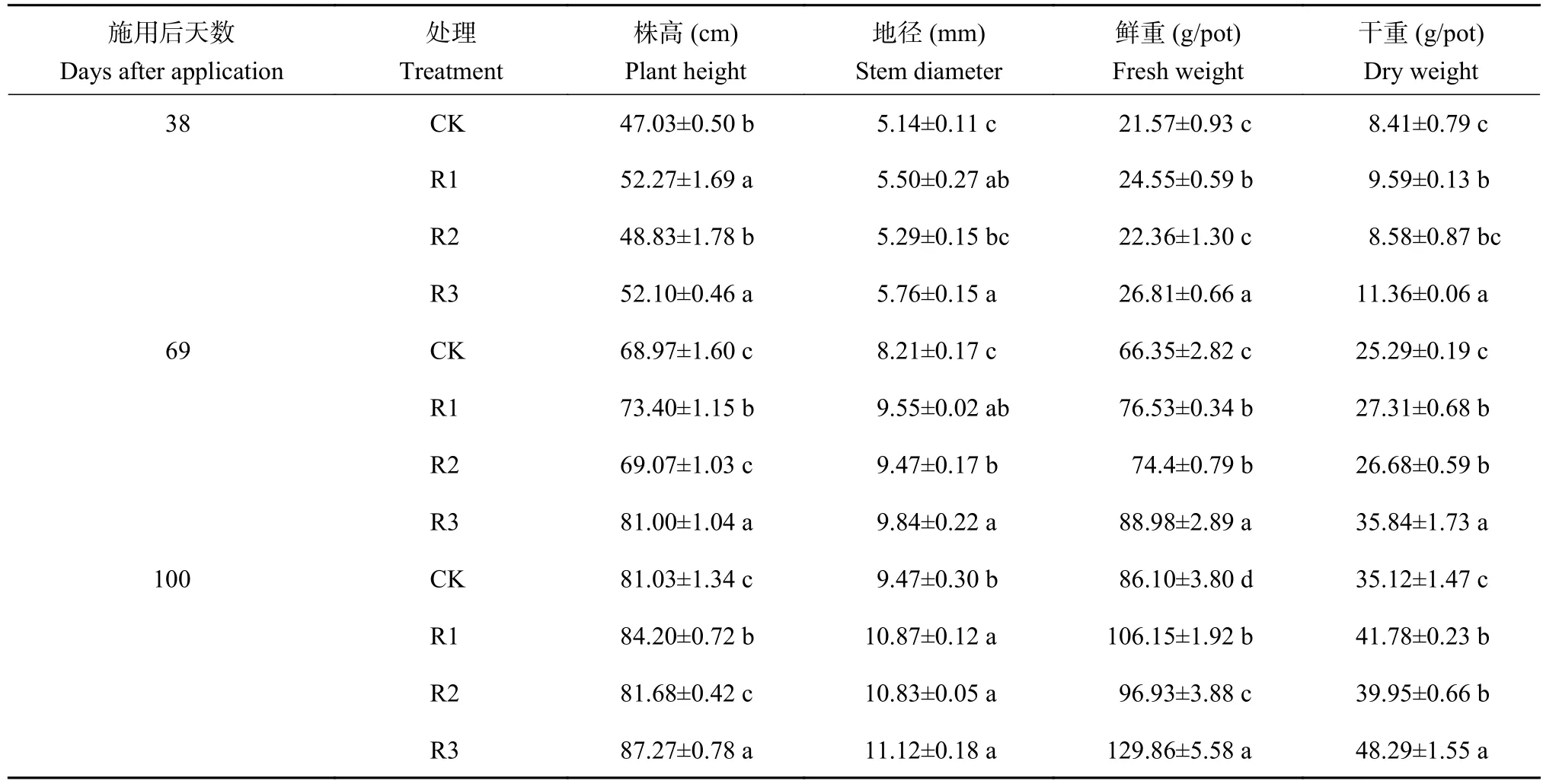
表1 施用发酵产物后不同天数平邑甜茶幼苗的生物量Table 1 Biomass of Malus hupehensis Rehd. seedlings in different days after application of fermentation products
2.2 不同发酵产物对平邑甜茶幼苗根系呼吸速率的影响
由图1可以看出,与连作对照相比,施加发酵产物的3个处理均促进了平邑甜茶幼苗的根系呼吸速率。第69天,R1、R2和R3处理差异不大,第38天和第100天R3处理平邑甜茶幼苗根系呼吸速率最高,与对照相比分别增加了19.20%、17.04%。
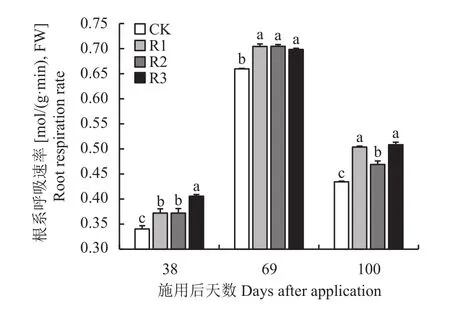
图1 施用发酵产物后不同天数平邑甜茶幼苗根系呼吸速率Fig. 1 Root respiration rate of Malus hupehensis Rehd.seedlings in different days after application of fermentation products
2.3 不同发酵产物对土壤酶活性的影响
由表2可知,与对照相比,施用发酵产物后土壤酶活性均有不同程度的提高。土壤过氧化氢酶活性,在第38天各处理与连作对照相比无显著差异;第69天差异显著,R1和R2显著高于CK,R3又显著高于R1和R2;第100天R1显著高于CK,R2和R3与CK差异不显著。土壤蔗糖酶活性,在第38天各处理显著高于连作对照。第38天脲酶活性和磷酸酶活性为R1和R3 处理显著高于CK;第69天,脲酶活性R1、R2和R3各处理显著高于CK,R1和R3 的磷酸酶活性显著高于CK;第100天,各处理脲酶活性、磷酸酶活性和蔗糖酶活性显著高于CK,其中R3处理与CK相比分别增加了66.67%、34.24%、25.49%。
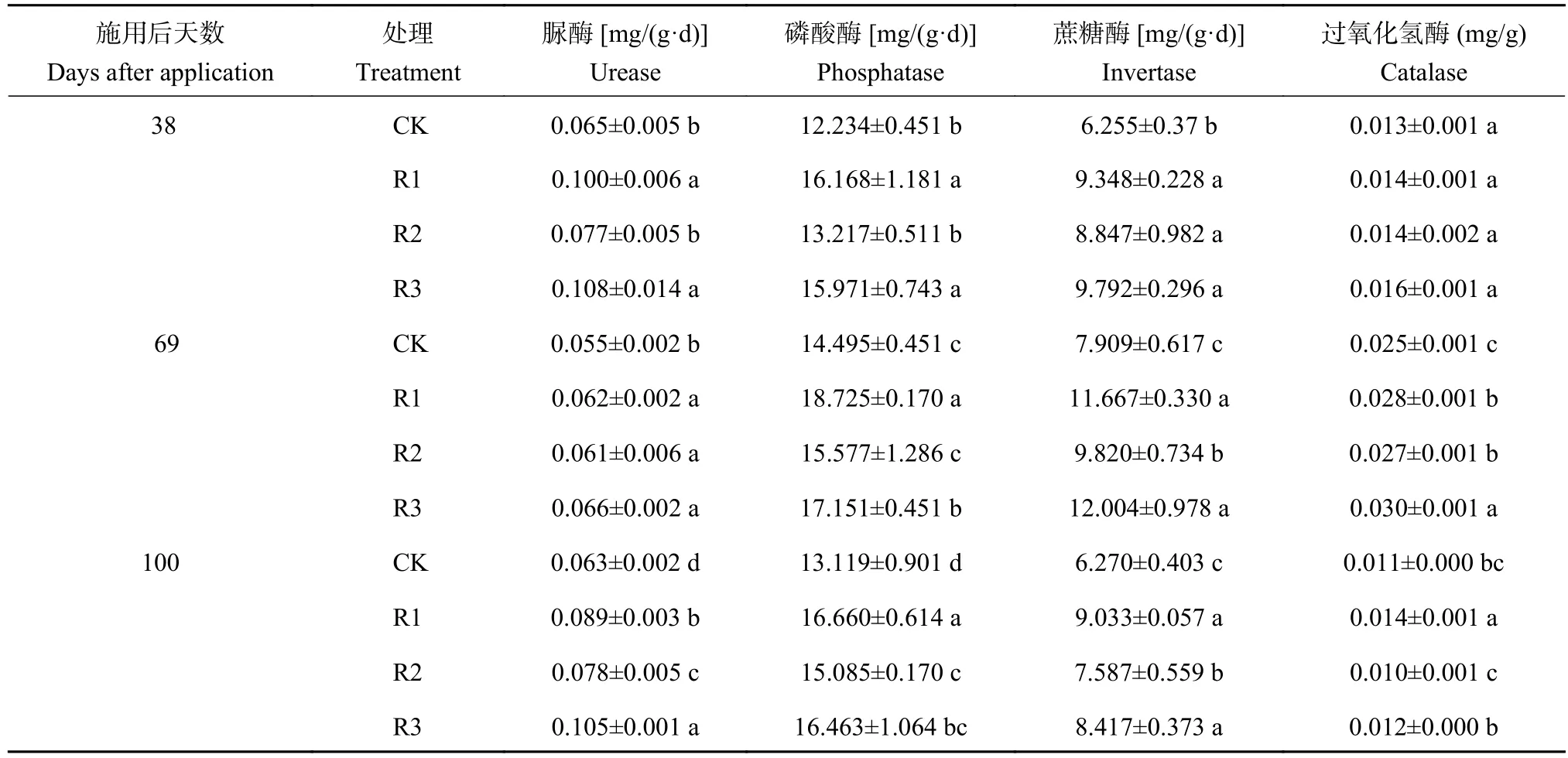
表2 施用发酵产物后不同天数土壤酶活性Table 2 Soil enzyme activities in different days after application of fermentation products
2.4 不同发酵产物对平邑甜茶幼苗根系保护性酶活性和根系丙二醛含量的影响
由图2可知,施用发酵产物后,平邑甜茶幼苗根系抗氧化酶活性均有不同程度的提高,其中以混合发酵产物处理(R3)促进效果最好。第100天,R1处理的幼苗SOD、POD和CAT活性与连作对照相比分别增加了7.25%、79.61%、27.69%;R2处理的幼苗SOD和POD与连作对照相比分别增加了13.25%、60.81%; R3处理的幼苗的SOD、POD和CAT活性与连作对照相比分别增加了29.19%、92.62%、39.59%,丙二醛含量降低了23.40%。

图2 施用发酵产物后不同天数平邑甜茶幼苗根系保护酶活性及丙二醛含量Fig. 2 SOD, POD, CAT activities, and MDA content in the roots of Malus hupehensis Rehd. seedling in different days after application of fermentation products
2.5 不同发酵产物对土壤中可培养微生物数量的影响
由表3可知,在施加发酵产物后,与连作对照(CK)相比,土壤中细菌数量显著增加,真菌数量显著降低。施用后第38天、69天和100天,普通青霉D12发酵产物处理(R1)土壤中细菌数量分别增加了38.18%、92.72%、94.20%,真菌数量分别降低了21.31%、29.63%、37.11%。罗伊氏乳杆菌发酵产物处理(R2)土壤中细菌数量分别增加了50.02%、59.79%、61.17%,真菌数量分别降低了40.44%、31.48%、28.06%。发酵产物混合处理(R3)土壤中细菌数量分别增加了39.48%、101.24%、81.56%,真菌数量分别降低了45.58%、32.09%、24.43%。
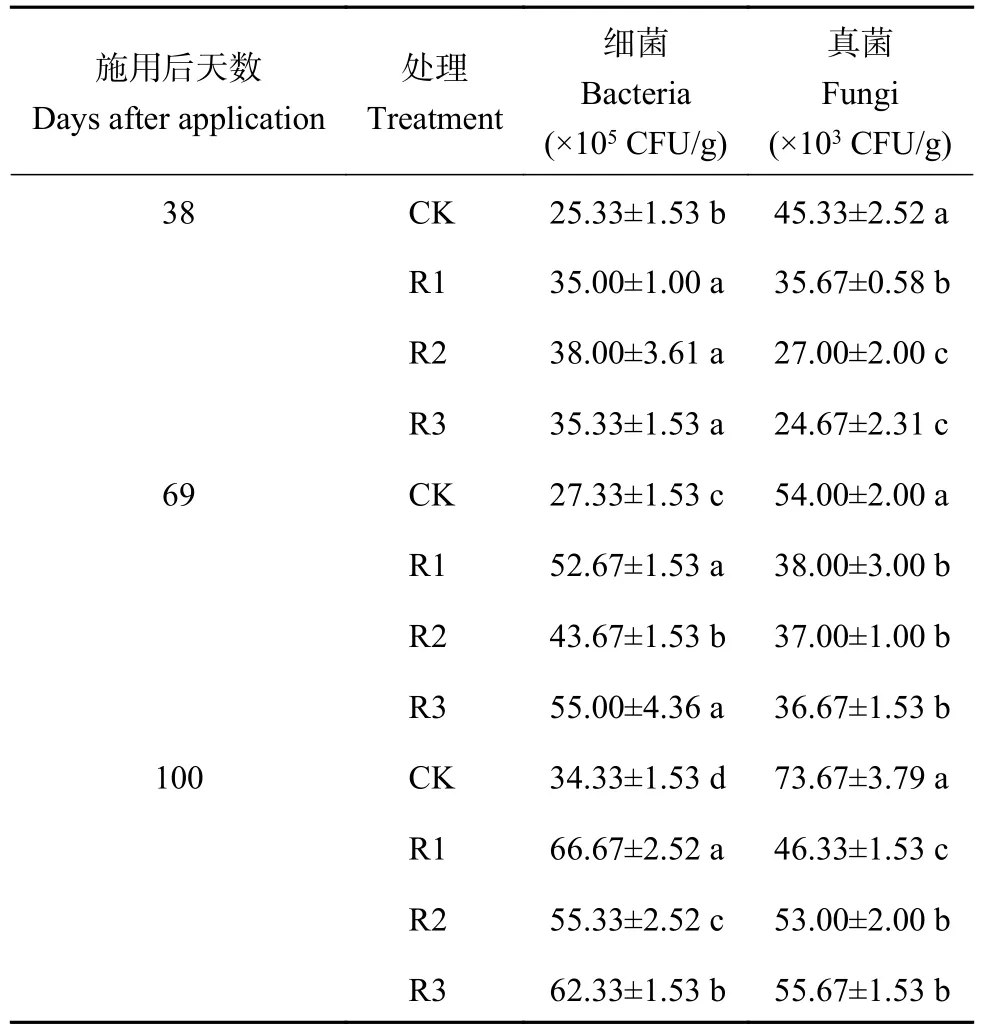
表3 施用不同发酵产物后不同天数土壤中的细菌和真菌数量Table 3 Population of bacteria and fungi in soils at different days after application of fermentation products
2.6 不同发酵产物对土壤微生物环境的影响
由图3主坐标分析结果可以看出,沿PC1轴方向,对照与3个发酵产物处理明显分开。沿PC2轴方向,单一发酵产物处理(R1、R2)与混合发酵产物处理(R3)明显分开。PCoA分析结果进一步表明,施用发酵产物对连作土壤真菌群落影响较大,并且单一发酵产物处理(R1、R2)与混合发酵产物处理(R3)对连作土壤真菌群落影响不同。
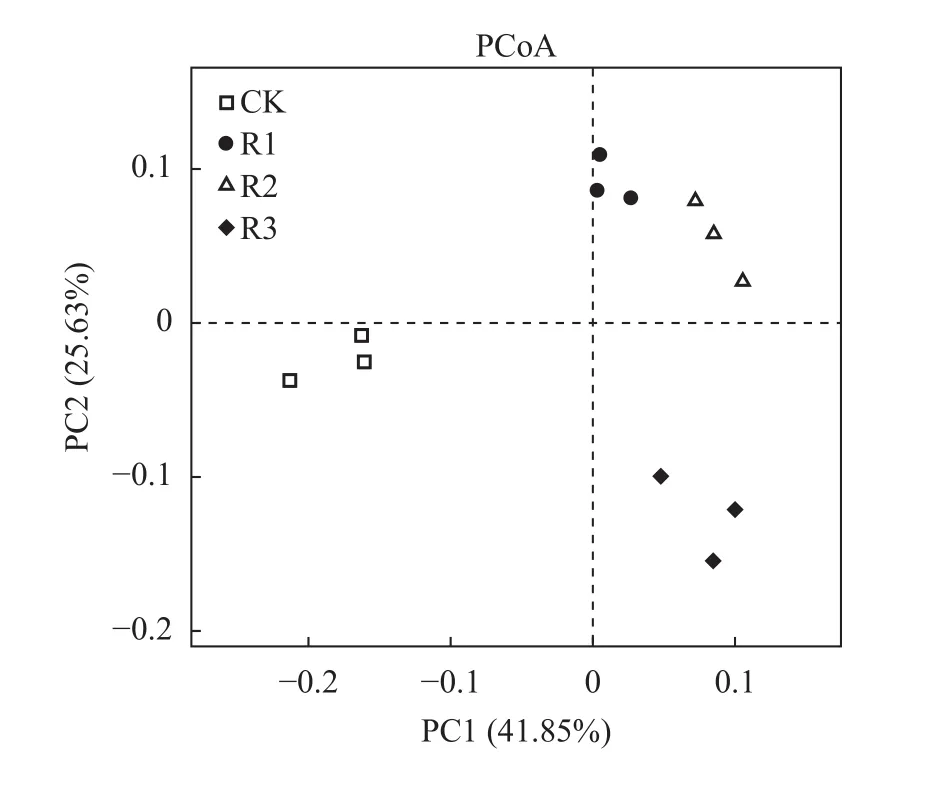
图3 施用不同发酵产物后土壤真菌群落主坐标分析Fig. 3 Principal coordinate analysis of soil fungi communities after application of different fermentation products
由图4聚类分析结果可以看出,连作对照(CK)单独一个分支说明施入发酵产物后土壤微生物群落发生改变,单一发酵产物处理(R1、R2)与混合发酵产物处理(R3)又分别处在不同的分支,说明单一发酵产物处理(R1、R2)与混合发酵产物处理(R3)对连作土壤真菌群落影响不同,与主坐标分析结果相一致。
在属水平,各处理土壤样品中相对丰度前8的属为未知Unclassified、腐质霉属Humicola、被孢霉属Mortierella、镰孢菌属Fusarium、链格孢属Alternaria、普鲁兰久浩属Guehomyces、枝孢菌属Cladosporium、矛束孢属Doratomyces(图 4)。与对照相比,施加发酵产物后,土壤中腐质霉属Humicola、被孢霉属Mortierella的相对丰度增加,镰孢菌属Fusarium、链格孢属Alternaria的相对丰度降低(表4)。与对照相比,发酵产物混合处理(R3)的土壤中腐质霉属Humicola、被孢霉属Mortierella的相对丰度分别增加了73.61%、137.72%,镰孢菌属Fusarium、链格孢属Alternaria的相对丰度分别降低了52.48%、73.35%。

表4 施用不同发酵产物后土壤属水平相对丰度(%)Table 4 Genus-level relative abundance of soils after application of different fermentation products

图4 施用不同发酵产物后土壤聚类分析和属水平相对丰度Fig. 4 Cluster analysis and genus-level relative abundance of soils after application of different fermentation products
2.7 平邑甜茶幼苗生理指标与土壤酶活性、可培养微生物数量和微生物群落的相关性
从图5可以看出,脲酶活性与平邑甜茶幼苗生物量、根系呼吸速率和根系保护性酶活性极显著正相关,细菌数量、磷酸酶和蔗糖酶活性与平邑甜茶幼苗生物量、根系呼吸速率和根系保护性酶活性显著正相关。真菌数量、镰孢菌属、链格孢属和枝孢菌属与平邑甜茶生物量、根系呼吸速率和根系保护性酶活性显著负相关,其中与平邑甜茶幼苗地径极显著负相关。被孢霉属与平邑甜茶幼苗地径显著正相关。普鲁兰久浩属与根系呼吸速率和根系过氧化物酶活性显著正相关。
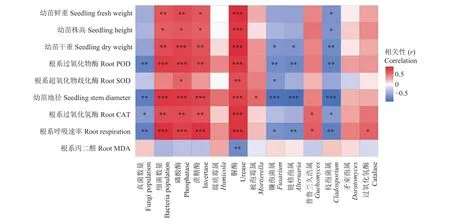
图5 Pearson相关性分析热图Fig. 5 Heat map of Pearson correlation analysis
3 讨论
连作障碍的发生是土壤养分失衡、有害微生物增加、土壤性质恶化、化感物质积累和微生物区系劣变等因素综合作用的结果[29],并且连作障碍最直观的表现就是植株的生长受到抑制。连作不仅抑制苹果根系生长,还影响根系功能。连作土壤中常含有酚酸类物质,当其积累到一定浓度会对作物根系造成逆境胁迫,根系中积累过多的自由基会导致膜脂过氧化,进而影响了膜的功能,降低了根系对营养元素和水分的吸收和运输,进而影响根系活力,并且根系受影响程度高于地上部分[30–32]。本研究表明施用发酵产物能显著地促进平邑甜茶幼苗的生长,其效果表现为:混合发酵产物处理(R3)>普通青霉D12发酵产物处理(R1)>罗伊氏乳杆菌发酵产物处理(R2)。并且施用发酵产物后平邑甜茶幼苗根系的呼吸速率显著提高,抗氧化酶活性均有不同程度的提高,丙二醛含量降低,其中混合发酵产物处理效果最佳。丛韫喆等[16]研究发现拟康氏木霉和黑根霉混合发酵液对苹果链格孢具有良好的抑菌效果,大田试验表明其混合发酵液能够提高苹果叶片防御相关酶SOD、POD以及PAL的酶活力,进而有效防治苹果斑点落叶病。周登博[33]研究表明,复合拮抗菌发酵液能降低香蕉枯萎病的发病率,且防病效果与酶活性呈正相关。可见发酵产物施入土壤后,改善了土壤环境,使得根系生长环境变得有利,根系呼吸速率、抗氧化酶活性提高,丙二醛含量降低,植株抗性增强,从而有利于植株的生长,有效地缓解了苹果连作障碍。
土壤酶参与土壤中复杂多样的生物化学反应,脲酶可催化水解土壤中的尿素产生氨,促使有机氮向植物有效态氮转化,蔗糖酶通过水解蔗糖提高土壤可溶性营养物质含量,在土壤碳素循环过程中起关键作用。土壤磷酸酶主要是催化水解加速土壤有机磷转化过程,而过氧化氢酶分解微生物体内的过氧化氢,减少毒害作用[34–35]。轻微的环境改变会使土壤酶活性发生变化,酶活性高低可以在一定程度上反映土壤养分转化能力和土壤供应植物根系养分的潜在能力[36–38]。研究表明,随连作年限增加,土壤中过氧化氢酶、脲酶、酸性磷酸酶和蔗糖酶活性均呈显著降低趋势,而施用活的微生物菌剂能够显著提高连作土壤中脲酶、磷酸酶、蔗糖酶和过氧化氢酶活性[39]。尤其是在熏蒸剂处理后,加入生物菌肥能够使土壤酶活性趋于恢复和提升,从而快速形成更利于植物生长的土壤微环境[40]。本研究中,施入发酵产物后,连作土壤中的脲酶、磷酸酶、蔗糖酶和过氧化氢酶活性均有不同程度的提高,这与刘丽英等[41]研究结果一致。与连作对照处理相比,普通青霉D12 发酵产物处理(R1)和发酵产物混合处理(R3)土壤中脲酶、磷酸酶和蔗糖酶的活性在施用发酵产物后都显著增加,而罗伊氏乳杆菌发酵产物处理(R2)后,蔗糖酶活性、脲酶和磷酸酶活性逐月依次提高。这可能是因为普通青霉D12 和罗伊氏乳杆菌发酵后发酵产物施入土壤发挥的作用不同所导致时效性的差异。其中发酵产物混合处理(R3)的效果最好,可能是因为普通青霉D12 和罗伊氏乳杆菌发酵产物混合后存在某些协同作用[42–44]。
诸多研究表明青霉菌生命力强,能够通过竞争营养和空间来限制病原菌的生长[45–47]。并且青霉菌能够产生丰富的次级代谢产物,包括聚酮类、生物碱类、萜类、大环内酯等,普遍具有抑菌活性[48]。有些青霉菌被证实具有一定的溶磷特性,且具有一定的促生效果[49]。乳酸菌作为公认的有益微生物,其代谢产生的活性物质被证明具有抗真菌活性,如有机酸、过氧化氢和细菌素,并且细菌素被认为是抗生素最有潜力的替代物,不同的乳酸菌所分泌的活性物质存在种类、数量和浓度上的差异,从而导致抑菌能力的差别[50–52]。现有研究报道,生防菌对苹果连作障碍具有一定防治效果。生防菌通过调节土壤微生态环境对苹果连作土壤中的病原菌有良好的抑制效果,能够改善土壤微生物群落结构,并且促生效果明显[53–57]。在本研究中,平邑甜茶幼苗地径和根系呼吸速率与土壤脲酶、磷酸酶和蔗糖酶活性极显著正相关,而与镰孢菌、链格孢菌和枝孢菌属存在负相关关系。土壤酶来源于微生物,微生物群落结构对植物生长有重要影响。连作会导致土壤的微生物群落结构破坏,由于病原菌如镰孢属真菌对不同的土壤条件具有高度的适应性,所以一旦其成功地在土壤中定殖就会不断积累,很难被彻底清除,土壤特性就会由细菌型向真菌型转变[10,58]。镰孢属(Fusarium)侵染根部后,会诱导导管堵塞,阻碍水分通过木质部的运输,导致苹果幼苗光系统损伤,还会产生毒素损害植物组织[59]。由PCoA分析和聚类分析结果可知,施用发酵产物对连作土壤真菌群落影响较大,并且单一发酵产物处理(R1、R2)与混合发酵产物处理(R3)对连作土壤真菌群落影响是不同的。连作土壤中可培养真菌数量显著降低,可培养细菌数量显著增加,镰孢属、链格孢属、枝孢菌属相对丰度降低,说明施入发酵产物100天中,连作土壤正逐步向有利的细菌型转变,施用发酵产物可以改善连作土壤微生物群落结构,使其往有利的方向发展。
4 结论
在土壤中添加普通青霉D12 发酵产物、罗伊氏乳杆菌发酵产物及其混合发酵产物均促进平邑甜茶幼苗生长,增强根系活力,提高土壤酶和根系保护性酶活性,降低丙二醛含量,可培养真菌数量显著降低,可培养细菌数量显著增加,镰孢属相对丰度降低,改善土壤微生物群落结构,使其往有利的方向发展,其中以普通青霉D12 和罗伊氏乳杆菌混合发酵产物处理效果最佳,可作为防控苹果连作障碍绿色有效的措施。

